【化学】山东省德州市2020届高三第二次模拟考试
山东省德州市 2020 届高三第二次模拟考试
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 S 32 C1 35.5 K 39 Cr 52 Cu 64
第 I 卷(选择题 共 40 分)
一、选择题:本题共 10 小题,每题 2 分,共 20 分。每小题只有一个选项符合题意。
1.化学与中华古文化密切相关,下列说法不正确的是( )
A.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为粘土
B.《墨子·天志》中记载:“书于竹帛,镂于金石”。其中的“金”指的是金属
C.《天工开物》中记载:“世间丝、麻、裘、褐皆具素质”,其中“丝、麻、裘”的主要成分都
是蛋白质
D.《周易参同契》中对汞的描述:“得火则飞,不见埃尘,将欲制之,黄芽为根。”黄芽为
硫磺
2.在指定条件下,下列各组离子一定能大量共存的是( )
A.滴加甲基橙显红色的溶液中:Na+、Fe2+、C1-、NO3-
B.0.1mol·L-1FeC13 溶液中:NH4+、Mg2+、SO32-、NO3-
C.0.1mo1·L-1KI 溶液中:Na+、K+、ClO-、OH-
D.由水电离的 c(H+)=1.0×10-13 mo1·L-1 的溶液中:K+、NH4+、C1-、HCO3-
3.X、Y、Z、W 为短周期主族元素。X、Z、W 形成的一种离子常用于检验 Fe3+,X、Y 形
成的化合物 YX3 常用作汽车安全气囊的气体发生剂,W 的单质在加热条件下可与 X、Z 的
最高价含氧酸反应。下列叙述正确的是( )
A.原子半径:Z>Y>W>X
B.简单氢化物稳定性:Z>X
C.W 形成的单质一定为原子晶体
D.ZO2 和 ZO3 中 Z 的原子杂化方式相同
4.设 NA 为阿伏加德罗常数的值。下列叙述正确的是( )
A.14gCO、N2 混合气体中共含有 7NA 个电子
B.常温下,0.1mol 环氧乙烷( )共有 0.3NA 个共价键
C.在含 CO32-总数为 NA 的 Na2CO3 溶液中,Na+总数为 2NA
D.氢氧燃料电池正极消耗 22.4L 气体时,负极消耗的气体分子数目为 2NA
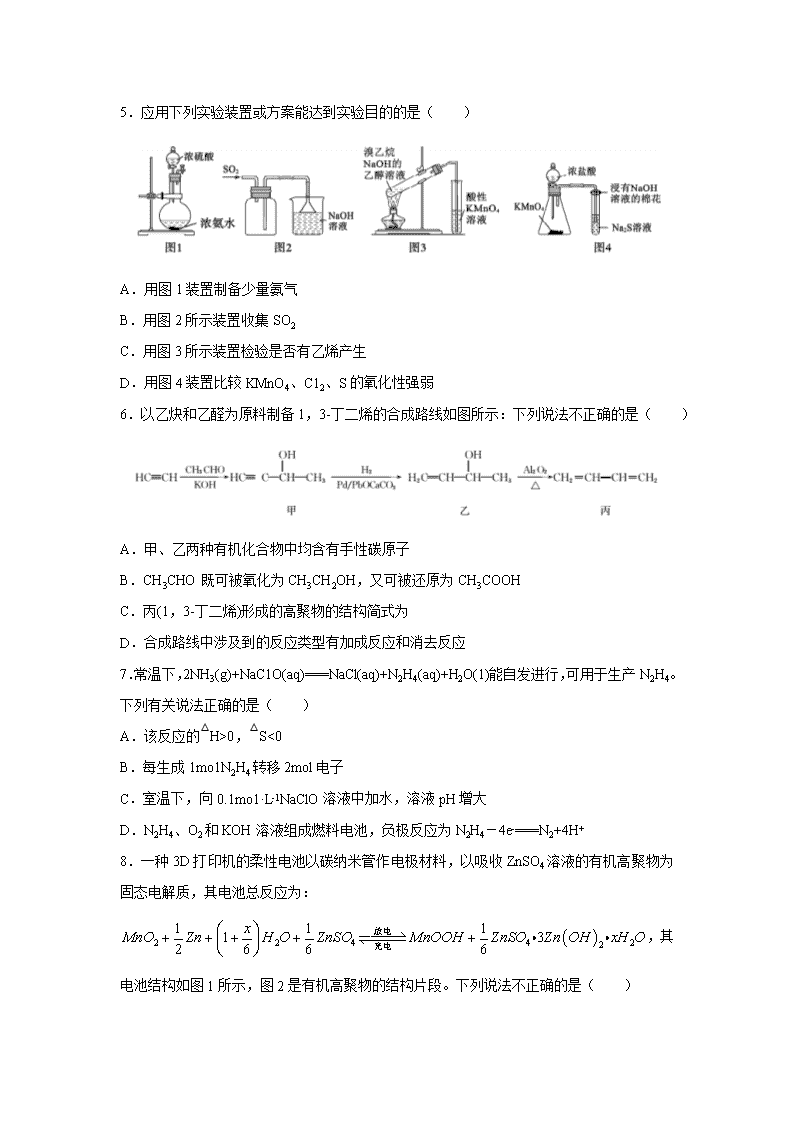
5.应用下列实验装置或方案能达到实验目的的是( )
A.用图 1 装置制备少量氨气
B.用图 2 所示装置收集 SO2
C.用图 3 所示装置检验是否有乙烯产生
D.用图 4 装置比较 KMnO4、C12、S 的氧化性强弱
6.以乙炔和乙醛为原料制备 1,3-丁二烯的合成路线如图所示:下列说法不正确的是( )
A.甲、乙两种有机化合物中均含有手性碳原子
B.CH3CHO 既可被氧化为 CH3CH2OH,又可被还原为 CH3COOH
C.丙(1,3-丁二烯)形成的高聚物的结构简式为
D.合成路线中涉及到的反应类型有加成反应和消去反应
7.常温下,2NH3(g)+NaC1O(aq)===NaCl(aq)+N2H4(aq)+H2O(1)能自发进行,可用于生产 N2H4。
下列有关说法正确的是( )
A.该反应的△H>0,△S<0
B.每生成 1mo1N2H4 转移 2mol 电子
C.室温下,向 0.1mo1·L-1NaClO 溶液中加水,溶液 pH 增大
D.N2H4、O2 和 KOH 溶液组成燃料电池,负极反应为 N2H4-4e-===N2+4H+
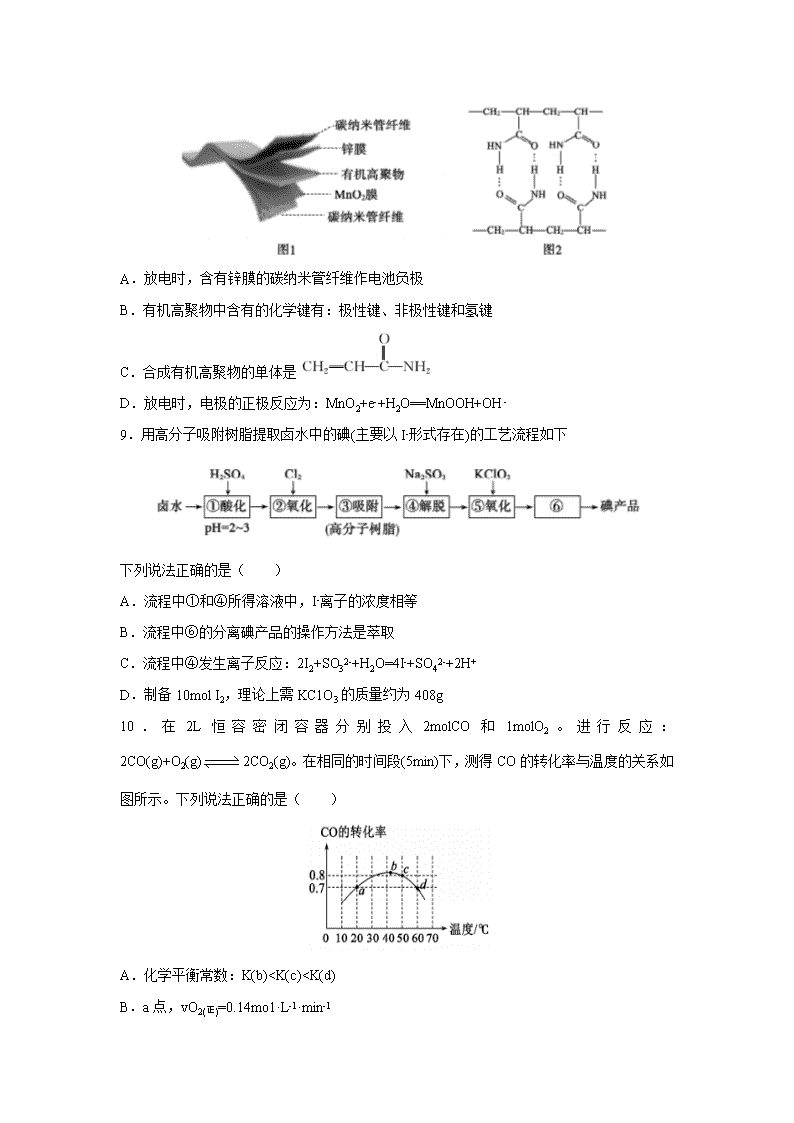
8.一种 3D 打印机的柔性电池以碳纳米管作电极材料,以吸收 ZnSO4 溶液的有机高聚物为
固态电解质,其电池总反应为:
,其
电池结构如图 1 所示,图 2 是有机高聚物的结构片段。下列说法不正确的是( )
( )2 2 4 4 22
1 1 11 32 6 6 6
xMnO Zn H O ZnSO MnOOH ZnSO Zn OH xH O + + + + +
放电
充电
A.放电时,含有锌膜的碳纳米管纤维作电池负极
B.有机高聚物中含有的化学键有:极性键、非极性键和氢键
C.合成有机高聚物的单体是
D.放电时,电极的正极反应为:MnO2+e-+H2O==MnOOH+OH-
9.用高分子吸附树脂提取卤水中的碘(主要以 I-形式存在)的工艺流程如下
下列说法正确的是( )
A.流程中①和④所得溶液中,I-离子的浓度相等
B.流程中⑥的分离碘产品的操作方法是萃取
C.流程中④发生离子反应:2I2+SO32-+H2O=4I-+SO42-+2H+
D.制备 10mol I2,理论上需 KC1O3 的质量约为 408g
10.在 2L 恒容密闭容器分别投入 2molCO 和 1molO2。进行反应:2CO(g)+O2(g)
2CO2(g)。在相同的时间段(5min)下,测得 CO 的转化率与温度的关系如图所示。下列说法正
确的是( )
A.化学平衡常数:K(b)
0
C. 随 pH 的升高而减小
D.在 NaHC2O4 溶液中 c(Na+)>(HC2O4-)>c(C2O42-)>c(H2C2O4)
第Ⅱ卷(非选择题 共 60 分)
三、非选择题:本题共 5 小题,共 60 分
16.(12 分)过氧化尿素(CO(NH2)2·H2O2)是过氧化氢水溶液与尿素的加和物,兼有尿素和过
氧化氢的性质,是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。某化
学小组同学用低浓度的双氧水和饱和尿素[CO(NH2)2]溶液在 30℃条件下用右图装置合成过
氧化尿素。请回答下列问题:
( )2 4lgc HC O−−
(1)仪器 X 的名称是______________;
(2)制备过氧化尿素的化学方程式为_________________________________________,反应时
采取的受热方式为_____________;
(3)搅拌器不能选择铁质材料的原因是________________________________________
(4)过氧化尿素中活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相
当于其中含 H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品 8.000g,溶解
于 水 , 在 250mL 容 量 瓶 中 定 容 , 准 确 量 取 其 中 25 . 00mL 溶 液 于 锥 形 瓶 中 , 加 入
1mL6mol·L-1H2SO4,然后用 0.2000mol·L -1KMnO4 标准溶液滴定样品中的 H2O2(KMnO4 溶
液与尿素不反应)。三次滴定平均消耗 KMnO4 溶液 20.000mL:
①请完善滴定时反应的离子方程式:__MnO4-+___H2O2+______==_______________
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量_______(填“偏高”、
“偏低”或“不变”);
③根据滴定结果确定产品质量_______(填“合格”或“不合格”),活性氧的质量分数为
_________。
17.(10 分)N、F、Cu 及其化合物在化工、医药、材料等方面应用十分广泛。回答下列有关
问题:
(1)N 原子中最高能级的电子的电子云轮廓图为___________;基态 Cu+的核外电子排布式为
____________。
(2)化合物(CH3)3N 可用于制备医药、农药。分子中 N 原子杂化方式为________,该物质能
溶于水的原因是_____________________。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,其阳离子的空间构型为_____________,写出一种与
[H2F]+互为等电子体的分子______________(写化学式)。
(4)氮、铜形成的一种化合物的晶胞结构如图所示。与每个 Cu 原子紧邻的 Cu 原子有____个,
令阿伏加德罗常数的值为 NA,该晶体的密度为______g/cm3。(列出计算式)
18.(12 分)二甲醚(CH3OCH3)是一种新型能源,被誉为“21 世纪的清洁燃料”。
(1)用 CO 和 H2 合成二甲醚的反应为:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)△H。
几种物质的相对能量如下:
△H=_______kJ·mo1。改变下列“量”,一定会引起△H 发生变化的是_____(填代号)。
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
(2)有利于提高反应中 CH3OCH3 产率的条件为_______(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)采用新型催化剂(主要成分是 Cu—Mn 的合金)制备二甲醚。催化剂中 n(Mn)/n(Cu)对合成
二甲醚的影响情况如下图所示。
当 n(Mn)/n(Cu)=2 时,二甲醚的选择性( )为 85.8%,此时
二甲醚的产率为_________。
(4)用二甲醚燃料电池电解法可将酸性含铬废水(主要含有 Cr2O72-)转化为 Cr3+。原理如下图:
① 燃 料 电 池 中 的 负 极 是 ______( 填 “M” 或 “N”) 电 极 。 电 解 池 阴 极 的 电 极 反 应 式 为
______________________________。
②消耗 6.9g 二甲醚时可处理 Cr 的含量为 26.0g·L-1 的废水 1L,该套装置的能量利用率为
___________。(保留 3 位有效数字)
19.(13 分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂。工业上利用
钼精矿(主要成分是 MoS2,含少量 PbS 等)制备钼酸钠的途径如图所示:
(1) Na2MoO4·2H2O 中钼元素的化合价是____________
(2)焙烧过程发生的主要反应为 MoS 2+O2→MoO3+SO2(未配平),该反应的氧化产物是
____________(填化学式)。
(3)碱浸时生成 Na2MoO4 和一种气体 A,该气体的电子式为________;沉淀时加入 Na2S 溶
液的目的是_____________________________________
(4)焙烧钼精矿所用的装置是多层焙烧炉,图 1 为各炉层固体物料的物质的量的百分数(φ)。
第 6 层焙烧炉中所得 MoO3 与 MoO2 的物质的量之比为___________
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介
质中的腐蚀速率实验结果如图 2:
①使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_______。
②随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是
__________________________________。
③空气中钼酸盐对碳钢的缓蚀原理是在碳钢表面形成 FeMnO4—Fe2O3 保护膜。密闭式循环
冷却水系统中的碳钢管道缓蚀,除需要加入钼酸盐外还需加入 NaNO2。则 NaNO2 的作用是
_____________________________
20.(13 分)有机物 I( )是一种新型感光高分子化合物,工业合成 I 的路
线如下:
已知:同一个碳原子上连接有 2 个羟基时,自动脱去一个水分子。请回答下列问题:
(1)有机物 C 中官能团名称_________。反应①的化学反应类型为______________
(2)反应④的化学方程式为:_______________________________________________
(3)反应⑤除生成 H 外,还生成一种能与碳酸氢钠反应放出气体的有机化合物 M,M 的结构
简式为:_______________________
(4)X 是 H 的芳香族同分异构体,1molX 与足量银氨溶液反应时可得到 4molAg。则 X 共有
__________ 种 。 写 出 一 种 核 磁 共 振 氢 谱 有 4 组 峰 的 同 分 异 构 体 的 结 构 简 式
_____________________。
(5)参照上述合成路线。设计以乙醇和乙炔为原料制备 CH3CH=CH—COOCH=CH2 的流程图。
________________________________________________________________________
【参考答案】
一、选择题:本题共 10 小题,每题 2 分,共 20 分
1.C 2.B 3.D 4.A 5.D 6.B 7.B 8.B 9.D 10.D
二、选择题:本题共 5 个小题,共 20 分
11.BD 12.A 13.BC 14.C 15.BC
三、非选择题:本题共 5 小题,共 60 分
16.(12 分,除标注外每空 2 分)
(1)球形冷凝管(1 分)
(2)CO(NH2)2+H2O2==CO(NH2)2·H2O2 水浴加热(1 分)
(3)2Fe+3H2O2+6H+==2Fe3++6H2O,生成的金属离子能催化过氧化氢的分解;
(4)①2MnO4-+5H2O2+6H+==2Mn2++8H2O+5O2↑ ②偏高(1 分)
③合格(1 分) 20%
17.(10 分,除标注外每空 2 分)
(1)哑铃形或纺锤形;(1 分)[Ar]3d10 或 1s22s22p63s23p63d10(1 分)
(2)sp3;(1 分)(CH3)3N 为极性分子,且可与水分子形成分子间氢键(1 分)
(3)V 形;(1 分)H2O 或 H2S(合理即可)(1 分)
(4)8;
18.(12 分,除标注外每空 2 分)
(1)-253.4 D
(2) B (1 分)
(3)61.8%
(4)①M(1 分) Cr2O72-+6e-+14H+===2Cr3++7H2O ②83.3%
19.(13 分,除标注外每空 2 分)
(1)+6(1 分)
(2)MoO3 和 SO2
(3) 除去 Pb2+离子
(4)1:3(1 分)
(5)①1:1(1 分)
②C1 有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于
硫酸;
③替代空气中氧气起氧化剂作用
20.(13 分,除标注外每空 2 分)
(1)酯基(1 分) 加成反应(1 分)
(2)
(3)CH3COOH
(4)10