【化学】西藏山南市第二高级中学2020届高三下学期第一次模拟考试
西藏山南市第二高级中学2020届高三下学期第一次模拟考试
相对原子质量 H-l C-12 N- 14 O-16 Na-23 Mg-24 S-32 Fe-56 Cu-64
7.生活处处有化学,下列说法正确的是( )
A.制饭勺、饭盒、髙压锅等的不锈钢是合金
B.做衣服的棉和麻均与淀粉互为同分异构体
C.煎炸食物的花生油和牛油都是可皂化的饱和酯类
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
8. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温下,23 g NO2含有NA个氧原子
B.1 L 0. 1 mol·L-1的氨水含有 0.1 NA个OH-
C.常温常压下,22.4LCCl4含有个NA个CC14分子
D.1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
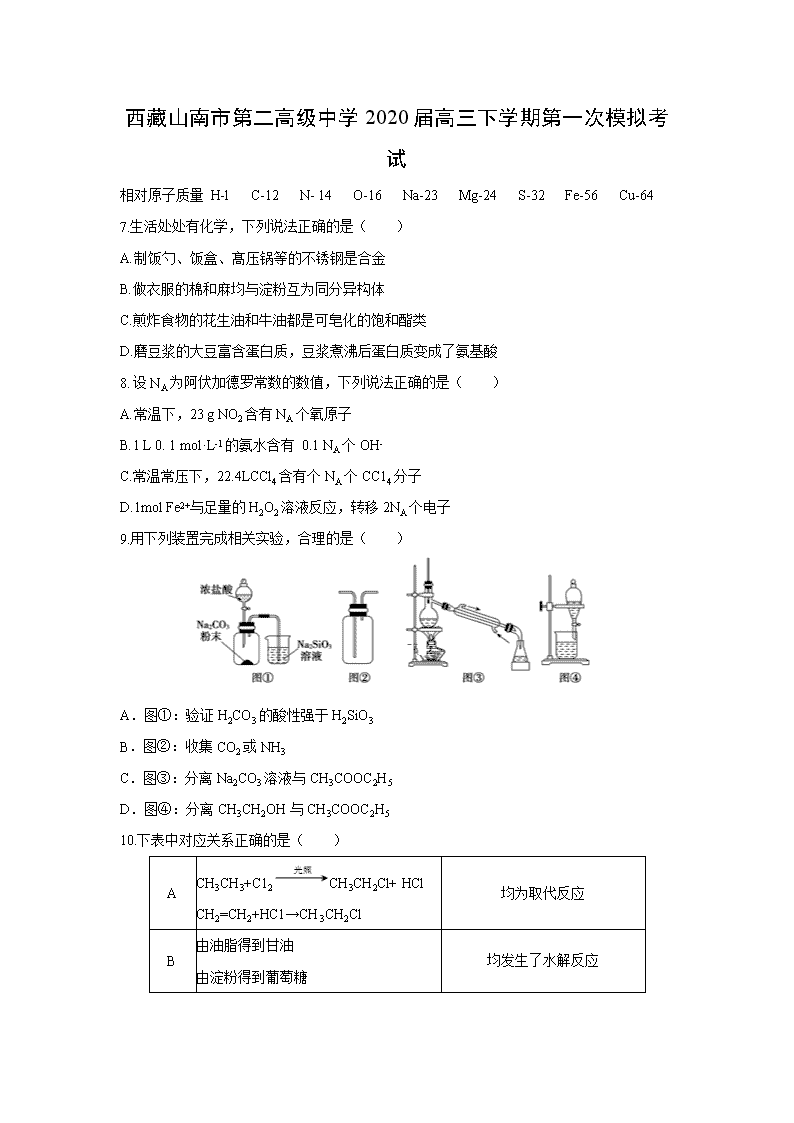
9.用下列装置完成相关实验,合理的是( )
A.图①:验证H2CO3的酸性强于H2SiO3
B.图②:收集CO2或NH3
C.图③:分离Na2CO3溶液与CH3COOC2H5
D.图④:分离CH3CH2OH与CH3COOC2H5
10.下表中对应关系正确的是( )
A
CH3CH3+C12CH3CH2Cl+ HCl
CH2=CH2+HC1→CH3CH2Cl
均为取代反应
B
由油脂得到甘油
由淀粉得到葡萄糖
均发生了水解反应
C
Cl2+2Br-=2Cl-+Br2
Zn+Cu2+=Zn2++Cu ’
均为单质被还原的置换反应
D
2Na2O2+2H2O=4NaOH+O2↑
C12+H2O=HC1+HC1O
均为水作还原剂的氧化还原反应
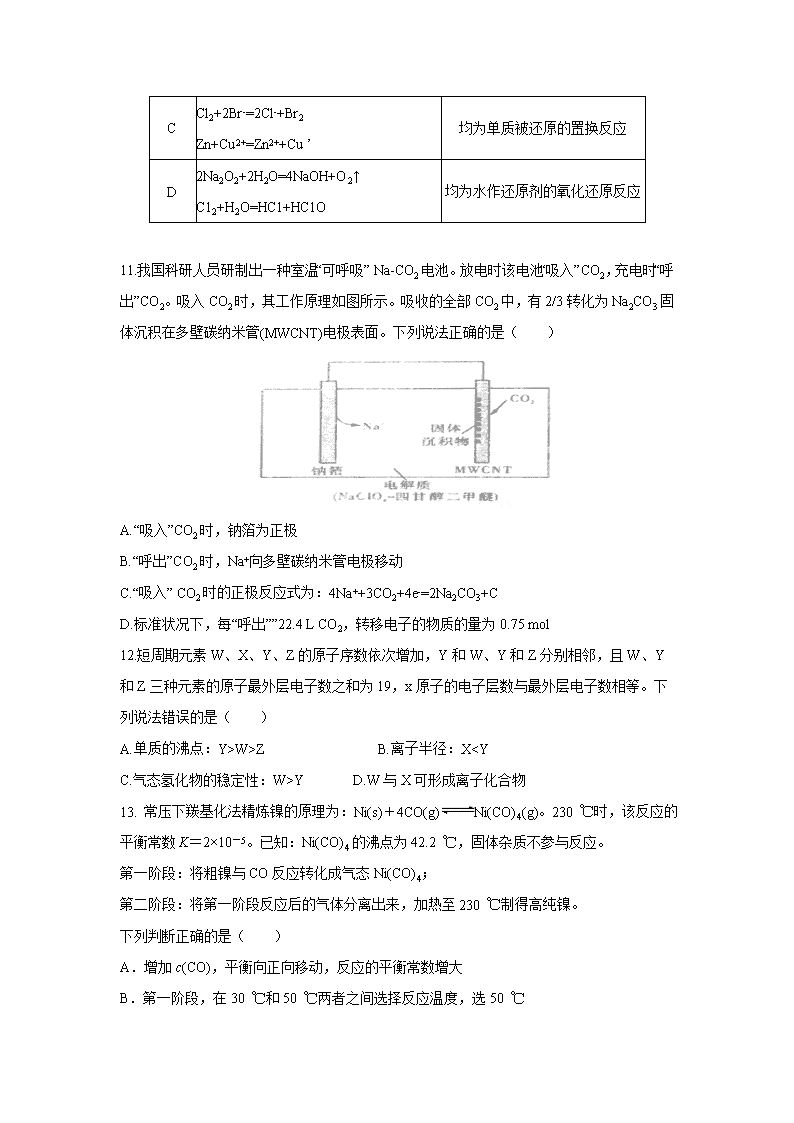
11.我国科研人员研制出一种室温“可呼吸” Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是( )
A.“吸入”CO2时,钠箔为正极
B.“呼出”CO2时,Na+向多壁碳纳米管电极移动
C.“吸入” CO2时的正极反应式为:4Na++3CO2+4e-=2Na2CO3+C
D.标准状况下,每“呼出””22.4 L CO2,转移电子的物质的量为0.75 mol
12.短周期元素W、X、Y、Z的原子序数依次增加,Y和W、Y和Z分别相邻,且W、Y和Z三种元素的原子最外层电子数之和为19,x原子的电子层数与最外层电子数相等。下列说法错误的是( )
A.单质的沸点:Y>W>Z B.离子半径:X
Y D.W与X可形成离子化合物
13. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30 ℃和50 ℃两者之间选择反应温度,选50 ℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
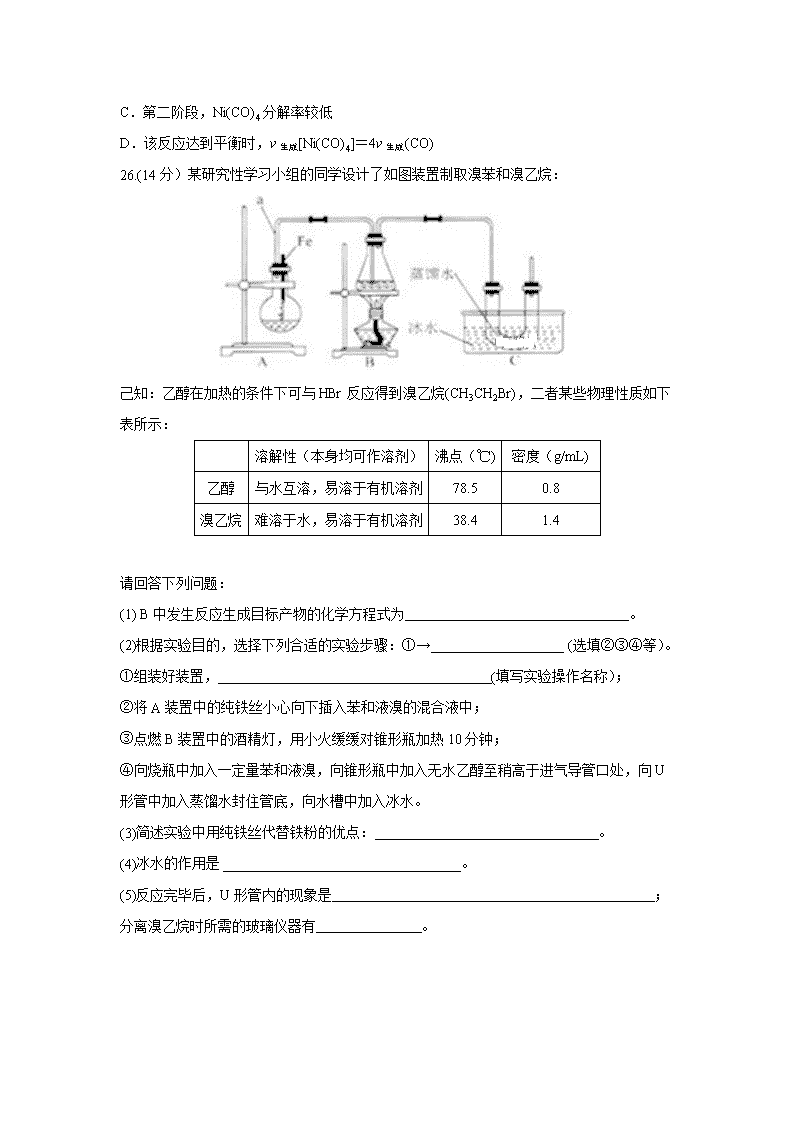
26.(14分)某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
己知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂)
沸点(℃)
密度(g/mL)
乙醇
与水互溶,易溶于有机溶剂
78.5
0.8
溴乙烷
难溶于水,易溶于有机溶剂
38.4
1.4
请回答下列问题:
(1) B中发生反应生成目标产物的化学方程式为 。
(2)根据实验目的,选择下列合适的实验步骤:①→ (选填②③④等)。
①组装好装置, (填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溴的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液溴,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸馏水封住管底,向水槽中加入冰水。
(3)简述实验中用纯铁丝代替铁粉的优点: 。
(4)冰水的作用是 。
(5)反应完毕后,U形管内的现象是 ;分离溴乙烷时所需的玻璃仪器有 。
27. (18分)硫酸亚铁晶体俗称绿矾(FeSO4 • 7H2O),重铬酸钠晶体俗称红矾钠(Na2Cr2O7·2H2O),它们都是重要的化工产品。工业上以铬铁矿[主要成分是[Fe(CrO2)2]为原料制备绿矾和红矾钠的工艺流程如图所示。
请回答下列问题:
(1)已知Fe(CrO2)2中铬元素的化合价为+3价,则Fe(CrO2) 2中铁元素的化合价为 。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(3)煅烧铬铁矿时,矿石中的Fe(CrO2)2转变成可溶于水的Na2CrO4,反应的化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 2Fe2O3+8Na2CrO4+8CO2
①该反应中还原剂与氧化剂的物质的量之比为 。
②为了加快该反应的反应速率,可采取的措施是 (填一种即可)。
⑷己知CrO42-在氢离子浓度不同的酸性溶液中有不同的反应。如:
2CrO42-+2H+=Cr2O72-+H2O 3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是 。
②混合溶液乙中溶质的化学式为 。
(5)写出Fe与混合溶液丙反应的主要离子方程式 。
检验溶液丁中无Fe3+ 的方法是: 。从溶液丁到绿矾的实验操作为蒸发浓缩、 、过滤、洗涤、干燥。
28. (12分)氢能是一种极具发展潜力的清洁能源,以太阳能为热能,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图1所示:
(1)反应I的化学方程式是
(2)反应I得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层,含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
② 辨别两层溶液的方法是 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因 。
(3)反应II : 2H2SO4(l)=2SO2(g) +O2(g) +2H2O(g) △H=+550 kJ • mol-1
它由两步反应组成:
i.H2SO4(l)==SO3(g) +H2O(g) △H =+177 kJ • mol-1
ii.SO3(g)分解。
L(L1, L2)和X可分别代表压强或温度,下图2表示L一定时,ⅱ中SO3(g)的平衡转化率随X的变化关系。
①写出反应iiSO3(g)分解的热化学方程式: 。
②X代表的物理量是 。
35.【化学-选修3:物质结构与性质】(14分)
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型: C、D为同周期元素,C核外电子总数是最外层层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
⑴四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式
为 。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式);A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为 ;晶胞中A原子的配位数为 ;列式计算晶体F的密度(g • cm-3 )
。
36.【化学一选修5:有机化学基础】(14分)
由化合物A合成黄樟油(E)和香料F的路线如下(部分反应条件己略去):
请回答下列问题:
(1)下列有关说法正确的是 (填选项字母)。
a.化合物A核磁共振氢谱为两组峰
b.CH2Br2只有一种结构
c.化合物E能发生加聚反应得到线型高分子
d.化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为 。
(3) D含有的官能团名称为 。
(4)写出A→B的化学反应方程式: 。
(5)满足下列条件的E的同分异构体W有 种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2::2::2::3的结构简式为 。
①1molW与足量NaOH溶液反应,能消耗2molNaOH
②能发生银镜反应
③苯环上只有两个取代基,能发生聚合反应
【参考答案】
7-13AABBCAB
26.(14分)(1) C2H5OH+HBrC2H5Br+H2O
(2)④②③
①检査其气密性
(3)随时控制反应的进行,不反应时上拉铁丝,反应时放下铁丝、
(4)降温,冷凝溴乙烷
(5) U形管底部产生无色的油状液体 分液漏斗、烧杯。
27. (18分)(1) +2 价(2分)
⑵FeO·Cr2O3(2分)
(3)①4:7(2分)②粉碎矿石(或升高温度)(2分)
⑷①H2SO4量少时不能除尽Na2CO3杂质,H2SO4量多时又会生成新的杂质(Cr2O10-2),所以H2SO4必须适量(2分) ②Na2Cr2O7、Na2SO4 (2分)
(5)Fe+2Fe3+=3Fe2+(2分) 取少量丁溶液于试管中,向其中加入KSCN溶液,不显红色则说明丁溶液中不含Fe3+(2分) 冷却结晶(2分)
28.(12分)(1)SO2+I2+2H2O=H2SO4+2HI
(2) ①ac ②观察颜色,颜色深的是HI层,颜色浅的是H2SO4层
③H2SO4层含有少量HI
(3)①2SO3(g) 2SO2(g)+O2(g) △H= +196 kJ • mol-1 ②压强
35.(1)(每空 1分)0 ls22s22p63s23p3(或[Ne] 3s23p3)
(2) (每空1分)O3 分子晶体 离子晶体
(3) (每空1分)三角锥形 sp3
(4)(2分) 2C12+2Na2CO3+H2O= Cl2O+2NaHCO3+2NaCl (或2Cl2+Na2CO3=Cl2O+CO2+2NaCl)
(5)(每空2分)Na2O 8 =2. 27 g/cm3
36. (14分)
(1)be (2分); (2)液溴、Fe (或液溴、FeBr3) (2分)
(3)醚键、溴原子(2分);1-溴丙烯(2分);
(4) (2分)
(5)9(2分);(2分)