- 2021-05-20 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省泸县第二中学2020届高三下学期第四次学月考试理综
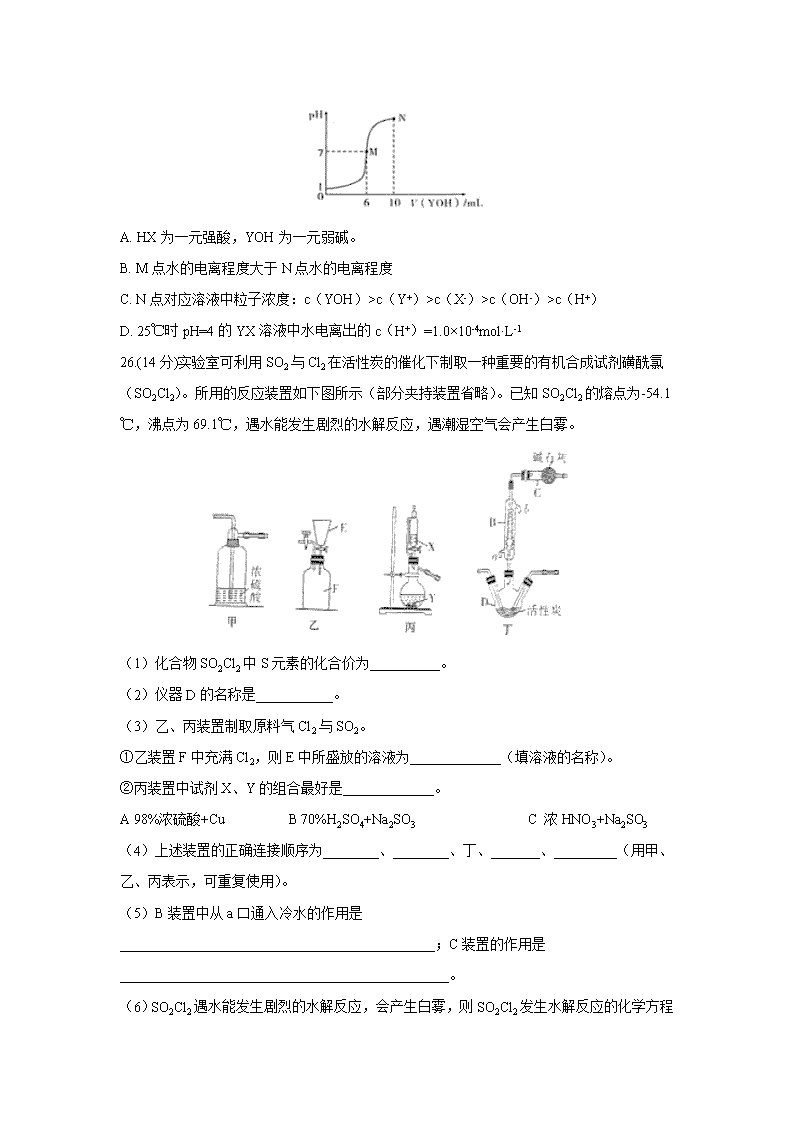
四川省泸县第二中学2020届高三下学期第四次学月考试理综 7.化学与生活、社会密切相关。下列说法正确的是( ) A. 苏打是面包发酵粉的主要成分 B. 汽油和乙烯均为石油分馏得到的产品 C. CaO可作工业废气的脱硫剂 D. 蔗糖、淀粉、油脂的水解产物均为非电解质 8.下列实验操作、现象和所得出结论正确的是 ( ) 选项 实验操作 实验现象 实验结论 A 向淀粉溶液中加入稀硫酸,加热一段时间后,再加入新制Cu(OH)2,加热 没有出现砖红色沉淀 淀粉没有水解 B 取少量Mg(OH)2悬浊液,向其中滴加适量浓CH3COONH4溶液 Mg(OH)2溶解 CH3COONH4溶液呈酸性 C 将浸透石蜡油的石棉放置在硬质试管底部,加入少量碎瓷片并加强热,将生成的气体通入酸性高锰酸钾溶液中 酸性高锰酸钾溶液褪色 石蜡油分解产物中含有不饱和烃 D 将海带剪碎,灼烧成灰,加蒸馏水浸泡,取滤液滴加硫酸溶液,再加入淀粉溶液 溶液变蓝 海带中含有丰富的I2 9.设NA表示阿伏加德罗常数的值。下列判断正确的是( ) A. 标准状况下,2.24L苯中含有碳碳双键数为0.3NA B. 6.4gS2、S4和S8的混合物中所含硫原子数为0.2NA C. 1L0.1mol·L-1的氢碘酸中含碘化氢分子数为0.1NA D. 60g乙酸与足量乙醇发生酯化反应时断裂的C-O键数为NA 10.萘乙酸甲酯是具有生长素活性的植物生长调节剂,农业上可用于抑制马铃薯块茎贮藏期发芽等,其结构如图所示,下列有关萘乙酸甲酯的判断错误的是( ) A. 其在水中和苯中的溶解度均较大 B. 属于芳香化合物,分子式为C13H12O2 C. 能发生水解反应、氧化反应和加成反应 D. 其一氯取代产物共有9种(不考虑立体异构体) 11.主族元素X、Y、Z、W、R、T的原子序数依次增大,且均不大于20。其中X-的电子层结构与氦相同,R和Y同族,Y元素的某种单质是一种自来水消毒剂;Z3+和Y2-具有相同的电子层结构;T、W、Y三种元素组成盐T2WY3的溶液通入过量CO2后产生白色沉淀。下列说法不正确的是 ( ) A. 原子半径:T>R>W>Z B. T和R形成化合物的水溶液呈碱性 C. 化合物TX具有很强的还原性,可与水反应 D. T、R、Z三种元素的最高价氧化物对应的水化物两两能发生反应 12.当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是( ) A. 当电流计指针归零后,断开K2,闭合K1,一段时间后B电极的质量增加 B. 断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等 C. 实验开始先断开K1,闭合K2,此时NO3-向B电极移动 D. 当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大 13.室温下,向10mL0.1mol·L-1HX溶液中逐滴加入0.2mol·L-1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论错误的是( ) A. HX为一元强酸,YOH为一元弱碱。 B. M点水的电离程度大于N点水的电离程度 C. N点对应溶液中粒子浓度:c(YOH)>c(Y+)>c(X-)>c(OH-)>c(H+) D. 25℃时pH=4的YX溶液中水电离出的c(H+)=1.0×10-4mol·L-1 26.(14分)实验室可利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2)。所用的反应装置如下图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。 (1)化合物SO2Cl2中S元素的化合价为__________。 (2)仪器D的名称是___________。 (3)乙、丙装置制取原料气Cl2与SO2。 ①乙装置F中充满Cl2,则E中所盛放的溶液为_____________(填溶液的名称)。 ②丙装置中试剂X、Y的组合最好是_____________。 A 98%浓硫酸+Cu B 70%H2SO4+Na2SO3 C 浓HNO3+Na2SO3 (4)上述装置的正确连接顺序为________、________、丁、_______、_________(用甲、乙、丙表示,可重复使用)。 (5)B装置中从a口通入冷水的作用是_____________________________________________;C装置的作用是_______________________________________________。 (6)SO2Cl2遇水能发生剧烈的水解反应,会产生白雾,则SO2Cl2 发生水解反应的化学方程式为________________________________________________________。 (7)若反应中消耗氯气的体积为1.12L(已转化为标准状况,SO2足量),最后通过蒸馏得到纯净的磺酰氯5.13g,则磺酰氯的产率为______________(保留三位有效数字)。 27.(14分)含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如图1: (1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是________________________________;所得滤渣的主要成分是____________(写化学式). (2)氧化:加热搅拌条件下加入NaClO3 , 将Fe2+氧化成Fe3+ , 其离子方程式________________________________________; 已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]•3H2O. 3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(蓝色沉淀) 4Fe3++3[Fe(CN)6]4﹣═Fe4[Fe(CN)6]3↓(蓝色沉淀) 确定Fe2+是否氧化完全的方法是_______________________________________________.(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液) (3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式________________________________________. (4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是________________________________________________________________. (5)溶解:CoCl2的溶解度曲线如图2所示.向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是________________________________________. 图2 (6)灼烧:准确称取所得CoC2O4 1.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式____________________. 28.(15分)“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题: (1)已知:N2(g)+O2(g)=2NO(g) △H1= +180.5 kJ/mol C(s)+O2(g)=CO2(g) △H2=-393.5 kJ/mol 2C(s)+O2(g)=2CO(g) △H3=-221 kJ/mol 若某反应的平衡常数表达式为:K= [c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。 (2)N2O5在一定条件下可发生分解:2N2O5(g)4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表: t/ min 0 1 2 3 4 5 c(N2O5)/查看更多