- 2021-05-19 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习新提升达标作业章末综合检测1含解析新人教版
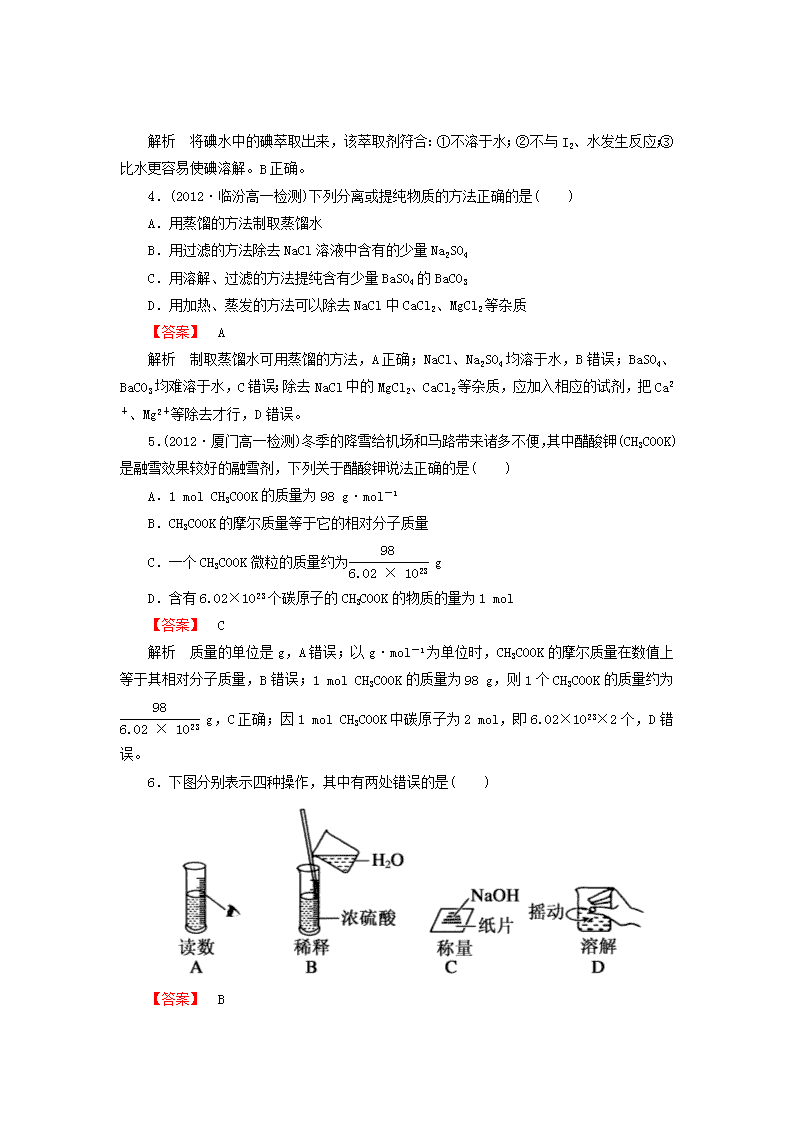
2014《成才之路》高考化学一轮复习 高一化学人教必修 1 新提升达标作业 章末综合检测 (90 分钟,100 分) 一、选择题(本题包括 18 个小题,每小题 3 分,共 54 分) 1.(2013·经典习题选萃)对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴 上危险警告标签。下面所列物质,贴错了包装标签的是( ) 选项 A B C D 物质 浓硫酸 汽油 酒精 氯酸钾 标签 【答案】 C 解析 浓硫酸具有强腐蚀性;汽油易燃;氯酸钾会因受热分解放出氧气属爆炸品;酒精 易燃但无毒。 2.(2013·试题调研)高一入学体检时,小明体检的血液化验单中,出现了如下图所示 的体检指标。表示该体检指标的物理量是( ) 甘油三酯 0.52 mmol/L 总胆固醇 4.27 mmol/L 高密度脂蛋白胆固醇 1.57 mmol/L 低密度脂蛋白胆固醇 1.40 mmol/L 葡萄糖 4.95 mmol/L A.溶解度 B.物质的量浓度 C.质量分数 D.摩尔质量 【答案】 B 3.(2012·深圳高一检测)选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性 质是( ) A.不溶于水,且必须易与碘发生化学反应 B.不溶于水,且比水更容易使碘溶解 C.不溶于水,且必须比水密度大 D.不溶于水,且必须比水密度小 【答案】 B 解析 将碘水中的碘萃取出来,该萃取剂符合:①不溶于水;②不与 I2、水发生反应; ③比水更容易使碘溶解。B 正确。 4.(2012·临汾高一检测)下列分离或提纯物质的方法正确的是( ) A.用蒸馏的方法制取蒸馏水 B.用过滤的方法除去 NaCl 溶液中含有的少量 Na2SO4 C.用溶解、过滤的方法提纯含有少量 BaSO4 的 BaCO3 D.用加热、蒸发的方法可以除去 NaCl 中 CaCl2、MgCl2 等杂质 【答案】 A 解析 制取蒸馏水可用蒸馏的方法,A 正确;NaCl、Na2SO4 均溶于水,B 错误;BaSO4、 BaCO3 均难溶于水,C 错误;除去 NaCl 中的 MgCl2、CaCl2 等杂质,应加入相应的试剂,把 Ca2 +、Mg2+等除去才行,D 错误。 5.(2012·厦门高一检测)冬季的降雪给机场和马路带来诸多不便,其中醋酸钾(CH3COOK) 是融雪效果较好的融雪剂,下列关于醋酸钾说法正确的是( ) A.1 mol CH3COOK 的质量为 98 g·mol-1 B.CH3COOK 的摩尔质量等于它的相对分子质量 C.一个 CH3COOK 微粒的质量约为 98 6.02×1023 g D.含有 6.02×1023 个碳原子的 CH3COOK 的物质的量为 1 mol 【答案】 C 解析 质量的单位是 g,A 错误;以 g·mol-1 为单位时,CH3COOK 的摩尔质量在数值上 等于其相对分子质量,B 错误;1 mol CH3COOK 的质量为 98 g,则 1 个 CH3COOK 的质量约为 98 6.02×1023 g,C 正确;因 1 mol CH3COOK 中碳原子为 2 mol,即 6.02×1023×2 个,D 错误。 6.下图分别表示四种操作,其中有两处错误的是( ) 【答案】 B 解析 A 项读数时,眼睛应平视;B 项浓硫酸的稀释应在烧杯中进行且应将浓硫酸慢慢 加到水中;C 项应将 NaOH 放在小烧杯中称量;D 项溶解时应用玻璃棒搅拌。 7.(2013·试题调研)实验中的下列操作正确的是( ) A.用试管取出试剂瓶中的 Na2CO3 溶液,发现取量过多,为了不浪费,又把过量的试剂 倒入试剂瓶中 B.Ba(NO3)2 溶于水,可将含有 Ba(NO3)2 的废液倒入水池中,再用水冲入下水道 C.用蒸发方法使 NaCl 从溶液中析出时,应将蒸发皿中 NaCl 溶液全部蒸干才停止加热 D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能 转移到容量瓶中 【答案】 D 8.有关化学实验的下列操作中,一般情况下不能相互接触的是( ) A.过滤操作中,玻璃棒与三层滤纸 B.过滤操作中,漏斗颈与烧杯内壁 C.分液操作中,分液漏斗颈与烧杯内壁 D.用胶头滴管向试管滴液体时,滴管尖端与试管内壁 【答案】 D 解析 用胶头滴管向试管滴液体时,应该悬滴,不能使滴管尖端与试管内壁接触。 9.(2013·试题调研)某学生只有下列仪器和用具:烧杯、试管、硬质玻璃管、圆底烧 瓶、量筒、铁架台(带铁夹)、酒精灯、集气瓶、玻璃片、水槽、导气管、橡皮塞、橡皮管、 100 mL 容量瓶、玻璃棒、药匙、火柴。从缺少仪器或用品的角度看,该学生不能进行的实 验操作是:( ) ①制取氢气 ②粗盐提纯 ③用氢气还原氧化铜 ④用氯化钠晶体配制 100 mL 0.1 mol·L-1 的氯化钠溶液 A.①② B.②③ C.①③ D.②④ 【答案】 D 解析 粗盐提纯需漏斗,蒸发皿等,配制 NaOH 溶液需托盘天平等仪器。 10.(2013·试题调研)下列叙述正确的是( ) A.1 mol H2O 的质量为 18 g/mol B.CH4 的摩尔质量为 16 g C.3.01×1023 个 SO2 分子的质量为 32 g D.标准状况下,1 mol 任何物质体积约为 22.4 L 【答案】 C 解析 A 中 1 mol H2O 的质量为 18 g;B 中 CH4 的摩尔质量为 16 g·mol-1,D 中 1 mol 任何物质错,应为 1 mol 气体。故选 C。 11.(2012·荆州高一检测)绿色植物是空气天然的“净化器”,研究发现,1 万平方米 柳杉每月可以吸收 160 kg SO2,则 1 万平方米柳杉每月吸收的 SO2 的物质的量为( ) A.164 kg B.2.5 mol C.2500 mol D.2500 g·mol-1 【答案】 C 解析 160 kg SO2 的物质的量为 160000 g÷64 g·mol-1=2500 mol。 12.(2013·经典习题选萃)在相同状况下,一个空瓶,若装满 O2 称其质量为 36 g,若 装满 CO2 称其质量为 42 g,若装满 A 气体,称其质量为 52 g,则 A 的相对分子质量是( ) A.16 B.32 C.64 D.128 【答案】 C 解析 设瓶子的质量为 x,气体 A 的摩尔质量为 y,同一瓶子的体积相等,由阿伏加德 罗定律可知,在相同状况下,O2、CO2 与气体 A 的物质的量也相等,则依据 n=m/M 得,(36 g -x)/32 g·mol-1=(42 g-x)/44 g·mol-1,解之得:x=20 g,故(36 g-20 g)/32 g·mol -1=(52 g-20 g)/y,解之得:y=64 g·mol-1,所以气体 A 的相对分子质量是 64。 13.(2013·经典习题选萃)某固体仅由一种元素组成,其密度为 5 g/cm3。用 X 射线研 究该固体的结果表明:在棱长为 1×10-7 cm 的立方体中含有 20 个原子,则此元素的相对原 子质量最接近( ) A.32 B.65 C.120 D.150 【答案】 D 解析 由 n=m M 和 n=N NA 可得m M =N NA ,则解此类问题的思路为 M=V·ρ·NA N 。 据题意,若能求出 20 个原子的质量,则可计算出 NA(取值为 6.02×1023)个原子的质量, 即 1 mol 原子的质量。 20 个原子的质量 m=V·ρ=(1×10-7 cm)3×5 g/cm3=5×10-21 g,则该元素的摩尔质 量 M=5×10-21 g×6.02×1023 mol-1 20 =150 g/mol。 所以,该元素的相对原子质量接近于 150。 14.(2013·试题调研)体积为 V mL,密度为 d g/mL,溶质的摩尔质量为 M g·mol-1, 物质的量浓度为 c mol·L-1,溶质的质量分数为 a%,溶质的质量为 m g。下列式子正确的是 ( ) A.m=aV/100d B.c=1 000da M C.c=1 000m VM D.a%= cM 1 000d % 【答案】 C 解析 已知溶质质量、溶液的体积和溶质的相对分子质量,求物质的量浓度 c= m M V 1000 = 1000m VM ,故 C 正确,其它三项均不正确。 15.(2013·经典习题选萃)欲配制 100 mL 1.0 mol/L Na2SO4 溶液,正确的方法是( ) ①将 14.2 g Na2SO4 溶于 100 mL 水中 ②将 32.2 g Na2SO4·10 H2O 溶于少量水中,再用水稀释至 100 mL ③将 20 mL 5.0 mol/L Na2SO4 溶液用水稀释至 100 mL A.①② B.②③ C.①③ D.①②③ 【答案】 B 16.下列溶液中的 Cl-浓度与 50 mL 1 mol·L-1 MgCl2 溶液中的 Cl-浓度相等的是( ) A.150 mL 1 mol·L-1 NaCl 溶液 B.75 mL 2 mol·L-1 CaCl2 溶液 C.150 mL 2 mol·L-1 KCl 溶液 D.75 mL 1 mol·L-1 AlCl3 溶液 【答案】 C 解析 已知 1 mol·L-1 MgCl2 溶液中 Cl-浓度为 2 mol·L-1,分析 A 中 Cl-浓度为 1 mol·L -1,B 中 Cl-浓度为 4 mol·L-1,C 中 Cl-浓度为 2 mol·L-1,D 中 Cl-浓度为 3 mol·L-1, 故选 C。请注意 Cl-浓度与体积数无关,这是干扰信息。 17.为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( ) 序号 物质 杂质 除杂质应选用的试剂或操作方法 ① KNO3 溶液 KOH 滴入稀 HNO3 同时用 pH 计测定至溶液呈中性 ② FeSO4 溶液 CuSO4 加入过量铁粉并过滤 ③ H2 CO2 依次通过盛有 NaOH 溶液和浓硫酸的洗气瓶 ④ NaNO3 CaCO3 加稀盐酸溶解、过滤、蒸发、结晶 A.①②③ B.②③④ C.①③④ D.①②③④ 【答案】 A 解析 除杂的原则是去除杂质,但不引进新的杂质,更不能使提纯物质减少。题中①②③ 都符合这个原则,④中加入盐酸,引进了 Cl-,不符合题意,所以选 A 项。 18.若 20 g 密度为ρ g·cm-3 的硝酸钙溶液里含 1 g Ca2+,则 NO - 3 的物质的量浓度是 ( ) A. ρ 400 mol·L-1 B.20 ρ mol·L-1 C.2.5ρ mol·L-1 D.1.25ρ mol·L-1 【答案】 C 解析 由 Ca(NO3)2 的组成知,NO - 3 的浓度应为 Ca2+浓度的 2 倍,所以先求 Ca2+浓度:c(Ca2 +)=n Ca2+ V = 1 g 40 g·mol-1 20 g ρ g·cm-3× 1 1000 L·mL-1 =5 4 ρ mol·L-1 c(NO- 3 )=5 4 ρ mol·L-1×2=5 2 ρ mol·L-1。 二、非选择题(本题包括 7 个小题,共 46 分) 19.(2013·经典习题选萃)(6 分)下图是中学化学中常用于混合物的分离和提纯的装 置,请根据装置回答问题: (1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同); 除去自来水中 的 Cl-等杂质,选择装置________________。 (2)从碘水中分离出 I2,选择装置________,该分离方法的名称为________________。 (3)装置 A 中①的名称是________,进水的方向是从________口进水。装置 B 在分液时 为 使 液 体 顺 利 下 滴 , 应 进 行 的 具 体 操 作 是 _________________________________________________________。 【答案】 (1)D A (2)B 萃取 (3)冷凝管 下 将分液漏斗上部的玻璃塞打开 解析 (1)从溶液得到固体溶质用蒸发溶剂法,除去自来水中的 Cl-可采用蒸馏法。(2) 加入萃取剂可从碘水中分离出 I2。(3)装置 A 中①是冷凝管,应从下口进水;分液时为保证 液体顺利流下,应将分液漏斗上部的玻璃塞打开。 20.(2012·四川泸州天立学校高一期中考试)(4 分)对于混合物的分离或提纯,常采用 的方法有:①过滤,②蒸发,③蒸馏,④萃取,⑤加热分解等。下列各组混合物的分离或提 纯应采用什么方法?(要求:填序号) (1)实验室中的石灰水久置,液面上常悬浮有 CaCO3 微粒。可用________的方法除去 Ca(OH)2 溶液中悬浮的 CaCO3 微粒。 (2)提取碘水中的碘,用________方法。 (3)除去食盐溶液中的水,可采用________的方法。 (4)淡化食盐水,可采用________的方法。 (5)除去氧化钙中的碳酸钙可用________的方法。 【答案】 (1)① (2)④ (3)② (4)③ (5)⑤ 21.(2012·厦门高一检测)(4 分) (1)0.5molCH4 的质量是________g,在标准状况下的体积为________L;含________个氢 原子。 (2)将标准状况下 22.4 L 的 HCl 溶于水配成 200 mL 的溶液,所得溶液的物质的量浓度 为________;配制 300 mL 0.5 mol·L-1 氯化钠溶液,需要 1.5 mol·L-1 的氯化钠溶液的体 积是________mL。 【解析】 (1)0.5 mol CH4 的质量是 0.5 mol×16 g·mol-1=8 g,在标准状况下的体 积为 0.5 mol×22.4 L·mol - 1 =11.2 L,氢原子数是 0.5 mol×4×6.02×1023 mol - 1 = 1.204×1024。 (2)标准状况下 22.4 L 的 HCl 是 22.4 L÷22.4 L·mol-1=1 mol,物质的量浓度为 1 mol÷0.2 L=5 mol·L-1;由稀释规律知,所需氯化钠溶液的体积是(300 mL×0.5 mol·L- 1)÷1.5 mol·L-1=100 mL。 【答案】 (1)8 11.2 1.204×1024 (2)5 mol·L-1 100 22.(2013·经典习题选萃)(8 分)掌握仪器的名称、组装及使用方法是中学化学实验的 基础,下图为两套实验装置。 (1)写出下列仪器的名称:①________,②________,④________。 (2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有________________, 将仪器补充完整后进行的实验操作的名称为________;冷凝管的进水口是________(填“f” 或“g”);现需配制 250 mL 0.2 mol/L NaCl 溶液,装置Ⅱ是某同学转移溶液的示意图,图 中的错误是__________________________________________________ _________________________________________________________。 【答案】 (1)①蒸馏烧瓶 ②锥形瓶 ④容量瓶 (2)温度计 分馏 g 未用玻璃棒引流,未采用 250 mL 容量瓶 23.(2013·经典习题选萃)用 Na2CO3·10H2O 晶体,配制 0.2 mol·L-1 的 Na2CO3 溶液 480 mL。 (1)应称取 Na2CO3·10H2O 晶体的质量:________。 (2)根据下列操作对所配溶液的浓度产生的影响,完成下列要求: ①Na2CO3·10H2O 晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体(使用游码) ③碳酸钠晶体不纯,其中混有氯化钠 ④称量碳酸钠晶体时所用砝码生锈 ⑤容量瓶未经干燥使用 其 中 引 起 所 配 溶 液 浓 度 偏 高 的 有 ______________( 填 序 号 , 下 同 ) , 偏 低 的 有 ________________,无影响的有__________________ _______________________________________________。 (3)下列操作中,容量瓶所不具备的功能有________。 A.配制一定体积准确浓度的标准溶液 B.贮存溶液 C.测量容量瓶规格以下的任意体积的液体 D.准确稀释某一浓度的溶液 E.用来加热溶解固体溶质 (4)某同学改用固体 Na2CO3 配制上述 Na2CO3 溶液的过程如图所示: 你认为该同学的错误步骤有________。 A.1 处 B.2 处 C.3 处 D.4 处 【解析】 (1)配制 0.2 mol·L-1 的 Na2CO3 溶液 480 mL,实际上应该配制 500 mL 溶液, 故需要 Na2CO3·10H2O 0.1 mol,质量为 28.6 g。 (2)Na2CO3· 10H2O 晶体失去了部分结晶水会使得称量的固体中 Na2CO3 的物质的量比理论 值大,会引起所配溶液的浓度偏高;称量时正确的操作是“左物右码”,用“左码右物”的 称量方法称量晶体,根据 m(砝码)=m(游码)+m(晶体)可知会引起所配溶液的浓度偏低;碳 酸钠晶体不纯,其中混有氯化钠会使得称量的固体中 Na2CO3 的物质的量比理论值小,会引起 所配溶液的浓度偏低;称量碳酸钠晶体时所用砝码生锈会使得称量的晶体的质量增大,使溶 液的浓度偏高;容量瓶未经干燥就使用对溶液的浓度没有影响。 (3)容量瓶不能贮存液体,只能配制规定体积的液体,不能用来加热。 (4)称量的固体的质量错误,应该是 10.6 g;定容时不应该仰视。 【答案】 (1)28.6 g (2)①④ ②③ ⑤ (3)B、C、E (4)B 24.(8 分)如图是“×××”牌饮用矿泉水标签的部分内容。 ××× (饮用矿泉水) 净含量:350 mL 配料表:纯净水、硫酸镁、氯化钾 保质期:12 个月 主要成分:钾离子(K+):1.0~27.3 mg/L 镁离子(Mg2+):0.1~4.8 mg/L 氯离子(Cl-):10~27.3 mg/L 硫酸根离子(SO2- 4 ):0.4~19.5 mg/L 请认真阅读标签内容,计算: (1)镁离子的物质的量浓度的最大值为________。 (2)一瓶合格的这种矿泉水中 SO 2- 4 的物质的量不能超过______。 【答案】 (1)2×10-4 mol/L (2)7.1×10-5 mol 解析 (1)根据标签内容知每升水中最多含 Mg2+4.8 mg,即 4.8×10-3 g,则 n(Mg2+)=4.8×10-3 g 24 g·mol-1=2×10-4 mol, c(Mg2+)=2×10-4 mol 1 L =2×10-4 mol/L。 (2)1 L 矿泉水中 SO 2- 4 的最大量为 19.5 mg,即 1.95×10-2 g,n(SO2- 4 )=1.95×10-2 g 96 g·mol-1 = 2.03×10-4 mol。 矿泉水的体积为 350 mL,因此,SO 2- 4 的物质的量不能超过:2.03×10-4 mol×0.35= 7.1×10-5 mol。 25.(8 分)把 V L 含有 MgSO4 与 K2SO4 的混合溶液分成两等份,一份加入含 a mol NaOH 的溶液,恰好使镁离子完全沉淀为 Mg(OH)2;另一份加入含 b mol BaCl2 的溶液,恰好使 SO 2- 4 完全沉淀为 BaSO4,则原混合溶液中钾离子的物质的量浓度为________。 【答案】 2 2b-a V mol·L-1 解析 根据元素守恒可知一份溶液中 MgSO4 的物质的量为a 2 mol,由 MgSO4 产生的 BaSO4 沉淀为a 2 mol,由 K2SO4 产生的 BaSO4 沉淀为(b-a 2 ) mol,由此推出在一份溶液中 K2SO4 含的 K +为 2(b-a 2 )mol=(2b-a) mol,所以原混合物溶液中 K+的物质的量浓度为 2b-a mol V 2 L = 2 2b-a V mol·L-1。查看更多