广西省贵港市桂平市第五中学2019-2020学年高二第八次周考化学试卷
化学周测
1.下列能级能量最高的是( )
A. 5s B. 2p C. 3d D. 4s
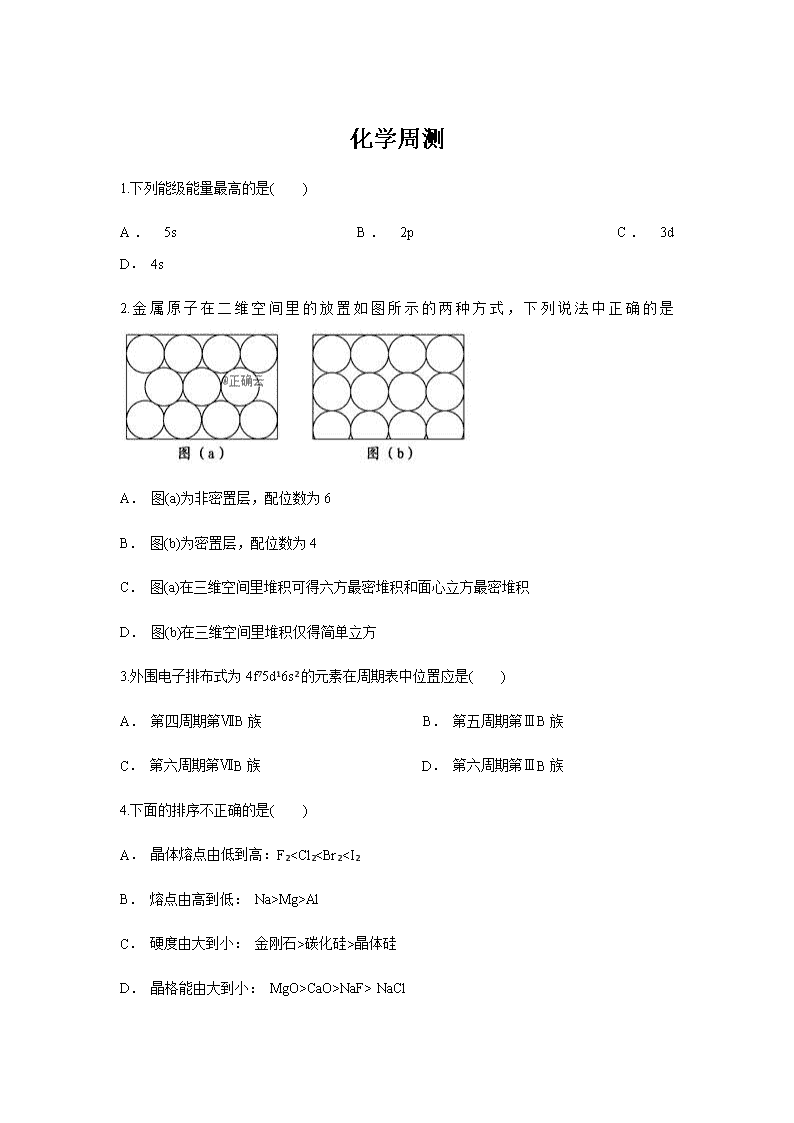
2.金属原子在二维空间里的放置如图所示的两种方式,下列说法中正确的是
A. 图(a)为非密置层,配位数为6
B. 图(b)为密置层,配位数为4
C. 图(a)在三维空间里堆积可得六方最密堆积和面心立方最密堆积
D. 图(b)在三维空间里堆积仅得简单立方
3.外围电子排布式为4f75d16s2的元素在周期表中位置应是( )
A. 第四周期第ⅦB族 B. 第五周期第ⅢB族
C. 第六周期第ⅦB族 D. 第六周期第ⅢB族
4.下面的排序不正确的是( )
A. 晶体熔点由低到高:F2
Mg>Al
C. 硬度由大到小: 金刚石>碳化硅>晶体硅
D. 晶格能由大到小: MgO>CaO>NaF> NaCl
5.下列关于晶格能的说法中正确的是( )
A. 晶格能指形成1 mol离子键所放出的能量
B. 晶格能指破坏1 mol离子键所吸收的能量
C. 晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量
D. 晶格能的大小与晶体的熔点、硬度都无关
6.某原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是( )
A. 该元素原子中共有25个电子
B. 该元素原子核外有4个能层
C. 该元素原子最外层共有2个电子
D. 该元素原子M电子层共有8个电子
7.下列分子的空间构型可用sp2杂化轨道来解释的是 ( )
①BF3 ②CH2=CH2 ③ ④CH≡CH ⑤NH3 ⑥CH4
A. ①②③ B. ①⑤⑥ C. ②③④ D. ③⑤⑥
8.在40GPa高压下,用激光器加热到1800K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是( )
A. 原子晶体干冰易汽化,可用作制冷剂
B. 原子晶体干冰有很高的熔点和沸点
C. 原子晶体干冰的硬度小,不能用作耐磨材料
D. 1mol原子晶体干冰中含2molC-O键
9.通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间构型相同,则下列有关说法中正确的是( )
A. CH4和NH4+是等电子体,键角均为60°
B. NO3-和CO32-是等电子体,均为平面正三角形结构
C. H3O+和PCl3是等电子体,均为三角锥型结构
D. B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
10.下图是金属晶体内部的电气理论示意图
仔细观察并用电气理论解释金属导电的原因是
A. 金属能导电是因为含有金属阳离子
B. 金属能导电是因为含有的自由电子在外电场作用下做定向运动
C. 金属能导电是因为含有电子且无规则运动
D. 金属能导电是因为金属阳离子和自由电子的相互作用
11.下列有机化合物中含有手性碳原子的是( )
A. CH3CH(CH3)2 B. CH3CH2OH C. CH3CH2CHO D. CH3CHClCH2CH3
12.能够用键能解释的是( )
A.氮气的化学性质比氧气稳定 B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应 D.硝酸易挥发,硫酸难挥发
13.生活中的下列现象与原子核外电子发生跃迁有关的是( )
A. 钢铁长期使用后生锈 B. 节日里燃放的焰火
C. 金属导线可以导电 D. 卫生丸久置后消失
14.某主族元素的原子,M层上有一个半充满的能级,这种原子的质子数( )
A. 只能是7 B. 只能是15
C. 是11或15 D. 是11或13
15.下列关于苯分子结构或性质的描述错误的是 ( )
A. 苯分子呈平面正六边形,六个碳碳键完全相同,键角皆为120°
B. 苯分子中的碳原子采取sp2杂化,6个碳原子中未参与杂化的2p轨道以“肩与肩”形式形成一个大π键
C. 苯分子中的碳碳键是介于单键和双键之间的一种特殊类型的键
D. 苯能使溴水和酸性KMnO4溶液因发生化学反应而褪色
16.原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E元素原子序数为29。
用元素符号或化学式回答下列问题:
(1)Y在周期表中的位置为__________________。
(2)已知YZ2+与XO2互为等电子体,则1mol YZ2+中含有π键数目为___________。
(3)X、Z与氢元素可形成化合物XH2Z,XH2Z分子中X的杂化方式为_________________。
(4)E原子的核外电子排布式为__________;E有可变价态,它的某价态的离子与Z的阴离子形成晶体的晶胞如图所示,该价态的化学式为____________。
(5)氧元素和钠元素能够形成化合物F,其晶胞结构如图所示(立方体晶胞),晶体的密度为ρg·cm-3,列式计算晶胞的边长为a=______________cm(要求列代数式)。
17.X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表.
请根据上述信息回答下列问题:
(1)写出 X3﹣的一种等电子体的化学式 ; X的气态氢化物易液化的原因是: .
(2)写出T元素基态原子的核外电子排布图 ;Q元素的原子核外有 种运动状态不同的电子.
(3)元素 X、T 的电负性相比, 的小(填元素名称);元素 X
的第一电离能与T相比较,T的 (填“大”或“小”).
(4)甲醛(CH2O)分子中σ 键与π 键的个数之比为 .
(5)Y元素在周期表中位于 区.Y单质晶体的晶胞如图所示,该晶胞中实际拥有
个原子,该晶体中Y原子在三维空间里的堆积方式为 堆积.
(6)元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为: ,分子中X原子的杂化方式为 杂化.