- 2021-05-19 发布 |
- 37.5 KB |
- 27页


文档介绍
2018届二轮复习化学平衡图像题课件(27张)(全国通用)
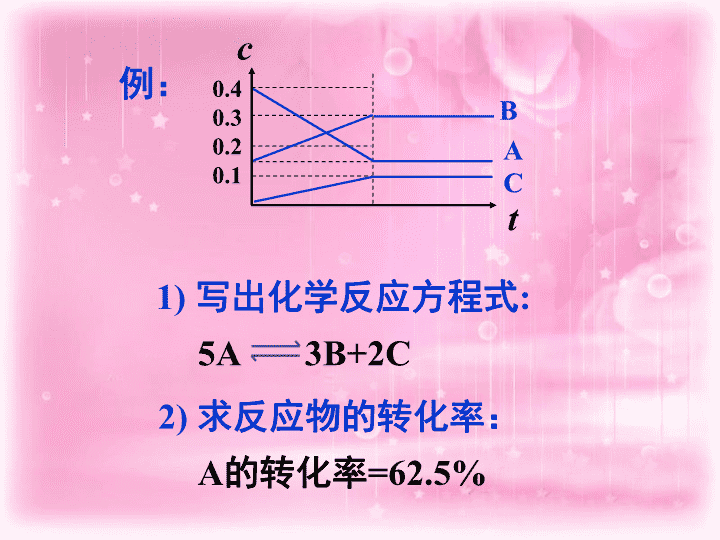
化学平衡图像题 共 2 课时 说明:解题关键: ①何为反应物、生成物 ②反应物、生成物的计量数关系 ③是否为可逆反应 ④看起点、看变化趋势、看终点 一、浓度 —— 时间图像 A B C t c 0.4 0.3 0.2 0.1 2) 求反应物的转化率: 例: 5A 3B+2C A 的转化率 =62.5% 1) 写出化学反应方程式 : 1 、 正反应为放热的可逆反应,若反应开始经 t 1 s 后达平衡,在 t 2 s 时由于反应条件改变,使平衡破坏,到 t 3 s 时又达平衡,如图: ( 1 )该反应的反应物是 _________________ ( 2 )该反应的化学方程式为 _________________ ( 3 )分析从 t 2 到 t 3 时曲线改变的原因是( ) A 、增大了 X 或 Y 的浓度 B 、使用了催化剂 C 、缩小体积,使体系压强增大 D 、升高了反应温度 关键: t 2 时刻浓度的瞬间变化情况 D 二、 v—t 图像(速率 — 时间图像) 速率 — 时间图既能表示反应速率变化,又能表示平衡移动的方向。 V 逆 V 正 V' 正 V' 逆 时间 V 0 0 V 正 V 逆 V' 正 = V' 逆 时间 V 0 V 逆 V 正 V' 正 V' 逆 时间 V (1) (2) (3) B 2 、对于达到平衡的可逆反应 : X + Y W + Z 增大压强则反应速率的变化图象如图所示。据此分析 X 、 Y 、 W 、 Z 的聚集状态是( ) A. Z 、 W 均为气态, X 、 Y 中有一种为气体 B. Z 、 W 中有一种为气体, X 、 Y 均为气体 C. X 、 Y 、 Z 均为非气体, W 为气体 D. X 、 Y 均为气体, Z 、 W 皆为非气体 v V (正) V (正) V (逆) V (逆) 时间 t ( 1 )、确定 t 1 、 t 2 、 t 3 时刻的操作: A 、降温 B 、加压 C 、浓度减小 ( 2 )、该反应正向是: 啊 (吸、放)热反应。 啊 气体物质的量 (增大、减小)的反应。 3 、 t 1 :A t 2 :B t 3 :C 正反应为放热反应 正反应气体物质的量增大 可逆反应 mA(g ) + nB(g ) pC(g ) + qD(g ) C% t T 1 T 2 1 、 T 1 T 2 ( > = < ) 正反应是 反应 (放热、吸热) B% t T 1 T 2 2 、 T 1 T 2 ( > = < ) 正反应是 反应 (放热、吸热) < 放热 > 放热 A B t 1 t 2 三、百分含量 ( 或转化率、产率 )- 时间图像 先拐先平,数值大 A 转化率 t P 1 P 2 3 、 P 1 P 2 ( > = < ) m+n p+q ( > = < ) B% t P 1 P 2 4 、 P 1 P 2 ( > = < ) m+n p+q ( > = < ) < < < > A B t 1 t 2 可逆反应 mA(g ) + nB(g ) pC(g ) + qD(g ) 4 、 反应 2X(g)+Y(g) 2Z(g) △H<0 在不同 (T 1 和 T 2 ) 温度及不同压强 (p 1 和 p 2 ) 下,产物 Z 的物质的量 n(Z ) 与反应时间 t 的关系如图所示。下述判断正确的是 ( ) A.T 1 = < )
C%
P
400
°C
500
°C
2
、正反应是
反应
(
放热、吸热
)
m+n
p+q
( > = <)
放热
>
放热
<
C
D
C%
T
10
7
Pa
10
5
Pa
A
B
可逆反应
mA(g
) +
nB(g
)
pC(g
) +
qD(g
)
作等温线
四、百分含量
(
或转化率
)--
压强
--
温度图像
定一议二原则
6
、右图表示外界条件
(
温度、压强
)
的变化对下列反应的影响
:
L(s
)
+
G(g
)
2R(g), △H
﹥
0
,在图中,
Y
轴是指( )
A.
平衡混合气中
R
的体积分数
B.
平衡混合气中
G
的体积分数
C.G
的转化率
D.L
的浓度
Y
温度
10kpa
100kpa
B
五、速率
---
温度(压强)图像
T
V
V(
正
)
V(
逆
)
可逆反应
mA(g
) +
nB(g
)
pC(g
) +
qD(g
)
正反应是
反应
(放热、吸热)
V(
正
)
V(
逆
)
V
P
m + n
p +q ( > = < )
吸热
>
平衡点
图像题解答要点
:
(1)
看懂图象:
①看面
(
即看清纵坐标与横坐标
)
②
看线
(
即线的走向和变化趋势
)
③
看点
(
即起点、拐点、交点、终点
)
④
看量
(
图像中有关量的多少
)
⑤
看是否要作辅助线
(
如等温线、等压线
)
(2)
联想规律
:
联想外界条件对化学反应速率和化学平衡的影响规律。
(3)
作出判断:
根据图像中表现的关系与所学规律相对比,作出符合题目要求的判断。
1
、
可逆反应
:
mA(s
)
+
nB(g
)
pC(g
)
;△
H<0
,在一定温度下
B
的转化率与压强的关系如图所示,则下列判断正确的是( )。(双选)
A.m+n
<
p
B.n
>
p
C.x
点的状态是
v
正
>
v
逆
D.x
点比
y
点的反应速度慢
α
(
B
)
压强
0
X
Y
BD
平衡状态
和
非平衡状态
的判断
2
、
下图是在其它条件一定时,反应
:
2NO(g) + O
2
(g) 2NO
2
(g)
△H<0
NO
的最大转化率与温度的关系
曲线。图中坐标有
A
、
B
、
C
、
D
、
E 5
点。
(
1
)其中表示已达平衡状态
V
正
=V
逆
的点是
。
(
2
)其中表示未达平衡状态
,
V
正
>V
逆
的点是
。
(
3
)其中表示未达平衡状态
,
V
正
P △H>0
C.T
1
T
2
P
1
0
t
T
2
P
2
T
1
P
2
T
1
P
1
B%
关键:
1
、先拐先平数值大。
2
、“定一论二”,即让温度、压强之一为恒量,
抓住拐点讨论另外两个变量的关系。
D
4
、对于
mA
(
s
)+
nB
(
g
)
pC
(气)△
H<0
的可逆反应,在一定温度下达到平衡时
B
的百分含量与压强的关系如图所示,下列判断正确的是
( )
A.m+n
<
p
B.n
>
p
C.x
点的状态是
v
正
>
v
逆
D.x
点比
y
点的反应速度慢
0
x
y
压强
B%
C
、
D
关键:图象上的点代表的是在相应的温度和压强下处于平
衡状态的函数值,不在图象上的点代表此刻反应还没有达
到平衡,并且可以通过比较确定此刻平衡移动的方向
5
、一定条件下,在一个体积可变的容器中
有如下平衡体系 :
2SO
3
(
g
)
2SO
2
(
g
)
+O
2
(
g
) △
H<0
。
在
t
1
时刻改变某个条件,在
t
2
时达成新的
平衡。下列关于
t
1
时改变条件的说法正确
的是( )
A.
温度不变,扩大容器的体积
B.
压强、温度不变,充入一些
N
2
C.
压强不变,降低温度
D.
温度、压强不变,充入一些
SO
3
(
g
),移走一些
SO
2
(
g
)
V(
逆
)
V(
反应速率
)
O
t
1
t
2
时间
V(
正
)
D
6
、在密闭容器中进行下列反应:
M
(
g
)+
N
(
g
)
R
(
g
)+
2
L
(?)
△
H
(?)
此反应符合下面图像,下列叙述正确的是( )
A
.
正反应吸热,
L
是气体
B
.
正反应吸热,
L
是固体
C
.
正反应放热,
L
是气体
D
.
正反应放热,
L
是固体或液体
t
T
2
P
1
T
1
P
2
T
1
P
1
R%
0
C
7
、如图,表示外界条件的变化对下列反应的影响
L(S)+G(g
) 2R(g) △H>0
在图中,
Y
轴是指( )
A.
平衡混合气体中
R
的体积分数
B.
平衡混合气体中
G
的体积分数
C.G
的转化率
D.L
的转化率
0
1.01
10
7
Pa
1.01
10
6
Pa
1.01
10
5
Pa
T
(℃)
y
B
关键:
1
、定一议二,讨论其中一个变量时可将另一 个变量设为定值
2
、分析图象的变化趋势与平衡的移动方向是否一致
8
、
如图所示,反应
X(g)+3Y(g)
Z(g
)
△H<0
,
在不同温度、不同压强
(p
1
>p
2
)
下达到平衡时,混合气体中
Z
的体积分数
φ
(
Z
)随温度变化的曲线应为
( )
O
T
p
1
p
2
Φ(
Z)
O
T
Φ(
Z)
O
T
Φ(
Z)
O
T
Φ(
Z)
p
1
p
1
p
1
p
2
p
2
p
2
A
B
C
D
C
9
、反应
A
(
g
)
+B
(
g
)
C
(
g
);
△
H<0
在密闭容器中进行,若反应在
200 ℃
、无催化剂
时
A
的浓度变化曲线如图所示,试在图中画出在
反应物起始浓度不变的情况下:
(
1
)保持
200 ℃
,但反应在适当催化剂条件下
进行时
A
的浓度变化曲线。
(
2
)在无催化剂但使反应在
500 ℃
进行时
A
的
浓度变化曲线。
t
0
C
(
A
)
10
、某容积一定的密闭容器中,可逆反应
A(g)+B(g
)
xC(g
) △H
(?)符合如图
Ⅰ
所
示关系,由此推断对图
Ⅱ
的正确说法是( )
A.
P
3
>P
4
, y
轴表示
A
的转化率
B.
P
3
P
4
, y
轴表示混合气体密度
D.
P
3
>P
4
, y
轴表示混合气体
Mr
t
T
1
P
1
T
1
P
2
T
2
P
2
0
C%
0
P
3
P
4
y
T
(℃)
Ⅰ
Ⅱ
A
、
D
关键:
1
、利用图象对反应进行定性分析
2
、利用反应的特征去判断图象的正误