- 2021-05-19 发布 |
- 37.5 KB |
- 36页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届高考二轮复习人教版第三编化学反应原理专题十一化学反应速率和化学平衡学案19
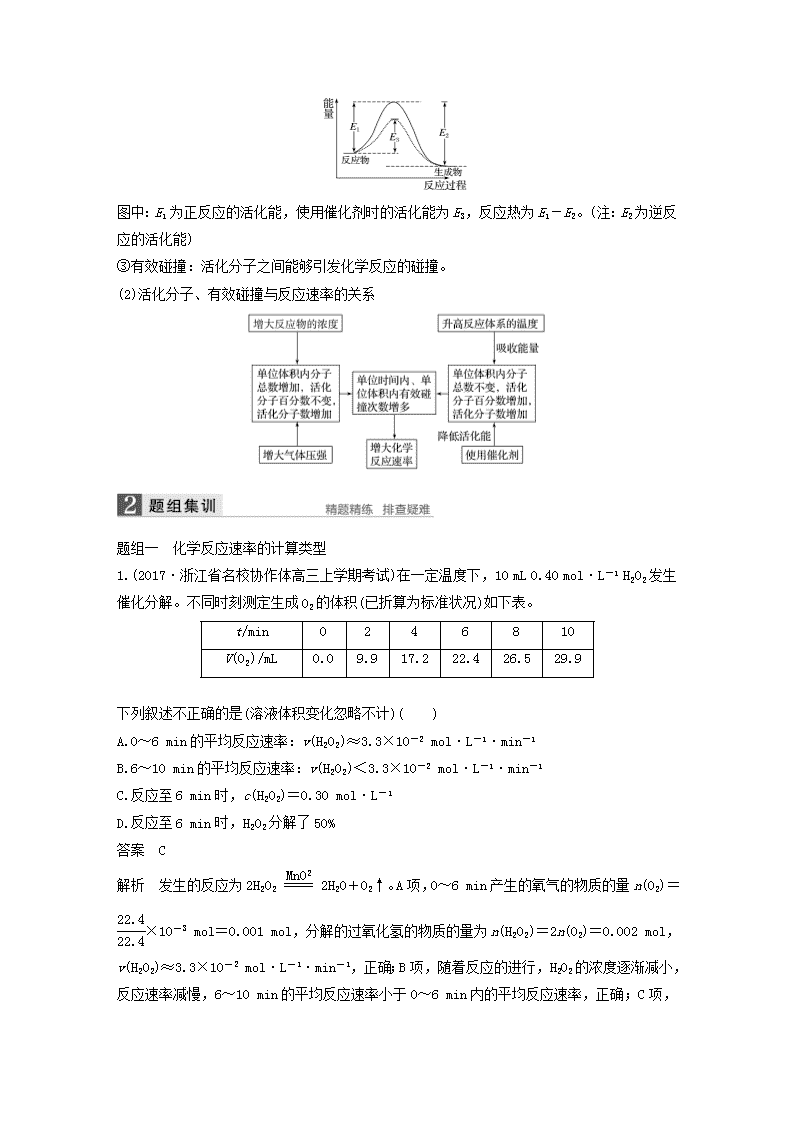
专题十一 化学反应速率和化学平衡 [考试标准] 知识条目 必考要求 加试要求 1.化学反应速率与反应限度 a a a a a b b b b b ①化学反应速率及其简单计算 ②影响化学反应速率的因素,控制反应条件在生产和科学研究中的作用 ③化学反应的限度 ④化学平衡的概念 ⑤化学平衡状态的特征 2.化学反应速率 a b c ①活化分子、活化能、有效碰撞的概念 ②碰撞理论 ③实验数据的记录与处理 3.化学反应的方向和限度 a a c b b c ①自发反应的概念 ②熵变的概念 ③用熵变、焓变判断化学反应的方向 ④化学平衡常数 ⑤反应物的转化率 ⑥化学平衡常数与反应限度、转化率的关系 4.化学平衡的移动 a b c ①化学平衡移动的概念 ②影响化学平衡移动的因素及平衡移动方向的判断 ③用化学平衡移动原理选择和确定合适的生产条件 考点一 化学反应速率及其影响因素 1.深度剖析速率的计算方法 (1)公式法:v(B)== 用上式进行某物质反应速率计算时需注意以下几点: ①浓度变化只适用于气体和溶液中的溶质,不适用于固体和纯液体。 ②化学反应速率是某段时间内的平均反应速率,而不是即时速率,且计算时取正值。 ③对于可逆反应,通常计算的是正、逆反应抵消后的总反应速率,当达到平衡时,总反应速率为零。(注:总反应速率也可理解为净速率) (2)比值法:同一化学反应,各物质的反应速率之比等于方程式中的化学计量数之比。对于反应:mA(g)+nB(g)===pC(g)+qD(g)来说,则有===。 2.正确理解速率影响因素 (1)“惰性气体”对反应速率的影响 ①恒容:充入“惰性气体”总压增大―→物质浓度不变(活化分子浓度不变)―→反应速率不变。 ②恒压:充入“惰性气体”体积增大物质浓度减小(活化分子浓度减小)反应速率减小。 (2)纯液体、固体对化学反应速率的影响 在化学反应中,纯液体和固态物质的浓度为常数,故不能用固态物质的浓度变化来表示反应速率,但是固态反应物颗粒的大小是影响反应速率的条件之一,如煤粉由于表面积大,燃烧就比煤块快得多。 (3)外界条件对可逆反应的正、逆反应速率的影响方向是一致的,但影响程度不一定相同。 ①当增大反应物浓度时,v正增大,v逆瞬间不变,随后也增大; ②增大压强,气体分子数减小方向的反应速率变化程度大; ③对于反应前后气体分子数不变的反应,改变压强可以同等程度地改变正、逆反应速率; ④升高温度,v正和v逆都增大,但吸热反应方向的反应速率增大的程度大; ⑤使用催化剂,能同等程度地改变正、逆反应速率。 3.准确把握碰撞理论(加试) (1)活化分子、活化能、有效碰撞 ①活化分子:能够发生有效碰撞的分子。 ②活化能:如图 图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。(注:E2为逆反应的活化能) ③有效碰撞:活化分子之间能够引发化学反应的碰撞。 (2)活化分子、有效碰撞与反应速率的关系 题组一 化学反应速率的计算类型 1.(2017·浙江省名校协作体高三上学期考试)在一定温度下,10 mL 0.40 mol·L-1 H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。 t/min 0 2 4 6 8 10 V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9 下列叙述不正确的是(溶液体积变化忽略不计)( ) A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol·L-1·min-1 B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol·L-1·min-1 C.反应至6 min时,c(H2O2)=0.30 mol·L-1 D.反应至6 min时,H2O2分解了50% 答案 C 解析 发生的反应为2H2O22H2O+O2↑。A项,0~6 min产生的氧气的物质的量n(O2)=×10-3 mol=0.001 mol,分解的过氧化氢的物质的量为n(H2O2)=2n(O2)=0.002 mol,v(H2O2)≈3.3×10-2 mol·L-1·min-1,正确;B项,随着反应的进行,H2O2的浓度逐渐减小,反应速率减慢,6~10 min的平均反应速率小于0~6 min内的平均反应速率,正确;C项,由A项计算可知,反应至6 min时c(H2O2)=0.40 mol·L-1-0.20 mol·L-1=0.20 mol·L-1 ,错误;D项,6 min内Δc(H2O2)=0.20 mol·L-1,则H2O2的分解率为(0.20 mol·L-1÷0.40 mol·L-1)×100%=50%,正确。 2.一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0,反应过程如下图所示,下列说法正确的是( ) A.t1 min时X和Y的反应速率相等 B.X曲线表示NH3的物质的量随时间变化的关系 C.0~8 min,H2的平均反应速率v(H2)= mol·L-1·min-1 D.0~12 min,H2的平均反应速率v(H2)= mol·L-1·min-1 答案 B 解析 t1 min时,只是X和Y的物质的量相等,X和Y的物质的量变化或浓度变化不等,X和Y的反应速率不相等,A项错误;根据图像,Y表示H2的物质的量随时间的变化关系,X表示NH3的物质的量随时间的变化关系,B项正确;0~8 min,H2的平均反应速率v(H2)== mol·L-1·min-1,C项错误;0~12 min,H2的平均反应速率v(H2)== mol·L-1·min-1,D项错误。 3.现将0.40 mol A2气体和0.20 mol B2气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如下图所示,请回答下列有关问题: (1)若t1=10 min,则0到t1时间内C物质的平均反应速率为________。 (2)该反应在t2时达到平衡,其化学方程式为________________________________ ________________________________________________________________________,若用A、B表示物质C, 则物质C的化学式是____________。 答案 (1)0.001 mol·L-1·min-1 (2)3A2+B22C A3B 化学反应速率计算常常包括化学反应速率的常规计算、速率大小比较、书写化学方程式或化学式等。 (1)反应速率大小(或快慢)比较方法 同一反应的化学反应速率用不同物质表示时数值可能不同,比较化学反应速率的快慢不能只看数值大小,而要进行一定的转化。一般采用“归一法”进行比较,即将同一反应中的不同物质的反应速率转化成同一种物质同一单位的反应速率,再进行比较。比较时要注意“一看”、“二转”、“三比较”。“一看”:看速率的单位是否一致;“二转”:利用化学反应速率之比等于化学计量数之比,转化成同一物质同一单位的化学反应速率;“三比较”:比较数值的大小,数值越大,反应速率越快。 (2)书写化学方程式或化学式 首先判断出反应物和生成物;然后计算化学方程式[对于反应aA(g)+bB(g)===cC(g)+dD(g)]中各物质前的化学计量数,计算时根据a∶b∶c∶d=v(A)∶v(B)∶v(C)∶v(D)=Δn(A)∶Δn(B)∶Δn(C)∶Δn(D)=Δc(A)∶Δc(B)∶Δc(C)∶Δc(D);最后写出化学方程式,有时再根据质量守恒定律书写出某一反应物或某一生成物的化学式。 题组二 正确理解影响化学反应速率的因素 4.按要求填空。 (1)形状大小相同的铁、铝分别与等浓度的盐酸反应生成氢气的速率:铁______(填“大于”“小于”或“等于”)铝。 (2)对于Fe+2HCl===FeCl2+H2↑,改变下列条件对生成氢气的速率有何影响?(填“增大”“减小”或“不变”) ①升高温度:________; ②增大盐酸浓度:__________; ③增大铁的质量:__________; ④增加盐酸体积:____________; ⑤把铁片改成铁粉:____________; ⑥滴入几滴CuSO4溶液:____________; ⑦加入NaCl固体:____________; ⑧加入CH3COONa固体:____________; ⑨加入一定体积的Na2SO4溶液:____________。 (3)若把(2)中的稀盐酸改成“稀硝酸”或“浓硫酸”是否还产生H2,为什么? 答案 (1)小于 (2)①增大 ②增大 ③不变 ④不变 ⑤增大 ⑥增大⑦不变 ⑧减小 ⑨减小 (3)不会产生H2,Fe和稀硝酸反应生成NO;常温下,Fe在浓硫酸中钝化。 5.对于化学反应:N2(g)+O2(g)2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填“加快”“不变”或“减慢”)。 A.缩小体积使压强增大:________。 B.体积不变充入N2使压强增大:________。 C.体积不变充入氩气使压强增大:________。 D.压强不变充入氩气使体积增大:________。 E.增大体积使压强减小:________。 答案 加快 加快 不变 减慢 减慢 解析 对于有气体参加的反应,压强的增大必须引起浓度的增大才能加快反应速率,故A、B使反应速率加快,C对反应速率无影响,D、E均使体积增大而引起浓度减小,反应速率变慢。 题组三 影响化学反应速率因素的实验探究 6.(2017·浙江省“七彩阳光”新高考研究联盟高三上学期考试)为探究影响化学反应速率的影响因素,将等质量的铁与过量盐酸反应,其他实验条件见下表。其中铁被反应完消耗时间最少的组别是( ) 组别 c(HCl)/ mol·L-1 温度/℃ 铁的状态 A 2.0 25 块状 B 2.5 30 粉末状 C 2.5 50 块状 D 2.5 50 粉末状 答案 D 解析 根据化学反应速率的影响因素,温度越高,化学反应速率越快,接触面积越大,化学反应速率越快,答案选D。 7.为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如下图所示,判断下列说法正确的是( ) A.pH越小氧化率越大 B.温度越高氧化率越小 C.Fe2+的氧化率仅与溶液的pH和温度有关 D.实验说明降低pH、升高温度有利于提高Fe2+的氧化率 答案 D 解析 由②③可知,温度相同时pH越小,氧化率越大,由①②可知,pH相同时,温度越高,氧化率越大,C项,Fe2+的氧化率除受pH、温度影响外,还受其他因素影响,如浓度等。 题组四 有效碰撞理论(加试) 8.(2016·宁波效实中学高二期中)1918年,Lewis提出反应速率的碰撞理论:反应物分子之间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称为有效碰撞。 (1)图Ⅰ是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是________(填“A”“B”或“C”)。 (2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:________________________________________________ ________________________________________________________________________。 (3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。 ①在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”“减小”或“不变”)。 ②请在图Ⅱ中用虚线作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。 答案 (1)C (2)NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1 (3)①减小 减小 ②示意图: 考点二 化学平衡状态与化学反应进行的方向 一、化学平衡状态 1.可逆反应 在同一条件下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。 2.化学平衡状态 (1)概念 一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的质量或浓度保持不变的状态。 (2)化学平衡的建立 (3)平衡特点 3.“三关注”突破化学平衡状态标志的判断 (1)关注反应条件,是恒温恒容、恒温恒压,还是绝热恒容容器; (2)关注反应特点,是等体积反应,还是非等体积反应; (3)关注特殊情况,是否有固体参加或生成,或固体的分解反应。 如:在一定温度下的定容容器中,当下列物理量不再发生变化时:①混合气体的压强、②混合气体的密度、③混合气体的总物质的量、④混合气体的平均相对分子质量、⑤混合气体的颜色、⑥各反应物或生成物的浓度之比等于化学计量数之比、⑦某种气体的百分含量(均填序号) (1)能说明2SO2(g)+O2(g)2SO3(g)达到平衡状态的是________________________。 (2)能说明I2(g)+H2(g)2HI(g)达到平衡状态的是 ________________________________________________________________________。 (3)能说明2NO2(g)N2O4(g)达到平衡状态的是_____________________________ ________________________________________________________________________。 (4)能说明C(s)+CO2(g)2CO(g)达到平衡状态的是 ________________________________________________________________________。 (5)能说明A(s)+2B(g)C(g)+D(g)达到平衡状态的是_______________________。 (6)能说明NH2COONH4(s)2NH3(g)+CO2(g)达到平衡状态的是____________________。 (7)能说明5CO(g)+I2O5(s)5CO2(g)+I2(s)达到平衡状态的是_________________________。 答案 (1)①③④⑦ (2)⑤⑦ (3)①③④⑤⑦ (4)①②③④⑦ (5)②④⑦ (6)①②③ (7)②④⑦ 4.若上述题目改成一定温度下的恒压密闭容器,结果又如何? 答案 (1)②③④⑦ (2)⑤⑦ (3)②③④⑤⑦ (4)②③④⑦ (5)②④⑦ (6)③ (7)②④⑦ 二、化学反应方向的综合判据(加试) 影响反应自发性的因素有焓变(ΔH)、熵变(ΔS)和温度(T)。要正确判断一个化学反应能否自发进行,必须综合考虑ΔH、ΔS和T这三个因素。在恒温恒压时,有如下判据: 这个判据用文字可表述:在温度、压强一定的条件下,自发反应总是向ΔH-TΔS<0的方向进行,直到达到平衡状态。 注意 用ΔH-TΔS<0来判断反应的自发性,只能用于判断反应的方向,不能确定反应是否一定会发生,也不能确定反应发生的速率。 题组一 正确理解概念 1.(2017·温州市十五校联合体高一下学期期中联考)哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是( ) A.达到化学平衡时,N2将完全转化为NH3 B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 D.达到化学平衡时,正反应和逆反应的速率相等且为零 答案 C 解析 在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A项,该反应是可逆反应,达到化学平衡时,N2不能完全转化为NH3,错误;B项,达到化学平衡时,N2、H2和NH3的物质的量浓度不再发生变化,但不一定相等,错误;C项,达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化,正确;D项,达到化学平衡时,正反应和逆反应速率相等,但不为零,错误。 2.向含有2 mol SO2的容器中通入过量氧气发生反应2SO2(g)+O2(g)2SO3(g) ΔH=-Q kJ·mol-1(Q>0),充分反应后生成SO3的物质的量______(填“<”“>”或“=”,下同)2 mol,SO2的物质的量______0 mol,转化率______100%,反应放出的热量________ Q kJ。 答案 < > < < 题组二 化学平衡状态的特征 3.(2017·温州市高三第二次选考模拟)在一定条件下,可逆反应N2(g)+3H2(g)2NH3(g) ΔH=-a kJ·mol-1(a>0)达到化学平衡时,下列说法一定正确的是( ) A.反应放出a kJ 热量 B.消耗1 mol N2的同时消耗3 mol H2 C.3v(H2)=2v(NH3) D.N2、H2、NH3的浓度之比为1∶3∶2 答案 B 解析 由于该反应是可逆反应,且未给出反应物的物质的量,所以反应放出的热量不确定,A错误;根据化学计量数可知消耗 1 mol N2的同时消耗3 mol H2,B正确;反应速率之比是相应的化学计量数之比,则2v(H2)=3v(NH3),C错误;平衡时N2、H2、NH3的浓度之比不一定为1∶3∶2,D错误。 4.(2017·浙江省“七彩阳光”新高考研究联盟高三上学期考试)已知:X(g)+3Y(g)2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是( ) 答案 A 解析 该反应是气体体积减小的反应,随反应进行X的体积分数不变化,恒为50%,Z的体积分数不断增大,达到平衡时体积分数不再变化,与图像符合,A项正确;X减少0.1 mol,消耗Y 0.3 mol,生成Z 0.2 mol,当达到平衡时的物质的量X、Z可以相同,但反应是可逆反应不能进行彻底,图像不符合反应达到平衡状态,B项错误;Y消耗0.1 mol,生成Z物质的量约为0.07 mol,图像中反应的定量关系不符合反应比,C项错误;反应速率之比等于化学方程式计量数之比,2v正(X)=v逆(Z),此时反应达到平衡状态,v正(X)=v逆(Z),不能说明反应达到平衡状态,D项错误。 题组三 化学平衡状态标志的判断 5.(2017·浙江省名校协作体高三上学期考试)一定温度下,反应N2(g)+3H2(g)2NH3(g)达到化学平衡状态的标志是( ) A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2 B.N2、H2和NH3的物质的量分数不再改变 C.N2与H2的物质的量之和是NH3的物质的量2倍 D.单位时间里每增加1 mol N2,同时增加3 mol H2 答案 B 解析 A项,平衡时各物质的分子数之比取决于物质的起始物质的量和转化率,故c(N2)∶c(H2)∶c(NH3)=1∶3∶2不能作为判断是否达到平衡状态的依据,错误;B项,N2、H2和NH3的物质的量分数不再改变,说明达到平衡状态,正确;C项,平衡时反应物与生成物的物质的量关系取决于反应物起始物质的量以及转化的程度,不能用来判断是否达到平衡状态,错误;D项,单位时间内每增加1 mol N2,同时增加3 mol H2只表示逆向反应,故不能说明达到平衡状态,错误。 6.(2017·温州中学高三2月模拟)在一个体积固定的密闭容器中,进行可逆反应A(s)+3B(g)3C(g) 。下列叙述中表明该可逆反应一定达到平衡状态的是( ) ①C的生成速率与C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B ③B的浓度不再变化 ④混合气体总的物质的量不再发生变化 ⑤A、B、C的物质的量之比为1∶3∶3 ⑥混合气体的密度不再变化 A.①③⑥ B. ①③④⑥ C.①②③ D. ①③④⑤ 答案 A 解析 在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项①③正确;②中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此②中的关系始终是成立的,不能说明;该反应是体积不变的可逆反应,所以容器内气体的压强始终是不变的,④不能说明;平衡时各物质的浓度不再发生变化,但不一定满足某种关系,⑤不能说明;密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,因此选项⑥可以说明;A项正确。 题组四 化学反应方向的判定(加试) 7.对于化学反应能否自发进行,下列说法中错误的是( ) A.若ΔH<0,ΔS>0,任何温度下都能自发进行 B.若ΔH>0,ΔS<0,任何温度下都不能自发进行 C.若ΔH>0,ΔS>0,低温时可自发进行 D.若ΔH<0,ΔS<0,低温时可自发进行 答案 C 解析 ΔH>0,ΔS>0时,要使ΔH-TΔS<0,则需要在高温下进行。 8.对于汽车尾气的净化反应:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-113.0 kJ·mol-1 ΔS=-145.3 J·mol-1·K-1,在298 K 101 kPa下,假定反应焓变与熵变不随温度变化,通过计算说明该反应在室温下________(填“能”或“不能”)自发进行,若常温常压下该反应自发进行,则大气中的NO和CO不能转化为N2和CO2而净化的原因是_______________。 答案 能 该反应虽然能自发进行,但速率太慢,必须选择合适的催化剂,加快反应速率 解析 在298 K、101 kPa下,该反应的ΔH=-113.0 kJ·mol-1,ΔS=-145.3 J·mol-1·K-1,由ΔH-TΔS≈-69.7 kJ·mol-1<0,因此该反应在室温下能自发进行。 ΔH-TΔS这个判据指的是温度、压强一定的条件下,化学反应自动发生的趋势,即反应发生的可能性,它并不能说明在该条件下一个可能自发进行的化学反应能否实际发生,因为化学反应能否实际发生还涉及反应速率问题,该反应必须选择合适的催化剂,加快反应速率。 化学反应的复合判据分析 在一定温度和压强下,反应能自发进行,则要使ΔH-TΔS<0。当反应的ΔH>0、ΔS>0,若要使反应自发进行,则要使温度T采用高温,即焓变“大”于0、熵变“大”于0时高(大)温时可自发反应;当反应ΔH<0、ΔS<0,若要使反应自发进行,则要使温度T采用低温,即焓变“小”于0、熵变“小”于0时低(小)温时可自发反应。这条规律即为“大大大小小小”规律。另外,这条规律还包括:当反应ΔH<0、ΔS>0,在任意温度下均有ΔH-TΔS<0,此种情况下任意温度均可自发反应;当反应ΔH>0、ΔS<0,在任意温度下均有ΔH-TΔS>0,此种情况下任意温度均不可自发反应。 考点三 化学平衡移动、化学平衡常数(加试) 1.化学平衡移动 (1)判断方法 如果改变影响平衡的一个条件(温度、浓度、压强等),平衡就向着能够减弱这种改变的方向移动。如升高温度时,平衡向吸热反应方向移动;增加反应物浓度,平衡向反应物浓度减少的方向(正反应方向)移动;增大压强时,平衡向气体体积缩小的方向移动,反之亦然。 化学平衡移动的根本原因是外界条件改变破坏了原平衡体系,使得正、逆反应速率不再相等。如下图所示: (2)化学平衡问题中的“三不混同” ①不要将平衡的移动和速率的变化混同起来。如化学反应速率改变,平衡不一定发生移动,但平衡发生移动,化学反应速率一定改变;不要误认为平衡正向移动一定是v正加快,v逆减慢等。 ②不要将平衡的移动和浓度的变化混同起来。如不要以为平衡正向移动时,反应物浓度一定减少,生成物浓度一定增加等。 ③不要将平衡的移动和反应物的转化率提高混同起来。不要误认为平衡正向移动时,反应物的转化率一定提高。 2.化学平衡常数 (1)正确书写化学平衡常数的注意事项 ①浓度必是平衡浓度,固体、纯液体或水溶液中水不列入平衡常数表达式中。 ②反应方向改变或化学计量数改变,平衡常数均发生改变;若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)。 ③K不随反应物或生成物浓度的改变而改变,仅随温度的改变而改变。 (2)化学平衡常数的应用 ①判断、比较可逆反应进行程度的大小 K值越大,反应进行的程度越大;K值越小,反应进行的程度越小。 ②判断可逆反应是否达到化学平衡状态 对于可逆反应aA(g)+bB(g)cC(g)+dD(g),在一定温度下的任意时刻,反应物与生成物的浓度有如下关系:浓度商Q=,则 Q ③判断可逆反应的反应热 升高温度K值增大,则正反应为吸热反应;K值减小,则正反应为放热反应。 ④计算反应物或生成物的平衡浓度及反应物的转化率。 题组一 化学平衡状态的移动及结果判断 1.(2017·温州中学高一下学期期中)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是( ) A.反应在c点达到平衡状态 B.反应物浓度:a点小于b点 C.反应物的总能量低于生成物的总能量 D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段 答案 D 解析 A项,化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,一定未达平衡,错误;B项,a到b时正反应速率增加,反应物浓度随时间不断减小,错误;C项,从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,错误;D项,随着反应的进行,正反应速率越快,消耗的二氧化硫就越多,SO2的转化率将逐渐增大,正确。 2.(2017·台州市高二上学期期末)已知反应:2NO2(红棕色)N2O4(无色) ΔH<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是( ) A.b点到c点的实验现象是气体颜色先变深后变浅,最后气体颜色比a点还要深 B.c点与a点相比,n(NO2)减小,混合气体密度增大 C.d 点:v逆>v正 D.若在注射器中对反应H2(g)+I2(g)2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图像 答案 D 解析 该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅。据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大。A项,根据上述分析,b点到c点的实验现象是气体颜色先变深后变浅,最后气体颜色比a点还要深,正确;B项,c点是a点压缩后的点,压强增大,平衡正向移动,n(NO2)减小,气体的体积减小,密度增大,正确;C项,c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v逆>v正,正确;D项,H2(g)+I2(g)2HI(g)反应前后气体的物质的量不变,压强的变化不能引起平衡的移动,不能得到相似的透光率变化趋势图像,错误;故选D。 3.(2017·绍兴市第一中学高二上学期期中)在容积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( ) A.图Ⅱ可知反应xA(g)+yB(g)zC(g)的ΔH<0,且a=2 B.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1 C.若在图Ⅰ所示的平衡状态下,再向体系中充入He的瞬间,v正>v逆 D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数等于0.5 答案 B 解析 A项,由图像可知:升高温度,平衡时C的体积分数增大,说明升高温度化学平衡向正反应方向移动,则正反应方向为吸热反应,所以ΔH>0;根据图Ⅰ所示可知该反应的方程式为2A(g)+B(g)C(g),只有当两种反应物按照方程式的计量数的关系加入时生成物C达到平衡时含量才会最高,则a=2,A错误;B项,200 ℃时,反应从开始到平衡的平均速率v(B)=(0.4-0.2) mol÷2 L÷5 min=0.02 mol·L-1·min-1,B正确;C项,若在图Ⅰ所示的平衡状态下,再向体系中充入He,由于平衡混合物中各组分的浓度没变,所以平衡不移动,v正=v逆,C错误;D项,由图Ⅰ可知在200 ℃时,若加入0.8 mol A和0.4 mol B,达到平衡时A的体积分数为0.5。若向容器中充入2 mol A和1 mol B,即增大了反应物的浓度,同时容器内气体的压强增大。根据平衡移动原理:增大压强,化学平衡向压强减小的方向移动。所以达到平衡时,A的体积分数小于0.5,D错误。 题组二 有关化学平衡原理的综合应用 4.(2017年·丽水、衢州、湖州三地市9月教学质量检测)据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。 (1)甲烷重整是提高甲烷利用率的重要方式,有以下三种: 部分氧化:CH4(g)+O2(g)CO(g)+2H2(g) ΔH1=-35.9 kJ·mol-1 ① 水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH2=205.9 kJ·mol-1② CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1③ 二氧化碳重整:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH4④ 反应②自发进行的条件是________,ΔH4=________kJ·mol-1。 (2)水蒸气重整是较为传统的甲烷制氢途径。在Fe2O3—Ni—gel催化下,CH4和H2O的混合气体进行反应,测得气体的成分随温度、压强、S/C (水蒸气和甲烷的体积比)的变化分别如图1、图2、图3所示: ①下列说法正确的是________。 A.800~1 000 ℃,CO2体积分数减小,原因是温度升高抑制了反应③ B.温度升高对氢气的生成有促进作用,温度越高,氢气的产率也越大 C.随着压强的增大,CH4的平衡转化率增大 D.其他条件相同时,将S/C由1增加至3,可提高CH4的平衡转化率及CO2和CO的体积分数 ②综合考虑,甲烷、水蒸气重整制氢合适的温度是________、压强是________。 (3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp)。请在下图画出反应①Kp1随温度变化的趋势曲线。 答案 (1)高温 247.1 (2)①AB ② 800 ℃左右(在800~1 000 ℃之间都可以) 常压或1 MPa (3)(如图,趋势正确即可) 解析 (1)反应②是吸热的熵值增大的可逆反应,根据ΔG=ΔH-TΔS<0可知自发进行的条件是高温;根据盖斯定律可知②-③即得到反应④的ΔH4=247.1 kJ·mol-1。 (2)①A项,反应③是放热反应,温度升高反应逆向进行,因此800~1 000 ℃,CO2 体积分数减小,正确;B项,反应②是吸热反应,温度升高对氢气的生成有促进作用,温度越高,氢气的产率也越大,正确;C项,反应②是体积增大的可逆反应,随着压强的增大,CH4的平衡转化率降低,错误;D项,其他条件相同时,将S/C由1增加至3,CH4的平衡转化率和CO2的体积分数增大,CO体积分数减小,错误,答案选AB。②综合以上分析与图像变化趋势可判断甲烷、水蒸气重整制氢合适的温度是800 ℃左右(在800~1 000 ℃之间都可以),压强是常压或1 MPa。(3)反应①是放热反应,升高温度平衡常数降低,因此反应①Kp1随温度变化的趋势曲线图为 。 5.(2017·温州市高三9月选考适应性测试)CO2回收资源化利用是环保领域研究的热点课题。 (1)在FeO催化下,以CO2为原料制取炭黑(C)的太阳能工艺如图1所示。 已知:①过程1生成1 mol C(s)的反应热为ΔH1。 ②过程2反应:Fe3O4(s)3FeO(s)+O2(g) ΔH2。 上述以CO2为原料制取炭黑总反应的热化学方程式为 ________________________________________________________________________, 若该反应的ΔS<0,请判断该反应是否为自发反应并说明理由:_______________________。 (2)以CO2为原料可以催化加氢合成低碳烯烃,利用CO2合成乙烯的反应方程式为2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH3。在常压下,以 FeCoMnK/BeO 作催化剂,按n(CO2)∶n(H2)=1∶3(总物质的量为4a mol)的投料比充入密闭容器中发生反应。测得温度对CO2的平衡转化率和催化剂催化效率影响情况如图2所示。 ①下列说法不正确的是________。 A.ΔH3<0;平衡常数:KM>KN B.增加原催化剂的表面积,对平衡转化率无影响 C.生成乙烯的速率:v(M)有可能小于v(N) D.若投料比改为n(CO2)∶n(H2)=1∶2,可以提高CO2的平衡转化率 E.若投料比不变,温度越低,反应一定时间后CO2的转化率越高 ②250 ℃时,上述反应达平衡时容器体积为V L,则此温度下该反应的平衡常数为________(用含a、V的代数式表示)。 ③某温度下,n(C2H4)随时间(t)的变化趋势曲线如图3所示。其他条件相同时,若容器的体积为其一半,画出0~t1时刻n(C2H4)随时间(t)的变化趋势曲线。 答案 (1)CO2(g)===C(s)+O2(g) ΔH1+2ΔH2 该反应为非自发反应,因为该反应的ΔH>0,ΔS<0 (2)①DE ②K= ③ 解析 (1)①过程1生成1 mol C(s)的反应热为ΔH1,可知过程1的热化学方程式为CO2 (g)+6FeO(s)===C(s)+2Fe3O4(s) ΔH1;②过程2反应:Fe3O4(s)3FeO(s)+O2(g) ΔH2;根据盖斯定律①+2×②,得CO2(g)===C(s)+O2(g) ΔH1+2ΔH2。该反应的ΔH>0,ΔS<0,ΔH-TΔS>0,所以该反应为非自发反应。 (2)①根据图2可知,随温度升高CO2的平衡转化率减小,即升高温度平衡逆向移动,所以ΔH3<0,平衡常数:KM >KN,故A正确;催化剂对平衡移动无影响,故B正确;根据图2可知,M点催化剂的催化效率大于N点,M点的温度低于N点,所以v(M)有可能小于v(N),故C正确;增大氢气的比例,可以提高CO2的平衡转化率,若投料比改为n(CO2)∶n(H2)=1∶2,降低CO2的平衡转化率,故D错误;温度越低,反应速率越慢,反应一定时间后CO2的转化率可能较低,故E错误。②根据图2可知,250 ℃时,CO2的平衡转化率为50%, 2CO2(g)+6H2(g)C2H4(g)+4H2O(g) 开始浓度/mol·L-1 0 0 转化浓度/mol·L-1 平衡浓度/mol·L-1 - - K== 。 ③其他条件相同时,若容器的体积为其一半,压强增大反应速率加快,达到平衡用的时间减少,增大压强平衡正向移动,平衡时乙烯的物质的量增大,图像为 。 1.(2017·浙江11月选考,16)已知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,起始反应物为N2和H2,物质的量之比为1∶3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中NH3的物质的量分数如下表: 温度 物质的量分数 400 ℃ 450 ℃ 500 ℃ 600 ℃ 压强 20 MPa 0.387 0.274 0.189 0.088 30 MPa 0.478 0.359 0.260 0.129 下列说法正确的是( ) A.体系中NH3的物质的量分数越大,则正反应速率越大 B.反应达到平衡时,N2和H2的转化率之比均为1 C.反应达到平衡时,放出的热量均为92.4 kJ D.600 ℃、30 MPa下反应达到平衡时,生成NH3的物质的量最多 答案 B 解析 正反应速率与反应物的浓度有关,且反应物浓度越大反应速率越快,而NH3是产物,故A错误;N2和H2的物质的量之比为1∶3,反应消耗也是1∶3,故N2和H2的转化率相同,故B正确;当1 mol N2参与反应时放出的热量为92.4 kJ,而题目中没有确定反应的量,故C错误;由表格可知600 ℃、30 MPa下反应达到平衡时,NH3的物质的量分数相对于500 ℃、30 MPa时减小,故D错误。 2.(2017·浙江11月选考,21)在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙醇进料量(单位:mL·min-1)的关系如图所示(保持其他条件相同)。 在410~440 ℃温度范围内,下列说法不正确的是( ) A.当乙醇进料量一定,随乙醇转化率增大,乙烯选择性升高 B.当乙醇进料量一定,随温度的升高,乙烯选择性不一定增大 C.当温度一定,随乙醇进料量增大,乙醇转化率减小 D.当温度一定,随乙醇进料量增大,乙烯选择性增大 答案 A 解析 由图像可知,当乙醇进料量一定,随乙醇转化率增大,乙烯选择性先升高后减小,故A选项错误;由图像可知,当乙醇进料量一定,随温度的升高,乙烯选择性先升高后减小,故B选项正确;由图像可知,当温度一定,随乙醇进料量增大,乙醇转化率减小,故C选项正确;由图像可知,当温度一定,随乙醇进料量增大,乙烯选择性增大,故D选项正确。 3.(2017·浙江4月选考,12)已知:X(g)+2Y(g)3Z(g)ΔH=-a kJ·mol-1(a >0)。下列说法不正确的是( ) A.0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol B.达到化学平衡状态时,X、Y、Z的浓度不再发生变化 C.达到化学平衡状态时,反应放出的总热量可达a kJ D.升高反应温度,逆反应速率增大、正反应速率减小 答案 D 解析 已知该反应属于可逆反应,0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol,A正确;达到化学平衡状态时正、逆反应速率相等,X、Y、Z的浓度不再发生变化,B正确;虽然该反应属于可逆反应,达到化学平衡状态时,如果生成3 mol Z,则反应放出的总热量等于a kJ,C正确;升高反应温度,正、逆反应速率均增大,D错误。 4.(2017·浙江4月选考,21)对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。 时间 水样 0 5 10 15 20 25 Ⅰ(pH=2) 0.40 0.28 0.19 0.13 0.10 0.09 Ⅱ(pH=4) 0.40 0.31 0.24 0.20 0.18 0.16 Ⅲ(pH=4) 0.20 0.15 0.12 0.09 0.07 0.05 Ⅳ(pH=4、含Cu2+) 0.20 0.09 0.05 0.03 0.01 0 下列说法不正确的是( ) A.在0~20 min内,Ⅰ中M的分解速率为0.015 mol·L-1·min-1 B.水样酸性越强,M的分解速率越快 C.在0~25 min内,Ⅲ中M的分解百分率比Ⅱ大 D.由于Cu2+存在,Ⅳ中M的分解速率比Ⅰ快 答案 D 解析 在0~20 min内,Ⅰ中M的分解速率为=0.015 mol·L-1·min-1,A正确;根据实验Ⅰ、Ⅱ数据对比可判断水样酸性越强,M的分解速率越快,B正确;在0~25 min内,Ⅲ中M的分解百分率是×100%=75%,Ⅱ中M的分解百分率是×100%=60%,C正确;Ⅰ、Ⅳ中pH不同,D错误。 5.(2016·浙江10月选考,12)在一定条件下,可逆反应X(g)+2Y(g)2Z(g) ΔH=-a kJ·mol-1,达到化学平衡时,下列说法一定正确的是 ( ) A.反应放出a kJ热量 B.X和Y的物质的量之比为1∶2 C.反应物和生成物的浓度都不再发生变化 D.X的正反应速率等于Z的逆反应速率 答案 C 解析 A项,由于该反应为可逆反应,且没给出反应物的物质的量,所以反应放出的热量不确定;B项,达到平衡时,X、Y的物质的量之比不一定为1∶2,它和起始量、转化率均有关系;D项,达到平衡时,X的正反应速率与Z的逆反应速率应符合其化学计量数之比。 6.(2016·浙江10月选考,21)为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( ) A.25 ℃时,在10~30 min内,R的分解平均速率为0.030 mol·L-1·min-1 B.对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等 C.对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的分解平均速度随温度升高而增大 D.对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大 答案 D 解析 A项,v(R)==0.030 mol·L-1·min-1,正确;B项,在50 min时,两个温度下R全部分解,分解率均为100%,正确;C项,在50 min时,30 ℃时,R分解了1.6 mol·L-1,而在25 ℃时,R分解了1.3 mol·L-1,所以在0~50 min内,R的平均分解速率随温度升高而增大,正确;D项,对比30 ℃和10 ℃的曲线,不能在同一时刻,应指明在同一段时间内R的分解速率随温度升高而增大,错误。 7.[2017·浙江11月选考,30(一)(1)(2)](一)十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知: C10H18(l)C10H12(l)+3H2(g) ΔH1 C10H12(l)C10H8(l)+2H2(g) ΔH2 ΔH1>ΔH2>0,C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192 ℃;在192 ℃,液态十氢萘脱氢反应的平衡转化率约为9%。 请回答: (1)有利于提高上述反应平衡转化率的条件是_____________________________________。 A.高温高压 B.低温低压 C.高温低压 D.低温高压 (2)研究表明,将适量十氢萘置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是_______________________________________________________________。 答案 (1)C (2)温度升高加快反应速率;反应吸热,平衡正向移动,温度升高使平衡正向移动的作用大于压强增大使平衡逆向移动的作用 解析 (1)提高平衡转化率即平衡正向移动,应该升温、降压。所以选择高温低压,选C。 8.[2017·浙江4月选考,30(1)(2)]以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。 请回答: (1)已知:2Al2O3(s)===4Al(g)+3O2(g) ΔH1=3 351 kJ·mol-1 2C(s)+O2(g)===2CO(g) ΔH2=-221 kJ·mol-1 2Al(g)+N2(g)===2AlN(s) ΔH3=-318 kJ·mol-1 碳热还原Al2O3合成AlN的热化学方程式是___________________________________ ________________________________________________________________________, 该反应自发进行的条件________。 (2)在常压、Ru/TiO2催化下,CO2和H2混合气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。 反应 Ⅰ CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH4 反应Ⅱ CO2(g)+H2(g)CO(g)+H2O(g) ΔH5 图1 图2 ①下列说法不正确的是________。 A.ΔH4小于零 B.温度可影响产物的选择性 C.CO2平衡转化率随温度升高先增大后减少 D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率 ②350 ℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为________(用a、V表示)。 ③350 ℃下CH4物质的量随时间的变化曲线如图3所示。画出400 ℃下0~t1时刻CH4物质的量随时间的变化曲线。 图3 答案 (1)Al2O3(s)+3C(s)+N2(g)===2AlN(s)+3CO(g) ΔH=1 026 kJ·mol-1 高温 (2)①CD ② ③ 解析 (1)已知:①2Al2O3(s)===4Al(g)+3O2(g) ΔH1=3 351 kJ·mol-1,②2C(s)+O2(g)===2CO(g) ΔH2=-221 kJ·mol-1,③2Al(g)+N2(g)===2AlN(s) ΔH3=-318 kJ·mol-1,根据盖斯定律①×+②×+③即得到碳热还原Al2O3合成AlN的总热化学方程式:3C(s)+Al2O3(s)+N2(g)===2AlN(s)+3CO(g) ΔH=1 026 kJ·mol-1。正反应是吸热的、熵增加的反应,因此该反应自发进行的条件是高温。 9.[2016·浙江10月选考,30(1)(2)③]氯及其化合物在生活和生产中应用广泛。 (1)已知:900 K时,4HCl(g)+O2(g)2Cl2(g)+2H2O(g),反应自发。 ①该反应是放热还是吸热,判断并说明理由___________________________________ ________________________________________________________________________。 ②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。 (2)③有研究表明,生成NaClO3的反应分两步进行: Ⅰ.2ClO-===ClO+ Cl- Ⅱ.ClO+ClO-===ClO+Cl- 常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:__________________________________________________________ ________________________________________________________________________。 答案 (1)①放热反应,因为ΔS<0且反应自发,根据ΔG=ΔH-TΔS<0可知反应放热 ② (2)③反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO转化 解析 (1)①该反应是ΔS<0,而且是自发进行的反应,根据公式ΔG=ΔH-TΔS<0,可知ΔH<0,该反应是放热反应。②该反应的正反应是气体体积减小的放热反应,根据平衡移动原理,升高温度,平衡逆向移动,HCl转化率降低;在温度不变时,增大压强,平衡正向移动,反应物的转化率增大,所以在温度是T K及压强为1.5×105~4.5×105 Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线是。(2)③常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,是由于反应Ⅰ活化能高,活化分子百分数低,不利于ClO-向ClO转化。 专题强化练 [必考题组] 1.(2017·金华东阳中学月考)下列四种X溶液,均能跟盐酸反应,分别加入四个盛有10 mL 12 mol·L-1盐酸的烧杯中,均加水稀释到100 mL,其中反应最快的是( ) A.10 ℃ 20 mL 3 mol·L-1的X溶液 B.20 ℃ 30 mL 2 mol·L-1的X溶液 C.20 ℃ 10 mL 4 mol·L-1的X溶液 D.10 ℃ 10 mL 2 mol·L-1的X溶液 答案 B 解析 此题考查温度、浓度对反应速率的影响:温度越高,反应速率越快;反应物浓度越大,反应速率越快。 2.(2017·金华东阳中学月考)在一定温度下,向某恒压的密闭容器中加入1 mol N2和3 mol H2,发生如下反应:N2(g)+3H2(g)2NH3(g)。此反应达到平衡的标志是( ) A.N2、H2、NH3三者共存 B.容器内气体的密度不再发生变化 C.N2、H2和NH3的物质的量浓度相等 D.单位时间消耗0.1 mol N2的同时生成0.2 mol NH3 答案 B 解析 可逆反应,没达到平衡状态时也是三者共存,A错误;根据ρ= ,气体质量是恒量、容器体积是变量,所以密度为变量,密度不再发生变化,一定达到平衡,B正确;浓度相等但不是浓度不变,C错误;单位时间消耗0.1 mol N2的同时生成0.2 mol NH3,都是描述正反应速率,不一定达到平衡,D错误。 3.(2017·浙江省建人高复高三下学期第四次月考)在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应A(s)+2B(g)C(g)+D(g)已达平衡状态的是( ) A.混合气体的压强 B.混合气体的密度 C.B的物质的量浓度 D.混合气体的平均相对分子质量 答案 A 4.(2017·金华市兰溪一中高三月考)在一定温度下的恒容密闭容器中,下列不是可逆反应A(g)+3B(g)C(g)达到平衡标志的是( ) A.3v正(A)=v逆(B) B.单位时间内生成a mol A,同时生成3a mol B C.A、B、C的浓度不再变化 D.容器内的总压强不再变化 答案 B 解析 A项,化学平衡时,应有3v正(A)=v逆(B),故A正确;B项,只要反应发生,就有单位时间内生成a mol A,同时生成3a mol B,所以不一定平衡,故B错误;C项,A、B、C的浓度不再变化,说明正、逆反应速率相等,达到平衡状态,故C正确;D项,容器内的总压强不再变化,说明气体的物质的量不变,反应达到平衡状态,故D正确。 5.(2017·金华十校高三第一学期期末)一定温度下,将0.2 mol X和0.1 mol Y通入到2 L密闭容器中,发生反应:2X(g)+Y(g)aZ(g),2 min后达到平衡,测得n(Y)=0.04 mol,v(Z)=0.045 mol·L-1·min-1,下列说法正确的是( ) A.平衡后,v逆(X)=2v正(Y) B.平衡后,c(X)=0.08 mol·L-1 C.当容器总压强保持不变时,反应达到平衡 D.从反应开始至平衡,气体密度逐渐增大 答案 A 6.(2017·衢州市高三1月教学质量检测)一定条件下,0.3 mol X(g)与0.3 mol Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g)2Z(g) ΔH=-a kJ·mol-1,下列说法正确的是( ) A.反应一段时间后,X与Y的物质的量之比仍为1∶1 B.达到平衡时,该反应放出0.1a kJ的热量 C.达到平衡后,若向平衡体系中充入稀有气体,Z的正反应速率将不发生变化 D.X的体积分数保持不变,说明反应已达到平衡 答案 C 解析 反应过程中X与Y的变化量是1∶3,则反应一段时间后,X与Y的物质的量之比不可能仍为1∶1,故A错误;达到平衡时,因不知道变化的X的物质的量,无法确定反应放出0.1a kJ的热量,故B错误;恒容条件下,达到平衡后,若向平衡体系中充入稀有气体,不影响反应物和生成物的浓度,反应速率也不变,故C正确; X(g) + 3Y(g) 2Z(g) 起始物质的量/mol 0.3 0.3 0 变化物质的量/mol x 3x 2x 变化后物质的量/mol 0.3-x 0.3-3x 2x X的体积分数×100%=50%,始终保持不变,不能说明反应已达到平衡,故D错误。 7.(2017·宁波市十校高三9月联考)工业上主要利用碳热还原重晶石制得硫化钡,进而生产各种钡化合物。下图为不同反应温度下,实验中碳热还原硫酸钡反应体系的平衡组成随反应温度的变化关系。下列说法正确的是( ) A.约150 ℃,体系中开始出现BaS,说明温度越高反应速率越快 B.400 ℃时发生反应的化学方程式: BaSO4+2CBaS+2CO2↑ C.CO一定无法还原重晶石 D.温度高于400 ℃后,硫酸钡才能转化为BaS 答案 B 解析 A项,根据图像,约在150 ℃时,体系中开始出现BaS,说明反应在150 ℃时开始,不能说明温度越高反应速率越快,错误;B项,根据图像,在400 ℃时,BaSO4物质的量百分数为0,150~400 ℃ C的物质的量百分数减小,BaS物质的量百分数增大,CO2的物质的量分数增大,因此400 ℃时反应物是BaSO4和C,生成物是CO2和BaS,反应方程式为BaSO4+2CBaS+2CO2↑,正确;C项,CO常作还原剂,能还原BaSO4,错误;D项,根据图像,约在150 ℃左右BaSO4就可转化成BaS,错误。 8.(2016·杭州市第二中学高二上学期期末)下列对化学平衡移动的分析中,不正确的是( ) ①已达平衡的反应C(s)+H2O(g)CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应移动 ②已达平衡的反应N2(g)+3H2(g)2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应平衡时,若减小反应器容积时,平衡一定移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动 A.①④ B.①③④ C.①②③ D.①②③④ 答案 D 解析 ①反应中C为纯固体,增加C的量,平衡不移动,错误;②增大N2的浓度,促进氢气的转化,平衡向正反应方向移动,但氮气的转化率减小,错误;③若反应前后气体的化学计量数之和相等,减小反应器容积时,平衡不移动,错误;④恒压反应器中充入稀有气体,相当于减小压强,对于反应前后气体的化学计量数之和相等的反应,平衡不移动,对于反应前后气体的化学计量数之和不等的反应,平衡发生移动,错误。故选D。 9.(2017·温州十五校联合体高二期中)已知反应:2CH3COCH3(l)CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数(反应物已转化为产物的物质的量和反应物总物质的量的比)随时间变化的关系曲线(Yt)如图所示。下列说法正确的是( ) A.b代表0 ℃下CH3COCH3的Yt曲线 B.反应进行到20 min末,CH3COCH3的的比值大于1 C.升高温度可以缩短反应达到平衡的时间并能提高反应物转化为生成物的物质的量 D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的的比值等于1 答案 D 解析 A项,温度越高反应速率就越快,到达平衡的时间就越短,由图像可看出曲线b首先达到平衡,所以曲线b表示的是20 ℃时的Yt曲线,错误;B项,当反应进行到20 min时,从图像中可以看出b曲线对应的转化分数高于a曲线对应的转化分数,这说明b曲线在20 ℃时对应的反应速率快,所以<1,错误;C项,根据图像温度越高CH3COCH3转化的越少,说明升高温度平衡向逆反应方向进行,即降低反应物转化为生成物的物质的量,错误;D项,根据图像可以看出当反应进行到66 min时,a、b曲线对应的转化分数均相同,都是0.113,这说明此时生成的CH3COCH2COH(CH3)2一样多,所以从Y=0到Y=0.113,CH3COCH2COH(CH3)2的=1,正确。 10.(2017·温州市高三第二次选考)在某密闭恒容容器中发生反应:X(g)Y(g)+nZ(g) ΔH=Q kJ·mol-1(Q>0)。反应体系2 min时达到平衡后,各物质的浓度在不同条件下的变化如下图所示。(第12 min到16 min的X浓度变化曲线未标出),下列说法不正确的是( ) A.反应方程式中n=1 B.12~14 min内,用Y表示的平均速率为0.005 mol·L-1·min-1 C.在6~10 min内,反应吸收的热量为0.015Q kJ D.第12 min时,Z曲线发生变化的原因是移走一部分Z 答案 C 解析 根据图像可知6~10 min内X减少了0.055 mol·L-1-0.040 mol·L-1=0.015 mol·L-1,Z增加了0.085 mol·L-1-0.070 mol·L-1=0.015 mol·L-1,因此反应方程式中n=1,A正确;12~14 min内,用Y表示的平均速率==0.005 mol·L-1·min-1,B正确;在6~10 min内X减少了0.015 mol·L-1,但容器容积未知,因此不能计算反应吸收的热量,C错误;第12 min时Z的浓度瞬间减小,随后逐渐增大,这说明Z曲线发生变化的原因是移走一部分Z,D正确。 [加试题组] 11.(2017·金华市高三9月十校联考)碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题: (1)工业炼铁时有如下副反应:Fe(s)+CO2(g)FeO(s)+CO(g) ΔH>0,该反应能正向自发进行的原因是_________________________________________________________________。某温度时,把Fe和CO2放入体积固定的容器中,CO2 的起始浓度为2.0 mol·L-1,达到平衡后,CO的浓度为1.0 mol·L-1,则该温度下,该反应的平衡常数K=________。如果平衡后,再通入一定量的CO,则CO2的物质的量分数将________(填字母)。 A.增大 B.减少 C.不变 (2)已知反应Fe(s)+CO2(g)FeO(s)+CO(g) ΔH>0的逆反应速率随时间变化的关系如下图,t1—升温,t2—达到平衡,请在图上画出t1~t3时的v逆的变化曲线。 答案 (1)ΔS>0,高温条件可自发进行 1.0 C (2) 解析 (1)影响反应方向的因素有焓变和熵变,该反应吸热,根据焓变反应不能自发进行,所以该反应能正向自发进行的原因是ΔS>0,高温条件可自发进行; Fe(s)+CO2(g)FeO(s)+CO(g) 初始浓度/mol·L-1 2.0 0 转化浓度/mol·L-1 1.0 1.0 平衡浓度/mol·L-1 1.0 1.0 反应的平衡常数K===1.0 再通入一定量的CO,平衡常数不变,CO、CO2的比例不变,所以CO2的物质的量分数将不变。(2)升温,正、逆反应速率均突然增大,平衡正向移动,所以t1~t2之间逆反应速率逐渐增大,t2达到平衡,t2~t3之间速率保持不变,图像为。 12.(2017·宁波市十校高三9月联考)尿素(NH2CONH2)是目前含氮量最高的氮肥。国内外主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行: 第一步:2NH3(l)+CO2(g)H2NCOONH4(l) ΔH1=-117.2 kJ·mol-1 第二步:H2NCOONH4(l)H2O(l)+H2NCONH2(l) ΔH2=21.7 kJ·mol-1 请回答: (1)已知:NH3(l) NH3(g) ΔH3=c kJ·mol-1。火电厂烟气脱硝所使用的还原剂氨气主要来自于尿素水解。则反应NH2CONH2(l)+H2O(l)2NH3(g)+CO2(g) ΔH4=________kJ·mol-1 (用含c的式子表示),该反应能在常温下缓慢发生的主要原因是__________________________ ________________________________________________________________________。 (2)①一定条件下,对NH2COONH4的平衡转化率会产生明显的影响,如图1所示。NH2COONH4的平衡转化率随增大而上升,试分析其原因: ________________________________________________________________________。 ②恒温密闭容器中,一定量的NH3和CO2反应合成尿素,第10 min达到平衡。若相同条件下反应1的速率要快于反应2,请在图中画出0~15 min内,NH2COONH4的物质的量浓度随时间的变化曲线。 ③下图表示不同条件下,反应:N2(g) +3H2(g)2NH3(g)的产物浓度随时间的变化曲线。 下列有关说法中,正确的是________。 A.达到平衡时间最快的是Ⅱ B.反应约10分钟后,三个反应均已达到平衡 C.Ⅰ条件下氢气的平衡转化率大于Ⅱ D.三个反应的平衡常数一定相同 答案 (1)95.5+2c 该反应是熵增反应,有利于反应正向进行 (2)①过量的氨气和产物水进一步反应,使反应2的化学平衡正向移动,从而使NH2COONH4的平衡转化率上升 ② ③A 解析 (1)①2NH3(l)+CO2(g)H2NCOONH4(l),②H2NCOONH4(l)H2O(l)+H2NCONH2(l),③NH3(l)NH3(g),根据盖斯定律,2×③-(①+②)得出:ΔH4=(95.5+2c)kJ·mol-1;此反应是熵增反应,有利于反应正向进行。(2)②相同条件下,反应1的速率快于反应2,因此生成H2NCOONH4曲线比消耗H2NCOONH4曲线陡,在10 min时达到平衡,即10 min到15 min应是平行x轴的直线,即图像是; ③A项,根据图像,Ⅱ首先达到平衡,即Ⅱ的反应速率最快,正确;B项,反应到10 min,Ⅰ和Ⅱ达到平衡,Ⅲ不知道10 min后的曲线,因此无法判断Ⅲ是否达到平衡,错误;C项,题目中没有说明改变的条件,如果Ⅰ改变的条件是通入H2,虽然平衡向正反应方向进行,但氢气的转化率降低,如果Ⅱ是增大压强,平衡向正反应方向进行,氢气的转化率增大,错误;D项,如果Ⅱ是升高温度,反应速率加快,但化学平衡常数降低,如果Ⅰ是通入氢气,温度不变,平衡常数不变,则两者平衡常数不相同,错误。 13.(2016·绍兴市第一中学高二上学期期末)进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”。引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气。 Ⅰ.已知反应N2O4(g)2NO2(g) ΔH,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。 a.气体颜色不再改变 b.ΔH不再改变 c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变 Ⅱ.用NH3催化还原NOx可以消除氮氧化物的污染。如下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理: NO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g)。 (1)该反应的ΔS________(填“>”“=”或“<”)0。 (2)以下说法正确的是________。 A.第②种催化剂比第①种催化剂脱氮率高 B.相同条件下,改变压强对脱氮率没有影响 C.催化剂①②分别适合于250 ℃和450 ℃左右脱氮 Ⅲ.用CH4催化还原NOx也可以消除氮氧化物的污染。 (3)已知:CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=-844 kJ·mol-1 在温度为T1 ℃和T2 ℃时,分别将0.5 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得NO2的物质的量随时间变化数据如下表: 时间/min 温度/℃ 0 10 20 40 50 T1 1.2 0.9 0.7 0.4 0.4 T2 1.2 0.8 0.56 … 0.5 ①温度为T1 ℃时,0~20 min内,v(CH4)=________。 ②T1________(填“>”或“<”,下同)T2;判断理由是_________________________________ _______________________________________________________________________________ ________________________________________________________________________。 ③T1 ℃时,反应CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)平衡常数K=________。 ④温度为T2 ℃时,达平衡后,再向容器中加入0.5 mol CH4和1.2 mol NO2,达新平衡时CH4 的转化率将________(填“增大”“减小”或“不变”)。 答案 Ⅰ.ad Ⅱ.(1)> (2)C Ⅲ.(3)①0.012 5 mol·L-1·min-1 ②< 该反应为放热反应,升高温度平衡逆向移动,NO2浓度增大 ③6.4 ④减小 解析 Ⅰ.透光率不再发生改变,说明二氧化氮的浓度不变,反应达到平衡。a项,气体颜色不再改变,说明二氧化氮浓度不变,透光率不再发生改变,正确;b项,焓变ΔH与是否达到平衡无关,与物质的聚集状态与化学计量数有关,错误;c项,应是2v正(N2O4)=v逆(NO2)时,反应达到平衡,二氧化氮的浓度不变,错误;d项,N2O4的转化率不再改变,反应达到平衡,二氧化氮的浓度不变,透光率不再发生改变,正确。故选ad。 Ⅱ.(1)反应前气体的化学计量数之和为4,反应后计量数之和为5,正反应是混乱度增加的反应,所以ΔS>0;根据①、②图像可知,温度升高一定程度后再升高温度,氮氧化物的转化率减小,说明升高温度平衡逆向移动,正反应为放热反应,ΔH<0。 (2)A项,催化剂不会影响转化率,只影响反应速率,所以第②种催化剂和第①种催化剂对转化率没有影响,错误;B项,该反应为体积增大的反应,增大压强,平衡逆向移动,所以压强对脱氮率有影响,错误;C项,由图像可知,催化剂①、②分别适合于250 ℃和450 ℃左右脱氮,其催化活性最好,正确。 Ⅲ.(3)①温度为T1 ℃时,0~20 min内v(NO2)==0.025 mol·L-1·min-1,速率之比等于化学计量数之比,则v(CH4)=v(NO2)=0.012 5 mol·L-1·min-1。 ②该反应为放热反应,升高温度平衡逆向移动,NO2浓度增大,由表中数据可知,T2温度达到平衡时二氧化氮浓度大,因此温度T1<T2。 ③温度为T1 ℃时,40 min到达平衡,平衡时二氧化氮物质的量为0.4 mol,则: CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) 起始量(mol) 0.5 1.2 0 0 0 变化量(mol) 0.4 0.8 0.4 0.4 0.8 平衡量(mol) 0.1 0.4 0.4 0.4 0.8 容器的体积为1 L,则平衡常数 K===6.4。 ④温度为T2 ℃时,达平衡后,再向容器中加入0.5 mol CH4和1.2 mol NO2,等效于在原平衡基础上增大压强,平衡逆向移动,达新平衡时CH4的转化率将减小。查看更多