- 2021-05-13 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习晶体结构与性质作业
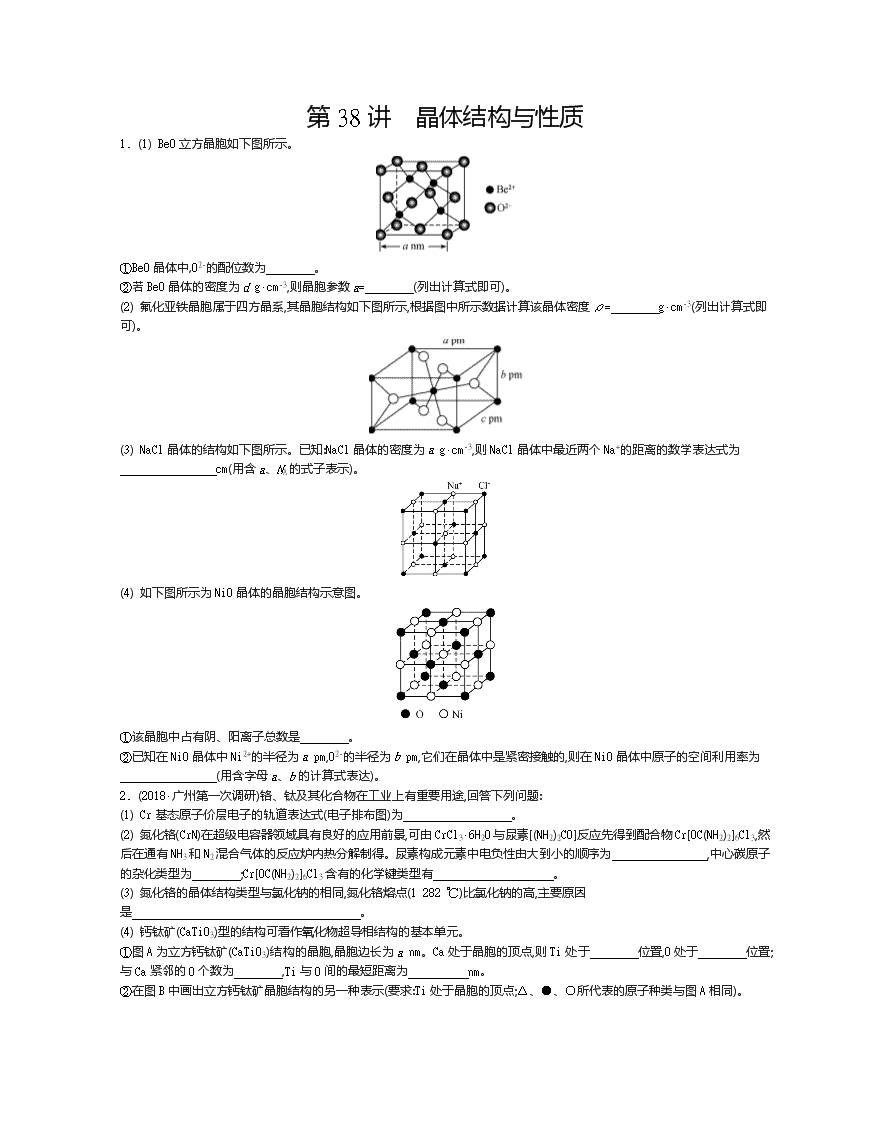
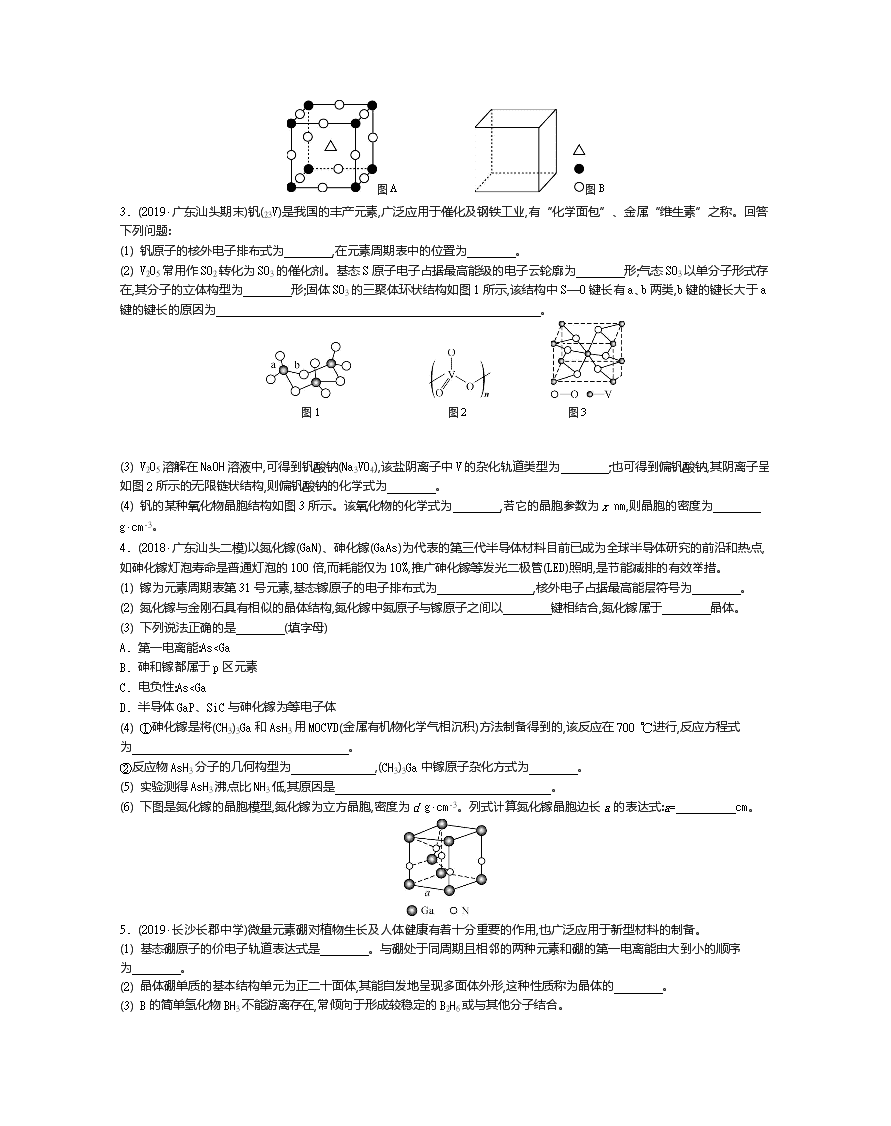
第38讲 晶体结构与性质 1. (1) BeO立方晶胞如下图所示。 ①BeO晶体中,O2-的配位数为 。 ②若BeO晶体的密度为d g·cm-3,则晶胞参数a= (列出计算式即可)。 (2) 氟化亚铁晶胞属于四方晶系,其晶胞结构如下图所示,根据图中所示数据计算该晶体密度ρ= g·cm-3(列出计算式即可)。 (3) NaCl晶体的结构如下图所示。已知:NaCl晶体的密度为a g·cm-3,则NaCl晶体中最近两个Na+的距离的数学表达式为 cm(用含a、NA的式子表示)。 (4) 如下图所示为NiO晶体的晶胞结构示意图。 ①该晶胞中占有阴、阳离子总数是 。 ②已知在NiO晶体中Ni2+的半径为a pm,O2-的半径为b pm,它们在晶体中是紧密接触的,则在NiO晶体中原子的空间利用率为 (用含字母a、b的计算式表达)。 2. (2018·广州第一次调研)铬、钛及其化合物在工业上有重要用途,回答下列问题: (1) Cr基态原子价层电子的轨道表达式(电子排布图)为 。 (2) 氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由CrCl3·6H2O与尿素[(NH2)2CO]反应先得到配合物Cr[OC(NH2)2]6Cl3,然后在通有NH3和N2混合气体的反应炉内热分解制得。尿素构成元素中电负性由大到小的顺序为 ,中心碳原子的杂化类型为 ;Cr[OC(NH2)2]6Cl3含有的化学键类型有 。 (3) 氮化铬的晶体结构类型与氯化钠的相同,氮化铬熔点(1 282 ℃)比氯化钠的高,主要原因是 。 (4) 钙钛矿(CaTiO3)型的结构可看作氧化物超导相结构的基本单元。 ①图A为立方钙钛矿(CaTiO3)结构的晶胞,晶胞边长为a nm。Ca处于晶胞的顶点,则Ti处于 位置,O处于 位置;与Ca紧邻的O个数为 ,Ti与O间的最短距离为 nm。 ②在图B中画出立方钙钛矿晶胞结构的另一种表示(要求:Ti处于晶胞的顶点;△、●、○所代表的原子种类与图A相同)。 图A 图B 3. (2019·广东汕头期末)钒(23V)是我国的丰产元素,广泛应用于催化及钢铁工业,有“化学面包”、金属“维生素”之称。回答下列问题: (1) 钒原子的核外电子排布式为 ,在元素周期表中的位置为 。 (2) V2O5常用作SO2转化为SO3的催化剂。基态S原子电子占据最高能级的电子云轮廓为 形;气态SO3以单分子形式存在,其分子的立体构型为 形;固体SO3的三聚体环状结构如图1所示,该结构中S—O键长有a、b两类,b键的键长大于a键的键长的原因为 。 图1 图2 图3 (3) V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子中V的杂化轨道类型为 ;也可得到偏钒酸钠,其阴离子呈如图2所示的无限链状结构,则偏钒酸钠的化学式为 。 (4) 钒的某种氧化物晶胞结构如图3所示。该氧化物的化学式为 ,若它的晶胞参数为x nm,则晶胞的密度为 g·cm-3。 4. (2018·广东汕头二模)以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能仅为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。 (1) 镓为元素周期表第31号元素,基态镓原子的电子排布式为 ,核外电子占据最高能层符号为 。 (2) 氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以 键相结合,氮化镓属于 晶体。 (3) 下列说法正确的是 (填字母) A. 第一电离能:As查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档