化学高考真题——四川卷解析版
2016年普通高等学校招生全国统一考试(四川卷)
理科综合化学部分
1.化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A.氯气作水杀菌消毒剂
B.硅胶作袋装食品的干燥剂
C.二氧化硫作纸浆的漂白剂
D.肥皂水作蚊虫叮咬处的清洗剂
2.根据下列实验操作和现象得出的结论正确的是
选项
实验操作
现象
结论
A
将某溶液与稀盐酸反应产生的气体通入澄清石灰水
石灰水变浑浊
该溶液中一定含有CO32-
B
常温下,将铁片浸入足量浓硫酸中
铁片不溶解
常温下,铁与浓硫酸钠一定没有发生化学反应
C
向某食盐溶液中滴加淀粉溶液
溶液颜色不变
该食盐中一定没有添加碘化钾
D
向苯酚钠溶液中滴加乙酸溶液
溶液变浑浊
相同条件下,乙酸的酸性一定比苯酚强
3.下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
4.NA为阿伏伽德罗常数的值。下列说法正确的是
A.2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA
B.标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA
C.氢原子数为0.4NA的甲醇分子中含有的σ键数为0.4NA
D.0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA
5.某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-= xLi++ C6
C.充电时,若转移1mole-,石墨C6电极将增重7xg
D.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+
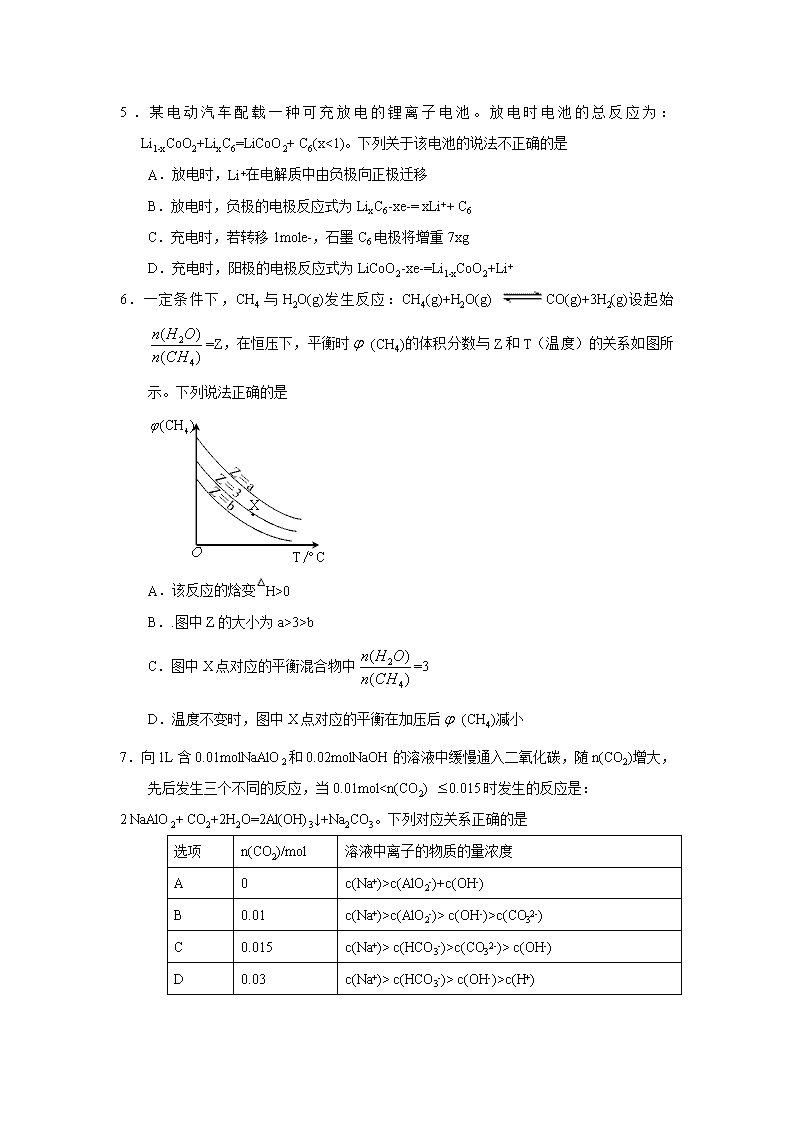
6.一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)设起始=Z,在恒压下,平衡时 (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
A.该反应的焓变△H>0
B..图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中=3
D.温度不变时,图中X点对应的平衡在加压后 (CH4)减小
7.向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol
c(AlO2-)+c(OH-)
B
0.01
c(Na+)>c(AlO2-)> c(OH-)>c(CO32-)
C
0.015
c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)
D
0.03
c(Na+)> c(HCO3-)> c(OH-)>c(H+)
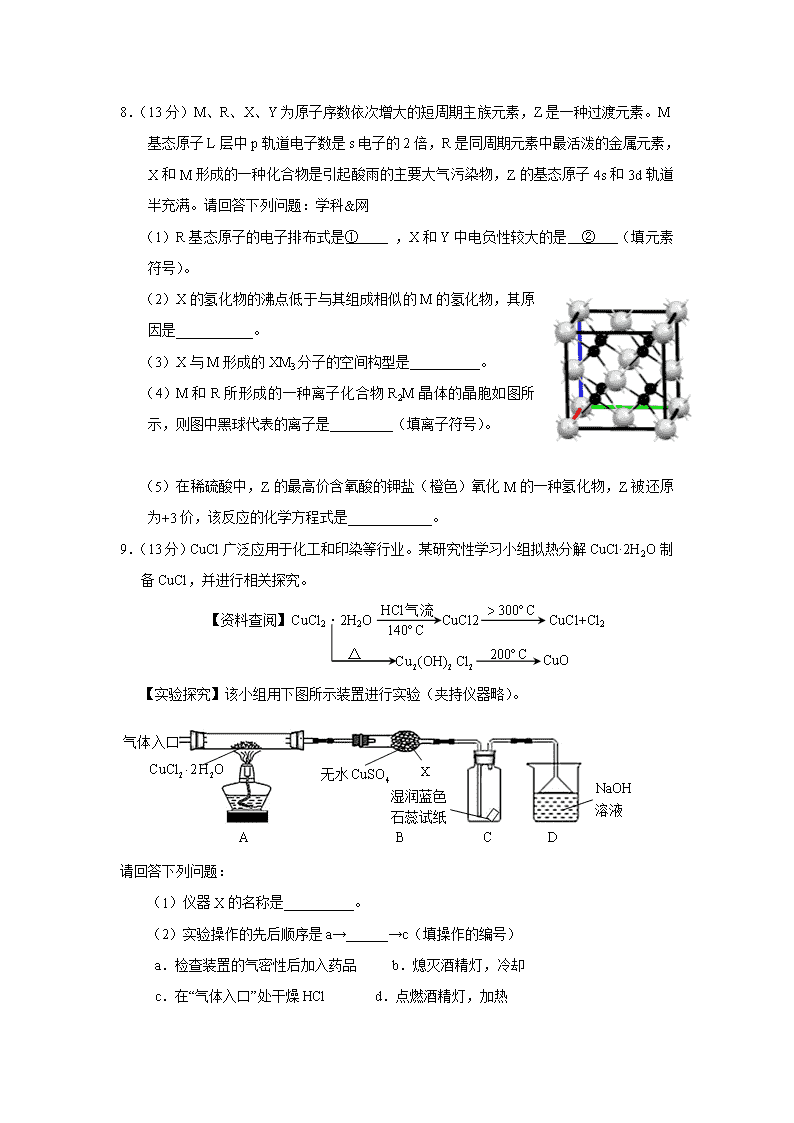
8.(13分)M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:学科&网
(1)R基态原子的电子排布式是① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
9.(13分)CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl·2H2O制备CuCl,并进行相关探究。
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
请回答下列问题:
(1)仪器X的名称是__________。
(2)实验操作的先后顺序是a→______→c(填操作的编号)
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_______。
(4)装置D中发生的氧化还原反应的离子方程式是________________。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是________________。
②若杂质是CuO,则产生的原因是________________。
10.(16分)高血脂严重影响人体健康,化合物E是一种临床治疗高血脂症的药物。E的合成路线如下(部分反应条件和试剂略):
请回答下列问题:
(1)试剂I的名称是____a____,试剂II中官能团的名称是____b___,第② 步的反应类型是____c___。
(2)第①步反应的化学方程式是_____________。
(3)第⑥步反应的化学方程式是_____________。
(4)第⑦步反应中,试剂Ⅲ为单碘代烷烃,其结构简式是_________ 。
(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH。若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y发生缩聚反应所得缩聚物的结构简式是___________。
11. (16分)资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:
已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。学科.网
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是__________。
(4)在浸取液II中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) 学科.网 △H=-271kJ/mol
5 CaO(s)+H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
(6)在一定条件下CO(g)+H2O(g) CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了5/6.若akg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
参考答案与试题解析
1.化学与生产和生活密切相关,下列过程中没有发生化学变化的是( )
A.氯气作水的杀菌消毒剂 B.硅胶作袋装食品的干燥剂
C.二氧化硫作纸浆的漂白剂 D.肥皂水作蚊虫叮咬处的清洗剂
【答案】B
【解析】
考察化学与生活。
A项中,生成的具有强氧化性,可对水进行杀菌消毒;B项中硅胶仅起到吸水干燥的作用,不涉及化学变化;C项中可对纸浆进行漂白,这个过程涉及化学变化;D项中被蚊虫叮咬会产生蚁酸,肥皂水显碱性,涂抹肥皂水发生酸碱中和,可清洗叮咬处。故选B。
2.根据下列实验操作和现象得出的结论正确的是( )
选项
实验操作
现象
结论
A
将某溶液与稀盐酸反应产生的气体通入澄清石灰水
石灰水变浑浊
该溶液中一定含有
B
常温下,将铁片浸入足量浓硫酸中
铁片不溶解
常温下,铁与浓硫酸一定没有发生化学反应
C
向某食盐溶液中滴加淀粉溶液
溶液颜色不变
该食盐中一定没有添加KIO3
D
向苯酚钠溶液中滴加乙酸溶液
溶液变浑浊
相同条件下,乙酸的酸性一定比苯酚强
【答案】D
【解析】
考察实验操作和物质鉴别。
A项中,能使澄清石灰水变浑浊的气体有和,故原溶液中可能含有、、、;B项中常温下铁片浸入浓硫酸中发生钝化,钝化是化学变化; C项中淀粉溶液遇碘单质变为蓝色,并不是遇碘元素变为蓝色,故不能证明该食盐中一定没有添加;D项中发生反应,该反应是强酸制弱酸,可以说明相同条件下乙酸的酸性强于苯酚。故选D。
3.下列关于离子共存或离子反应的说法正确的是( )
A.某无色溶液中可能大量存在H+、、
B.的溶液中可能大量存在、、
C.与H2O2在酸性溶液中的反应:=====
D.稀硫酸与Ba(OH)2溶液的反应:=====
【答案】C
【解析】
考察离子共存和离子方程式的书写。
A项中大量在水溶液中呈现紫色,不满足无色溶液的要求;B项pH=2说明是酸性溶液,存在,而和不能大量共存,会生成硅酸沉淀或胶体;C项中在酸性条件下会被氧化生成,离子方程式为;D项正确的离子方程式应该是。故选C。
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA
B.标准状况下,5.6L CO2气体中含有氧原子数为0.5NA
C.氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
D.0.1L 0.5mol/L CH3COOH溶液中含有的H+数为0.05NA
【答案】B
【解析】
考察阿伏伽德罗常数的计算。
A项中,发生反应,2.4 g的物质的量为0.1 mol,完全燃烧转移的电子数为0.2 NA;B项中,标况下5.6 L其物质的量为0.25 mol,含有的氧原子数为0.5 NA;C项中的结构式为,1 mol含有5 mol的σ键,故氢原子数为0.4 NA的其物质的量为0.1 mol,含有0.5 NA的σ键;D项由于是弱酸,在水中只能部分电离,故0.1 L、0.5 mol/L的溶液中数目小于0.05 NA。故选B。
5.某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为:
Li1-xCoO2+LixC6====LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6x e====x Li++C6
C.充电时,若转移,石墨(C6)电极将增重7x g
D.充电时,阳极的电极反应式为LiCoO2x e====Li1-x CoO2+x Li+
【答案】C
【解析】
考察原电池和电解池。
A项,放电时,在负极生成,由负极向正极迁移;B项,负极发生氧化反应,失去电子,电极反应式为;C项中,充电时,总反应为,石墨电极的电极反应式为,由反应关系可知,每转移1 mole-,生成 mol,增重7 g;D项中,充电时,阳极发生氧化反应,其电极反应式为。故选C。
6.一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。 设起始,在恒压下,平衡时CH4的体积分数与Z和T(温度)的关系如右图所示,下列说法正确的是( )
A.该反应的焓变
B.图中Z的大小为
C.图中X点对应的平衡混合物中
D.温度不变时,图中X点对应的平衡在加压后减小
【答案】A
【解析】
考察化学平衡。
A项中,由图像可知,任取一条平衡曲线,温度升高,平衡时的体积分数减小,说明温度升高,平衡正向移动,则正反应是吸热反应,ΔH>0;B项由图可知,增大水和甲烷的投料比,会增大甲烷的转化率,从而使平衡时甲烷的体积分数减小,所以b>3>a;C项中,X点对应的曲线 =3,温度升高,平衡正向移动,设平衡后,参与反应的 =a mol,则平衡时二者的比值为 必然大于3;D项中,若温度不变,X点对应的平衡加压后,反应逆向移动,的体积分数会增加。故选A。
7.向1L含0.01mol NaAlO2和0.02mol NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当时发生的反应是( )
====。下列对应关系正确的是
选项
n(CO2)/mol
溶液中离子的物质的量浓度
A
0
B
0.01
C
0.015
D
0.03
【答案】D
【解析】
考察溶液中离子浓度的关系。
A项中,未通入时,由电荷守恒可知,溶液中,则;B项通入了0.01 mol,发生反应:,由于酸性,故水解程度,所以离子浓度应该是;C项中此时溶液的溶质只有,故其离子浓度应该是;D项中,通入了0.03 mol后,溶质为,由于溶液呈碱性,故离子浓度为。故选D。
第II卷(非选择题,共58分)
8.(13分)M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 。
(3)X与M形成的XM3分子的空间构型是 。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是 (填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 。
【答案】
(1)1s22s22p63s1或[Ne]3s1,Cl
(2)分子间存在氢键,而分子间没有氢键
(3)平面三角形
(4)
(5)
【解析】
首先推断各种元素。M元素的2p电子数是2s的2倍,故价电子排布应为2s22p4,M为氧元素。R的原子序数比氧大,又是短周期金属,故只能是第三周期。第三周期最活泼的金属是钠。X与M的化合物,引起酸雨,只有可能是二氧化硫或氮氧化物。但是X的原子序数比氧大,故X只能是硫元素。Y的原子序数比X大,又是短周期元素,只能是氯元素。Z的最高价含氧酸的钾盐是橙色,这是重铬酸盐的典型颜色。题目中关于4s、3d轨道半充满的描述,也能推出Z是铬元素(3d54s1)。
(1)考察核外电子排布的三条规则:能量最低原理、泡利不相容原理和洪特规则以及元素周期性中电负性的递变。钠元素的基态电子排布为1s22s22p63s1,Cl的电负性比S大。
(2)考察分子间作用力对物理性质的影响。对于氢键X-H…Y,X与Y只能是N,O,F三者之一,故有氢键,而没有。分子间氢键会导致化合物熔沸点升高。
(3)考察价层电子对互斥理论。对于分子,成键电子对数为3,孤电子对数为:
。故分子应该是平面三角形。
(4)考察晶胞中微粒数的计算——均摊法。为。晶胞中黑球全部在晶胞内部,故有8个,白球有个,二者比例为2:1。故黑球为。
(5)水的化学性质稳定,不会与重铬酸钾反应。故被氧化的M的氢化物只能是,氧化产物是。根据题目,还原产物中Cr为+3价,反应又在稀硫酸中进行,故还原产物为。根据元素守恒,另两个产物是和。根据氧化还原配平原则配平即可。
9.(13分)CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl·2H2O制备CuCl,并进行相关探究。
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
请回答下列问题:
(1)仪器X的名称是 ;
(2)实验操作的先后顺序是 (填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生的氧化还原反应的离子方程式是 。
【探究反思】
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
【答案】(1)球形干燥管
(2)c、d、b
(3)试纸先变红后逐渐褪色
(4)
(5) ①加热温度不够,导致未完全分解
②在氯化氢氛围不足时加热,少量的转化为最后分解生成
【解析】
(1)略。
(2)考查实验设计的步骤。为保证氯化氢氛围,准确的步骤应为:检查气密性-装入药品-排除空气-点燃酒精灯加热-熄灭酒精灯并冷却至室温-停止通入气体。
(3)反应中通入的HCl溶于水呈酸性,使石蕊试纸变红。后氯化铜分解生成的氯气与水反应会生成氯化氢和次氯酸,次氯酸体现很强的氧化性,使得色素被漂白而褪色。
(4)注意题目中提到了氧化还原反应的方程式,所以只有此反应正确。
(5)①根据题意可知,分解为的反应只能在高于300 oC时发生,若温度不够,则部分没有完全分解。②根据题意可知,加热时有两条反应途径,充足的氯化氢氛围中生成,氯化氢不足或者无氯化氢时的反应还会生成。那么,氯化氢不足时,可能导致水解反应发生,从而有生成,进而再分解生成。
10.(16分)高血脂严重影响人体健康,化合物E是一种临床治疗高血脂症的药物。E的合成路线如下(部分反应条件和试剂略):
请回答下列问题:
(1)试剂I的名称是 ,试剂II中官能团的名称是 ,第②步的反应类型是 。
(2)第①步反应的化学方程式是 。
(3)第⑥步反应的化学方程式是 。
(4)第⑦步反应中,试剂III为单碘代烷烃,其结构简式是 。
(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH。若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y发生缩聚反应所得缩聚物的结构简式是 。
【答案】
(1)甲醇,溴原子,取代反应
(2)
(3)
(4)
(5)
【解析】本题以丙二酸衍生物合成法为载体,考查(1)有机化学的基本知识(命名、反应)。(2)阅读信息的能力。(3)观察、对比、推理的能力。反应①为酯化反应。反应②(Williamson醚合成)和③(丙二酸衍生物的烷基化)虽然是陌生的反应,但反应物、试剂和产物都已经给出,实际上难度不大。反应④和⑤是酯的碱性水解再酸化。反应⑥(脱羧)在信息中给出。⑦需要学生通过观察对比得出结论。
(1)前两空为基础知识,解析略。第三空,对于反应②,通过观察对比反应物与产物的结构,可以发现Na原子被基团所取代,符合取代反应的定义。
(2)酯化反应的书写,属于基础知识,解析略。
(3)套用题目信息,脱去一个羧基放出二氧化碳得到产物。
(4)通过观察对比D(见(3)的答案)与E的结构,发现E比D多出一个甲基,而这个甲基一定来自试剂Ⅲ。又因为试剂Ⅲ是单碘代烷烃,故只能是碘甲烷。
(5)C的该同分异构体分子式中有5个O,能水解成三个分子,其中一个是醇(),一个是羧酸(X),而Y也能与X发生缩聚反应,故Y也是一个醇。换言之,C的该同分异构体中应该含有两个酯基,X中应该含有两个羧基。故三个水解产物的分子式之和,应该是C的该同分异构体的分子式加上2分子水,即。其中X根据核磁共振信息,只能是对苯二甲酸:
从分子式的总和减去已知的两个分子,Y的分子式为C2H6O2。因为Y
必须含有醇羟基,且核磁共振只有两组氢,故Y是乙二醇HOCH2CH2OH。对苯二甲酸和乙二醇的缩聚产物见(5)的答案。这一产物就是涤纶。
11.(16分)资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3,某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg (OH)2、P4和H2,其简化流程如下:
已知:①Ca5(PO4)3F在不分解;
②4Ca5(PO4)3F+18SiO2+30C2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)煅烧磷尾矿生成气体的主要成分是 。
(2)实验室过滤所需的玻璃仪器是 。
(3)NH4NO3溶液能从磷矿I中浸取Ca2+的原因是 。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是_____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知,101kPa时;
CaO(s)+H2SO4(l)==== CaSO4(s)+H2O(l)
5CaO(s)+3H3PO4(l)+HF(g) ==== Ca5(PO4)3F(s)+5H2O(l)
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是 。
(6)在一定条件下CO(g)+H2O(g)CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化为。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则在相同条件下达平衡时能产生H2 kg。
【答案】
(1)CO2
(2)烧杯、漏斗、玻璃棒
(3)磷矿I中的氧化钙与水生成了氢氧化钙,氢氧化钙与硝酸铵在加热时反应生成了硝酸钙、氨气和水,从而浸取出钙离子;
(4)
(5)
(6)
【解析】
(1)碳酸盐分解生成二氧化碳。
(2)基础知识,解析略。
(3)煅烧时,碳酸盐先分解得到氧化钙和氧化镁。氧化钙与水生成了氢氧化钙,氢氧化钙与硝酸铵在加热时反应生成了硝酸钙、氨气和水(强碱制弱碱),从而浸取出钙离子;
(4)解析略。
(5)考察盖斯定律。反应①×5 -反应②,就能得到答案中的反应。故ΔH = 5×(-271) – (-937) = -418 kJ/mol.
(6)考察工艺流程与化学平衡的相关计算。先计算平衡常数。
CO(g)
+
H2O(g)
⇌
CO2(g)
+
H2(g)
反应前
1
5
0
0
变化量
-5/6
-5/6
5/6
5/6
反应后
1/6
25/6
5/6
5/6
平衡常数
反应前
1
3
0
0
变化量
-x
-x
x
X
反应后
1-x
3-x
x
x
平衡常数 解得
故每1 mol的CO会产生0.75 mol的H2。
H2的质量(以kg为单位)可计算为:
其中30/4为反应方程式中的CO与Ca5(PO4)3F的物质的量之比,2 g/mol为H2的摩尔质量。