- 2021-05-12 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习金属及其化合物作业
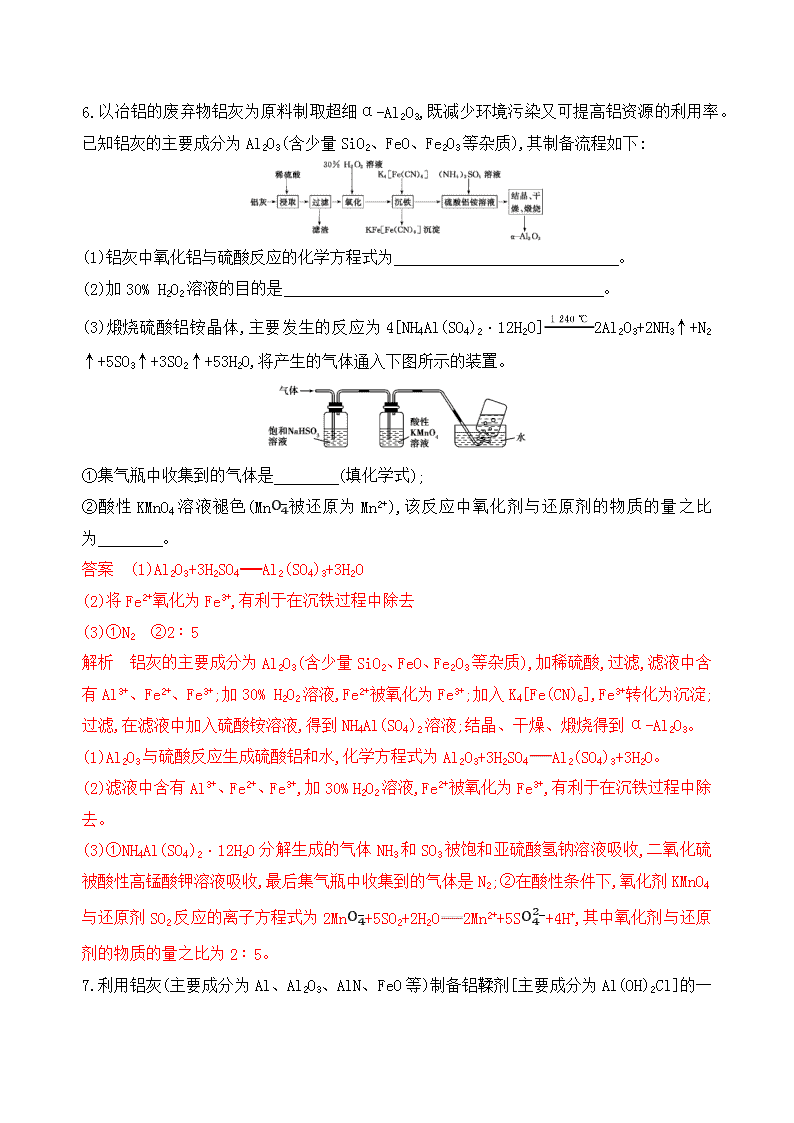
金属及其化合物 1.镁、铝性质相似,下表中对两者的对比不正确的是( ) 选项 反应 铝 镁 A 与非金属单质反应 能被Cl2、O2氧化 能与N2、O2反应 B 与水反应 能与沸水反应 反应很困难 C 与碱反应 能溶于强碱溶液 不反应 D 与某些氧化物反应 能与Fe2O3、MnO2、Cr2O3等金属氧化物发生铝热反应 能在CO2中燃烧 答案 B 镁的金属性强于铝,铝与水反应很困难,镁能与沸水反应。 2.已知NH4++AlO2-+2H2OAl(OH)3↓+NH3·H2O。向含有等物质的量的NH4+、Al3+、H+的混合溶液中,慢慢滴加NaOH溶液直到过量,并不断搅拌,发生以下离子反应:①H++OH-H2O ②Al(OH)3+OH-AlO2-+2H2O ③Al3++3OH-Al(OH)3↓ ④NH4++OH-NH3·H2O。反应的先后顺序正确的是( ) A.①→②→③→④ B.①→③→②→④ C.①→③→④→② D.①→④→②→③ 答案 C 先发生中和反应,第一个反应为H++OH-H2O;第二个反应为Al3++3OH-Al(OH)3↓;AlO2-与NH4+能相互促进水解而生成Al(OH)3,故第三个反应为NH4++OH-NH3·H2O;最后一个反应为Al(OH)3+OH- AlO2-+2H2O。 3.向明矾溶液里滴加Ba(OH)2溶液,当SO42-恰好沉淀完全时,铝元素的存在形式是( ) A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中 B.一部分为Al(OH)3沉淀,一部分以AlO2-形式存在于溶液中 C.全部为Al(OH)3沉淀 D.几乎全部以AlO2-形式存在于溶液中 答案 D 向明矾溶液里滴加Ba(OH)2溶液,当SO42-恰好沉淀完全时,KAl(SO4)2与Ba(OH)2按物质的量之比1∶2反应,此时铝离子与氢氧根离子物质的量之比为1∶4,铝元素几乎全部以AlO2-形式存在于溶液中,故选D。 4.某强酸性溶液X中可能含有H+、NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离和离子的水解),取该溶液进行连续实验,实验流程如下: 下列有关推断合理的是( ) A.根据上述连续实验不能确定溶液X中是否含有Fe3+ B.沉淀H为Al(OH)3、BaCO3的混合物 C.溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- D.若溶液X为100 mL,产生气体A为112 mL(标准状况),则溶液X中c(Fe2+)=0.05 mol·L-1 答案 A 因为加入过量NaOH溶液后有沉淀F生成,之后通入过量的CO2生成沉淀H,说明溶液X中有铝离子,沉淀H为Al(OH)3,B错误。加入过量的Ba(NO3)2溶液,有气体A生成,说明溶液X中含有具有还原性的离子,即有Fe2+,则一定无NO3-;有沉淀C生成,说明溶液X中有SO42-,没有Ba2+。加入过量NaOH溶液有气体D生成,说明溶液X中有NH4+。溶液X中肯定有H+、NH4+、Al3+、Fe2+、SO42-,不能确定是否有Fe3+和Cl-,A正确,C错误。气体A为NO,根据3Fe2+~NO,可以计算出n(Fe2+)=0.112 L22.4 L·mol-1×3=0.015 mol,c(Fe2+)=0.015mol0.1 L=0.15 mol·L-1,D错误。 5.现有含MgCl2、AlCl3均为n mol的混合溶液,向其中滴加NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子形成沉淀或沉淀的溶解与溶液pH的关系如下表)( ) 离子 Mg2+ Al3+ 物质 Al(OH)3 开始沉淀时的pH 8.93 3.56 开始溶解时的pH 8.04 完全沉淀时的pH 10.92 4.89 完全溶解时的pH 12.04 答案 C 由表中数据知,当Al3+沉淀完全时Mg2+还没有开始形成沉淀,当生成的Al(OH)3 开始溶解时Mg2+仍没有形成沉淀,当加碱至溶液的pH=8.93时,Al(OH)3部分溶解而Mg(OH)2开始形成沉淀,生成沉淀速率比前段生成沉淀速率小,当溶液pH=10.92时,Mg(OH)2沉淀完全,Al(OH)3继续溶解,至pH=12.04时,沉淀只有Mg(OH)2,Al(OH)3全部溶解,故C项正确。 6.以冶铝的废弃物铝灰为原料制取超细α-Al2O3,既减少环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量SiO2、FeO、Fe2O3等杂质),其制备流程如下: (1)铝灰中氧化铝与硫酸反应的化学方程式为 。 (2)加30% H2O2溶液的目的是 。 (3)煅烧硫酸铝铵晶体,主要发生的反应为4[NH4Al(SO4)2·12H2O]2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通入下图所示的装置。 ①集气瓶中收集到的气体是 (填化学式); ②酸性KMnO4溶液褪色(MnO4-被还原为Mn2+),该反应中氧化剂与还原剂的物质的量之比为 。 答案 (1)Al2O3+3H2SO4Al2(SO4)3+3H2O (2)将Fe2+氧化为Fe3+,有利于在沉铁过程中除去 (3)①N2 ②2∶5 解析 铝灰的主要成分为Al2O3(含少量SiO2、FeO、Fe2O3等杂质),加稀硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+;加30% H2O2溶液,Fe2+被氧化为Fe3+;加入K4[Fe(CN)6],Fe3+转化为沉淀;过滤,在滤液中加入硫酸铵溶液,得到NH4Al(SO4)2溶液;结晶、干燥、煅烧得到α-Al2O3。 (1)Al2O3与硫酸反应生成硫酸铝和水,化学方程式为Al2O3+3H2SO4Al2(SO4)3+3H2O。 (2)滤液中含有Al3+、Fe2+、Fe3+,加30% H2O2溶液,Fe2+被氧化为Fe3+,有利于在沉铁过程中除去。 (3)①NH4Al(SO4)2·12H2O分解生成的气体NH3和SO3被饱和亚硫酸氢钠溶液吸收,二氧化硫被酸性高锰酸钾溶液吸收,最后集气瓶中收集到的气体是N2;②在酸性条件下,氧化剂KMnO4 与还原剂SO2反应的离子方程式为2MnO4-+5SO2+2H2O2Mn2++5SO42-+4H+,其中氧化剂与还原剂的物质的量之比为2∶5。 7.利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下: (1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为 ;“水解”采用90 ℃而不在室温下进行的原因是 。 (2)“酸溶”时,Al2O3发生反应的离子方程式为 。 (3)“氧化”时,发生反应的离子方程式为 。 (4)“废渣”的成分为 (填化学式)。 (5)采用喷雾干燥而不用蒸发的原因是 。 答案 (1)AlN+3H2O Al(OH)3+NH3↑ 降低NH3在水中的溶解度,促使NH3逸出 (2)Al2O3+6H+ 2Al3++3H2O (3)2Fe2++2H++ClO- 2Fe3++Cl-+H2O (4)Fe(OH)3 (5)防止Al(OH)2Cl水解生成Al(OH)3 解析 铝灰的主要成分为Al、Al2O3、AlN、FeO等,加入水,AlN和水反应生成氢氧化铝和氨气,加入盐酸酸溶后,生成氯化铝和氯化亚铁,加入漂白剂氧化亚铁离子为铁离子,加入纯碱调节溶液pH使铁离子全部沉淀,采用喷雾干燥制备铝鞣剂。 (1)气体A能使湿润的红色石蕊试纸变蓝,说明生成的是氨气,铝灰中的AlN和水发生反应生成氢氧化铝和氨气,反应的化学方程式为:AlN+3H2O Al(OH)3+NH3↑;加热可以促进氮化铝水解生成氨气,降低NH3在水中的溶解度,促使NH3逸出。 (2)氧化铝是两性氧化物,酸溶时和盐酸发生反应生成氯化铝和水,反应的离子方程式为:Al2O3+6H+ 2Al3++3H2O。 (3)加入漂白液的作用是将亚铁离子氧化为铁离子,反应的离子方程式为:2Fe2++2H++ClO- 2Fe3++Cl-+H2O。 (4)由上述分析可知“废渣”成分为氢氧化铁,化学式为Fe(OH)3。 (5)铝鞣剂的主要成分为Al(OH)2Cl,在加热蒸发时会发生水解,为防止水解采用喷雾干燥。 8.类比(比较)法是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列说法正确的是( ) A.Fe能置换出硫酸铜溶液中的铜,则Na也能置换出硫酸铜溶液中的铜 B.CaC2能水解:CaC2+2H2OCa(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O4Al(OH)3↓+3CH4↑ C.工业上用电解熔融MgCl2的方法制取金属镁,则也可以用电解熔融AlCl3的方法制取金属铝 D.CO2与Na2O2反应生成Na2CO3和O2,则SO2与Na2O2反应生成Na2SO3和O2 答案 B A项,Fe能置换出硫酸铜溶液中的铜,而Na由于活动性很强,会与溶液中的水发生置换反应,所以不能置换出硫酸铜溶液中的铜,错误;B项正确;C项,工业上用电解熔融MgCl2的方法制取金属镁,而AlCl3是共价化合物,所以应该用电解熔融Al2O3的方法制取金属铝,错误;D项,CO2与Na2O2反应生成Na2CO3和O2,而SO2有还原性,与Na2O2发生氧化还原反应生成Na2SO4,错误。 9.将一定量的CO2气体通入2 L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2与加入HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( ) A.O点对应溶液中所含溶质的化学式为NaOH、Na2CO3 B.a点对应溶液中c(HCO3-)>c(CO32-) C.标准状况下,通入CO2的体积为44.8 L D.原NaOH溶液中NaOH的物质的量浓度为5 mol/L 答案 D Na2CO3与盐酸的反应是分步进行的:Na2CO3+HClNaHCO3+NaCl,NaHCO3+HClNaCl+H2O+CO2↑,HCl与Na2CO3、NaHCO3都按物质的量之比为1∶1反应,由图像可知从开始生成CO2到CO2的量达到最大值所消耗的HCl的物质的量小于从开始滴加稀盐酸到开始产生CO2阶段消耗的HCl,故O点对应的溶液中溶质为NaOH、Na2CO3 ,A正确;a点对应溶液中溶质为碳酸氢钠,则溶液中c(HCO3-)>c(CO32-),B正确;由图可知,a点时开始生成CO2,故发生反应:NaHCO3+HClNaCl+H2O+CO2↑,至生成二氧化碳体积最大时,该阶段消耗HCl的物质的量为2 mol,由化学方程式可知产生二氧化碳的物质的量为2 mol,生成CO2的物质的量等于通入的二氧化碳的物质的量,故标准状况下通入的二氧化碳的体积为2 mol×22.4 L/mol=44.8 L,C正确;加入5 mol HCl生成二氧化碳体积最大,此时溶液中溶质为NaCl,根据氯原子守恒有n(NaCl)=n(HCl),根据钠原子守恒有n(NaOH)=n(NaCl),故n(NaOH)=n(HCl)=5 mol,所以c(NaOH)=5mol2 L=2.5 mol/L,D错误。 10.下列试剂的保存或使用方法正确的是( ) A.实验室中氯水需要保存在棕色试剂瓶中 B.漂白粉比氯水稳定,可露置在空气中 C.称量氢氧化钠固体时,可在托盘天平的两个托盘上各放一张等质量的纸,左边纸上放氢氧化钠,右边纸上放砝码 D.金属钠可保存在煤油、四氯化碳等有机溶剂中 答案 A 漂白粉露置在空气中会变质,B项错误;氢氧化钠具有吸水性,称量时不能放在纸上,应放在表面皿或烧杯中,C项错误;钠的密度小于四氯化碳,保存在四氯化碳中不能与空气隔绝,D项错误。 11.下列有关Na2CO3和NaHCO3的说法中正确的是( ) A.Na2CO3和NaHCO3都既能与盐酸反应,又能与氢氧化钠溶液反应 B.等质量的Na2CO3、NaHCO3分别与相同浓度的盐酸反应,NaHCO3消耗的盐酸体积少 C.向NaHCO3溶液中滴入少量Ba(OH)2溶液无沉淀生成,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀 D.等物质的量Na2CO3、NaHCO3分别与足量稀硫酸反应,NaHCO3产生的CO2多 答案 B CO32-+2H+H2O+CO2↑,HCO3-+H+H2O+CO2↑;HCO3-+OH-H2O+CO32-,而Na2CO3不与NaOH反应,A错误。设所用Na2CO3和NaHCO3的质量均为m g,Na2CO3消耗HCl的物质的量为 m106×2 mol=m53 mol,NaHCO3消耗HClm84 mol,m53 mol>m84 mol,盐酸浓度相同时,Na2CO3消耗的盐酸体积更大,B正确。NaHCO3溶液中滴入少量Ba(OH)2溶液时,2NaHCO3+Ba(OH)2BaCO3↓+Na2CO3+2H2O,Na2CO3溶液中滴入少量Ba(OH)2溶液时,Na2CO3+Ba(OH)2BaCO3↓+2NaOH,两个反应都能生成白色沉淀BaCO3,C错误。设所用Na2CO3和NaHCO3的物质的量均为1 mol,加入足量稀硫酸后,二者生成的CO2均为1 mol,D错误。 12.常温下,0.2 moI·L-1的Na2CO3溶液与0.2 moI·L-1的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( ) A.A代表Na+浓度 B.该溶液中c(OH-)>c(Y) C.向该溶液中加水稀释,所有离子浓度均减小 D.该混合溶液中:c(X)+c(Y)+c(Z)=2c(Na+) 答案 B A项,发生反应是Na2CO3+HClNaHCO3+NaCl,根据钠原子守恒,c(Na+)=0.2×22 mol·L-1=0.2 mol·L-1,故错误;B项,反应后溶质为NaHCO3和NaCl,其中NaHCO3溶液显碱性,HCO3-发生水解:HCO3-+H2OH2CO3+OH-,水解程度微弱,即X为HCO3-,Y为H2CO3,Z为CO32-,溶液中水也发生电离,因此c(OH-)>c(H2CO3),故正确;C项,加水稀释,c(Na+)、c(HCO3-)、c(CO32-)、c(OH-)减小,水的离子积不变,即c(H+)增大,故错误;D项,根据物料守恒,2c(X)+2c(Y)+2c(Z)=c(Na+),故错误。 13.氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下: 已知:卤块的主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。 下列说法不正确的是 ( ) A.卤块中的FeCl2与KMnO4发生氧化还原反应 B.加入BaCl2生成的沉淀为BaSO4 C.加入MgO后过滤得到的滤渣成分是氢氧化镁和氢氧化铁 D.在滤液中加NaClO3饱和溶液得到产品的反应是复分解反应 答案 C 卤块的主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质,加入KMnO4发生氧化还原反应的实质是亚铁离子与高锰酸根离子的反应,故A正确;卤块中含有杂质硫酸根离子,加入氯化钡的目的是使硫酸根离子与钡离子反应生成硫酸钡沉淀,故B正确;加MgO调节溶液的pH=4,从而沉淀出氢氧化铁,滤渣里没有氢氧化镁,故C不正确;在滤液中加NaClO3饱和溶液,发生的反应为MgCl2+2NaClO3Mg(ClO3)2↓+2NaCl,反应原理是相同温度下Mg(ClO3)2的溶解度比NaClO3小,故D正确。 14.向含Na2CO3、NaHCO3的混合溶液中逐滴加入稀盐酸,生成气体的物质的量随加入盐酸体积的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( ) A.a点对应的溶液中:Na+、OH-、SO42-、NO3- B.b点对应的溶液中:K+、Ca2+、MnO4-、Cl- C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl- D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+ 答案 C A项,a点对应的溶液中含有HCO3-,HCO3-与OH-反应,不能大量共存,错误。B项,b点对应的溶液中含有Cl-,MnO4-与Cl-因发生氧化还原反应而不能大量共存,错误。C项,c点对应的溶液为NaCl溶液,离子之间不发生反应,能大量共存,正确。D项,d点对应的溶液呈酸性,酸性条件下,NO3-与Fe2+因发生氧化还原反应而不能大量共存;F-在酸性条件下不能大量存在且溶液中的Cl-与Ag+也不能大量共存,错误。 15.向含a mol NH4Fe(SO4)2和a mol NH4HSO4的溶液中逐滴加入含b mol Ba(OH)2的溶液,下列说法正确的是( ) A.NH4Fe(SO4)2是复盐,属于一种特殊的混合物 B.当b≤0.5a时,发生的离子反应为Ba2++SO42-+2H++2OH-BaSO4↓+2H2O C.当0.5a查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档