- 2021-05-12 发布 |
- 37.5 KB |
- 146页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习专题3金属及其化合物3铁铜的获取及应用课件苏教版
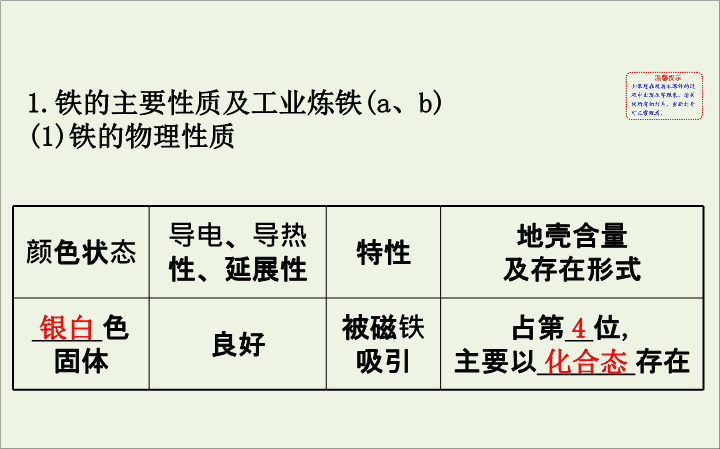
第三单元 铁、铜的获取及应用 1. 铁的主要性质及工业炼铁 (a 、 b) (1) 铁的物理性质 颜色状态 导电、导热 性、延展性 特性 地壳含量 及存在形式 _____ 色 固体 良好 被磁铁 吸引 占第 __ 位 , 主要以 _______ 存在 银白 4 化合态 (2) 铁的化学性质 铁元素性质活泼 , 单质有较强的还原性 , 主要化合价为 +2 价和 +3 价。 ① 与非金属单质的反应 化学方程式 与 S 反应 ______________ 与 I 2 反应 _______________ 与 O 2 反应 __________________ 与 Cl 2 反应 2Fe+3Cl 2 2FeCl 3 Fe+S FeS Fe+I 2 FeI 2 3Fe+2O 2 Fe 3 O 4 △ ==== △ ==== 点燃 ==== 点燃 ==== ② 与水的反应 常温下铁与水不反应 , 在高温条件下与水蒸气反应 : 3Fe+4H 2 O(g) Fe 3 O 4 +4H 2 。 高温 ==== ③ 与酸的反应 酸 化学方程式或现象 稀硫酸 Fe+H 2 SO 4 ====FeSO 4 +H 2 ↑ 稀 硝 酸 Fe 不足 Fe+4HNO 3 ====Fe(NO 3 ) 3 +NO↑+2H 2 O Fe 过量 3Fe+8HNO 3 ====3Fe(NO 3 ) 2 +2NO↑+4H 2 O 浓硝酸、 浓硫酸 常温下 _____ 钝化 ④ 与某些盐溶液的反应 a. 与 CuSO 4 溶液反应的离子方程式 :_________________ 。 b. 与 FeCl 3 溶液反应的离子方程式 :________________ 。 Fe+Cu 2+ ====Fe 2+ +Cu Fe+2Fe 3+ ====3Fe 2+ (3) 铁的冶炼 设 备 炼 铁 高 炉 原 料 ___________________________ 反应 原理 ___________________________ 、 ______________________ 铁矿石、焦炭、空气、石灰石 C+O 2 CO 2 、 C+CO 2 2CO Fe 2 O 3 +3CO 2Fe+3CO 2 点燃 ==== △ ==== 高温 ==== 炉渣 形成 ______________________ ____________________ 产 品 含碳 2% ~ 4.5% 的 _____, 进一步炼制 , 可得到含碳 0.03% ~ 2% 的钢 CaCO 3 CaO+CO 2 ↑ 、 CaO+SiO 2 CaSiO 3 生铁 高温 ==== 高温 ==== 2. 铁的化合物 (a 、 b) (1) 铁的氧化物 化学式 FeO Fe 2 O 3 Fe 3 O 4 俗名 _____ 磁性氧化铁 颜色状态 ___ 色粉末 _____ 色 粉末 黑色晶体 ( 有磁性 ) 溶解性 难溶于水 难溶于水 难溶于水 铁红 黑 红棕 化学式 FeO Fe 2 O 3 Fe 3 O 4 铁的化合价 ___ ___ _______ 与 H + 反应的离子方程式 ___________ ________ ____________ __________ Fe 3 O 4 +8H + ==== Fe 2+ +2Fe 3+ + 4H 2 O +2 +3 +2 、 +3 FeO+2H + ==== Fe 2+ +H 2 O Fe 2 O 3 +6H + ==== 2Fe 3+ +3H 2 O (2) 铁的氢氧化物 化学式 Fe(OH) 2 Fe(OH) 3 色态 _________ ___________ 与盐酸反应 _______________ _________ Fe(OH) 3 +3H + ==== Fe 3+ +3H 2 O 受热分解 ______________ __________ 白色固体 红褐色固体 Fe(OH) 2 +2H + ==== Fe 2+ +2H 2 O 2Fe(OH) 3 Fe 2 O 3 +3H 2 O △ ==== 化学式 Fe(OH) 2 Fe(OH) 3 制法 可溶性亚铁盐与碱反应 :_____________ _________ 可溶性铁盐与碱反应 :_____________ _________ 二者的 关系 空气中 ,Fe(OH) 2 能够非常迅速地被氧气氧 化成 Fe(OH) 3 , 现象是白色沉淀迅速变成 _____ 色 , 最后变成 _____ 色 , 化学方程式为 ___________________________ Fe 2+ +2OH - ==== Fe(OH) 2 ↓ Fe 3+ +3OH - ==== Fe(OH) 3 ↓ 灰绿 红褐 4Fe(OH) 2 +O 2 +2H 2 O====4Fe(OH) 3 (3) 铁盐和亚铁盐 ①亚铁盐 : 含有 Fe 2+ 的溶液呈 _____ 色 , 既有氧化性 , 又有还原性。 a. 氧化性 :Fe 2+ 与 Zn 反应的离子方程式 : Zn+Fe 2+ ====_______ 。 浅绿 Fe+Zn 2+ b. 还原性 2Fe 2+ +Cl 2 ====__________ 。 Mn +5Fe 2+ +8H + ====______________ 。 2Fe 3+ +2Cl - 5Fe 3+ +Mn 2+ +4H 2 O ② 铁盐 : a. 氧化性 : 含 Fe 3+ 的溶液呈 ___ 色 ,Fe 3+ 具有较强的氧化性。 2Fe 3+ +Fe====_____ 。 2Fe 3+ +2I - ====________ 。 2Fe 3+ +H 2 S====_____________ 。 黄 3Fe 2+ I 2 +2Fe 2+ 2Fe 2+ +S↓+2H + b. 特性 : 含有 Fe 3+ 的盐溶液遇到 _____ 时变成红色。 c.FeCl 3 易水解 : 将其饱和溶液滴入沸水中制备胶体的 化学方程式为 _________________________________ 。 KSCN FeCl 3 +3H 2 O Fe(OH) 3 ( 胶体 )+3HCl △ ==== ③Fe 2+ 、 Fe 3+ 的相互转化 : Fe 2+ Fe 3+ 上述转化关系中标号反应的离子方程式为 a. ______________________; b. _________________ c. _____________________ 。 2Fe 2+ +Cl 2 ====2Fe 3+ +2Cl - 2Fe 3+ +Fe====3Fe 2+ ; 2Fe 3+ +Cu====2Fe 2+ +Cu 2+ 【 典例精析 】 【 典例 1】 将 a g 铁和氧化铁的混合物加入足量的盐酸 中充分反应后 , 固体无剩余 , 测得参加反应的 HCl 为 0.08 mol, 放出标准状况下的气体 0.224 L, 已知氧化性 Fe 3+ 大于 H + 。则下列判断中正确的是 ( ) A. 原混合物中 n(Fe)∶n(Fe 2 O 3 )=2∶1 B. 向溶液中滴入 KSCN 溶液 , 显红色 C. 无法计算原混合物的质量 D. 此时溶液中 Fe 2+ 和 Fe 3+ 的物质的量之比为 3∶1 【 解题思路 】 根据化学方程式 Fe+2HCl====FeCl 2 +H 2 ↑ 中 H 2 的量来计算出 Fe 和 HCl 的量 , 再由 Fe 2 O 3 +6HCl====2FeCl 3 +3H 2 O 算出 Fe 2 O 3 和 FeCl 3 的量 , 由题目数据计算这个反应中消耗的 HCl 的量 , 得出 n(FeCl 3 ) 、 n(Fe 2 O 3 ), 最后由 Fe+2Fe 3+ ====3Fe 2+ 中 , 根据铁离子的量算出消耗 Fe 的量即可。 【 解析 】 选 A 。因为 Fe 3+ 和 H + 的氧化性强弱顺序为 Fe 3+ > H + , 所以当产生氢气时 ,Fe 3+ 已经全部被还原为 Fe 2+ , 故向 溶液中滴入 KSCN 溶液 , 溶液不变红 , 故 B 、 D 错误 ; 根据化 学方程式 Fe+2HCl====FeCl 2 +H 2 ↑ 中 H 2 的量来计算出 Fe 和 HCl 的物质的量分别是 n(Fe)=0.01 mol, n(HCl)= 0.02 mol, 由 Fe 2 O 3 +6HCl====2FeCl 3 +3H 2 O 算出 Fe 2 O 3 和 FeCl 3 的量 , 由题目可知 , 这个反应中消耗的 HCl 的量为 0.08 mol-0.02 mol=0.06 mol, 得出 n(FeCl 3 )= 0.02 mol,n(Fe 2 O 3 )=0.01 mol, 在反应 Fe+2Fe 3+ ====3Fe 2+ 中 , 根据 Fe 3+ 的量 0.02 mol 算出消耗 Fe 的量为 0.01 mol, 故 A 正确 ,C 错误。 【 考题变式 】 若将本题中的混合物在 CO 气体中加热并充分冷却 , 最后可得到固体的质量是多少 ? 提示 : 2.24 g 。反应后铁元素已经全部被还原为 Fe 2+ , 即 FeCl 2 , 根据消耗的 HCl 为 0.08 mol, 可知混合物中铁元素的物质的量为 0.04 mol 。根据元素守恒 , 混合物在 CO 气体中加热并充分冷却 , 最后可得到固体 Fe 的物质的量是 0.04 mol 。质量为 2.24 g 。 【 典例 2】 下图中 , 固体 A 是铁锈的主要成分。 请回答 : (1) 白色沉淀 E 的化学式 __________ 。 (2) 写出 A→B 的化学方程式 ______________ 。 (3) 写出 C→D 在溶液中发生氧化还原反应的离子方程式 ______________________________________ 。 【 解析 】 铁锈的主要成分是 Fe 2 O 3 ,Fe 2 O 3 在高温下被 CO 还 原成 Fe, 反应的化学方程式为 Fe 2 O 3 +3CO 2Fe+3CO 2 。 Fe 在加热条件下和氯气反应生成 FeCl 3 。 FeCl 3 具有强氧 化性 , 能够把 SO 2 氧化成 H 2 SO 4 , 自身被还原成 FeCl 2 , 反应 的离子方程式为 2Fe 3+ +SO 2 +2H 2 O====2Fe 2+ + +4H + 。 生成的 和 BaCl 2 溶液中的 Ba 2+ 反应生成 BaSO 4 沉淀。 高温 ==== 答案 : (1)BaSO 4 (2)Fe 2 O 3 +3CO 2Fe+3CO 2 (3)SO 2 +2H 2 O+2Fe 3+ ====2Fe 2+ + +4H + 高温 ==== 【 强化训练 】 1. 判断下列叙述的正误 ( 正确的打“√” , 错误的打“ ×”) (1) 铁具有导电、导热、延展性及被磁体吸引的特性。 ( ) 提示 : √ 。 (2)Fe 与稀硝酸、稀硫酸反应均有气泡产生 , 说明 Fe 与两种酸均发生置换反应。 ( ) 提示 : × 。 Fe 与稀硝酸发生氧化还原反应生成硝酸铁和 NO, 不是置换反应。 (3)Fe 在足量 Cl 2 中燃烧生成 FeCl 3 , 在少量 Cl 2 中燃烧生成 FeCl 2 。 ( ) 提示 : × 。 Fe 在 Cl 2 中燃烧只能生成 FeCl 3 , 无 FeCl 2 生成。 (4) 常温下 , 将铁片浸入足量浓硫酸中 , 铁片不溶解 , 说明常温下 , 铁与浓硫酸不发生化学反应。 ( ) 提示 : × 。常温下 , 铁片在浓硫酸中发生钝化 , 生成一层致密的氧化膜 , 为化学反应。 (5) 铁表面自然形成的氧化层能保护内层不被空气氧化。 ( ) 提示 : × 。铁表面自然形成的氧化层为氧化铁 , 比较疏松 , 不能保护内层不被空气氧化。 2. 把 22.4 g 铁粉完全溶解于某浓度的硝酸中 , 若反应只收集到 0.3 mol NO 2 和 0.2 mol NO, 下列说法正确的是 ( ) A. 反应后生成的盐只为 Fe(NO 3 ) 3 B. 反应后生成的盐只为 Fe(NO 3 ) 2 C. 反应后生成的盐为 Fe(NO 3 ) 3 和 Fe(NO 3 ) 2 , 其物质的量之比为 1∶3 D. 反应后生成的盐为 Fe(NO 3 ) 3 和 Fe(NO 3 ) 2 , 其物质的量之比为 3∶1 【 解析 】 选 C 。 n(Fe)= =0.4 mol,Fe 在反应的 过程中失去的电子数应介于 0.8 mol( 此时只产生 Fe 2+ ) 和 1.2 mol( 此时只产生 Fe 3+ ) 之间 , 又产生 0.3 mol NO 2 和 0.2 mol NO, 即反应过程中硝酸得电子物质的量为 0.3 mol × (5-4)+0.2 mol × (5-2)=0.9 mol, 产物既有 Fe(NO 3 ) 3 又有 Fe(NO 3 ) 2 , 设前者的物质的量为 x, 后者的物 质的量为 y, 则由铁原子守恒可得 x+y=0.4 mol, 由得失电子守恒得 3x+2y=0.9 mol, 解得 x=0.1 mol,y=0.3 mol 。 3.( 高考试题改编 ) 下列各图示中能较长时间看到 Fe(OH) 2 白色沉淀的是 ________( 填序号 ) 。 世纪金榜导学号 【 解析 】 因为 Fe(OH) 2 在空气中很容易被氧化为红褐色 的 Fe(OH) 3 , 即 4Fe(OH) 2 +O 2 +2H 2 O====4Fe(OH) 3 , 因此要较 长时间看到 Fe(OH) 2 白色沉淀 , 就要排除装置中的氧气或 空气。①、②原理一样 , 都是先用氢气将装置中的空气 排尽 , 并使生成的 Fe(OH) 2 处在氢气的保护中 ;③ 的原理 为铁作阳极产生 Fe 2+ , 与电解水产生的 OH - 结合生成 Fe(OH) 2 , 且液面用汽油保护 , 能防止空气进入 ;⑤ 中液面加苯阻止了空气进入 ;④ 由于带入空气中的氧气 , 能迅速将 Fe(OH) 2 氧化 , 因而不能较长时间看到白色沉淀。 答案 : ①②③⑤ 4. 某小组在验证反应“ Fe+2Ag + ====Fe 2+ +2Ag” 的实验中检测到 Fe 3+ , 发现和探究过程如下。 向硝酸酸化的 0.05 mol·L -1 硝酸银溶液 (pH≈2) 中加入过量铁粉 , 搅拌后静置 , 烧杯底部有黑色固体 , 溶液呈黄色。 (1) 检验产物 ①取出少量黑色固体 , 洗涤后 ,______________( 填操作和现象 ), 证明黑色固体中含有 Ag 。 ②取上层清液 , 滴加 K 3 [Fe(CN) 6 ] 溶液 , 产生蓝色沉淀 , 说明溶液中含有 __________ 。 (2) 针对“溶液呈黄色” , 甲认为溶液中有 Fe 3+ , 乙认为 铁粉过量时不可能有 Fe 3+ , 乙依据的原理是 __________ ( 用离子方程式表示 ) 。针对两种观点继续实验 : ① 取上层清液 , 滴加 KSCN 溶液 , 溶液变红 , 证实了甲的猜 测。同时发现有白色沉淀产生 , 且溶液颜色深浅、沉淀 量多少与取样时间有关 , 对比实验记录如下 : 序号 取样时 间 /min 现象 ⅰ 3 产生大量白色沉淀 ; 溶液呈红色 ⅱ 30 产生白色沉淀 ; 较 3 min 时量少 ; 溶液红色较 3 min 时加深 ⅲ 120 产生白色沉淀 ; 较 30 min 时量少 ; 溶液红色较 30 min 时变浅 ( 资料 :Ag + 与 SCN - 生成白色沉淀 AgSCN) ② 对 Fe 3+ 产生的原因作出如下假设 : 假设 a: 可能是铁粉表面有氧化层 , 能产生 Fe 3+ ; 假设 b: 空气中存在 O 2 , 由于 ____________( 用离子方程 式表示 ), 可产生 Fe 3+ ; 假设 c: 酸性溶液中 具有氧化性 , 可产生 Fe 3+ ; 假设 d: 根据 ______________ 现象 , 判断溶液中存在 Ag + , 可产生 Fe 3+ 。 ③ 下列实验 Ⅰ 可证实假设 a 、 b 、 c 不是产生 Fe 3+ 的主要原因。 实验 Ⅱ 可证实假设 d 成立。 实验 Ⅰ: 向硝酸酸化的 ________ 溶液 (pH≈2) 中加入过量铁粉 , 搅拌后静置 , 不同时间取上层清液滴加 KSCN 溶液 ,3 min 时溶液呈浅红色 ,30 min 后溶液几乎无色。 实验 Ⅱ: 装置如图。其中甲溶液是 ________, 操作及现象是 __________________ 。 【 解析 】 (1)① 黑色固体中含有过量铁 , 如果同时含有 银 , 则可以加入 HCl 或 H 2 SO 4 溶解 Fe, 而银不溶解。 ② K 3 [Fe(CN) 6 ] 是检验 Fe 2+ 的试剂 , 所以产生蓝色沉淀说 明含有 Fe 2+ 。 (2)② 过量铁粉与 Fe 3+ 反应生成 Fe 2+ , 即 Fe+2Fe 3+ ====3Fe 2+ 。 O 2 氧化 Fe 2+ 反应为 4Fe 2+ +O 2 +4H + ====4Fe 3+ +2H 2 O 。③实验 Ⅰ 的目的是证实 假设 a 、 b 、 c 非主要原因 , 可以从后续现象中看出。 Fe 3+ 在 30 min 时几乎完全消失 , 故应使 a 、 b 、 c 、中变量全部存在 , 即溶液中只需不存在 Ag + , 此时 Fe 3+ 可被过量铁粉还原为 Fe 2+ 。故初始时加入 Fe(NO 3 ) 3 溶液 , 随时间进行 , 可看到 Fe 3+ 浓度逐渐降低的实验现象。 实验 Ⅱ 是为了证实 Ag + 可能将 Fe 2+ 氧化为 Fe 3+ , 故甲溶液 必为 Fe 2+ 溶液。由于 的影响已被实验 Ⅰ 排除 , 为了 避免其他阴离子干扰 , 可选用 Fe(NO 3 ) 2 。在原电池结构 中 ,Ag + 将 Fe 2+ 氧化为 Fe 3+ , 电流表应有偏转。为证实 Fe 3+ 产生 , 应在电流表偏转后向左池加入 KSCN 验证。 答案 : (1) ① 加入足量稀盐酸 ( 或稀硫酸 ) 酸化 , 固体未完全溶解 ② Fe 2+ (2)Fe+2Fe 3+ ====3Fe 2+ ② 4Fe 2+ +O 2 +4H + ====4Fe 3+ +2H 2 O 生成白色沉淀 ③ Fe(NO 3 ) 3 Fe(NO 3 ) 2 当电流表指针偏转时 , 向左侧甲溶液中加入 KSCN 溶液 ; 溶液变红 【 归纳总结 】 1. 防氧化是制备 Fe(OH) 2 的关键 (1) 将配制溶液的蒸馏水煮沸 , 驱除溶液中的氧气。 (2) 将盛有 NaOH 溶液的胶头滴管尖端插入试管的亚铁盐溶液底部 , 并慢慢挤出 NaOH 溶液。 (3) 在亚铁盐溶液上面充入保护气 , 如 H 2 、 N 2 、稀有气体等。 (4) 在亚铁盐溶液上面加保护层 , 如苯、植物油等。 (5) 用 Fe 作阳极 , 石墨作阴极 , 电解 NaOH 溶液 , 利用新产生的 Fe 2+ 与 OH - 反应制取。 2. 数轴法分析铁与稀硝酸反应的产物 一是明确哪种物质过量 , 二是根据两种物质的量分析讨论判断 , 根据反应方程式 : (1)HNO 3 过量 :Fe+4HNO 3 ( 稀 )====Fe(NO 3 ) 3 +NO↑+2H 2 O, 铁元素的存在形式为 Fe 3+ 。 (2)Fe 过量 : 3Fe+8HNO 3 ( 稀 )====3Fe(NO 3 ) 2 +2NO↑+4H 2 O, 铁元素的存在形式为 Fe 2+ 。 (3) 用数轴表示 : (4) 解题时需注意量的范围 : 产物 结论 ≤ Fe(NO 3 ) 3 HNO 3 可能有剩余 ≥ Fe(NO 3 ) 2 Fe 可能有剩余 在 ~ 之间 Fe(NO 3 ) 3 和 Fe(NO 3 ) 2 Fe 和 HNO 3 都反应完全 考点 2: 铁的转化及 Fe 2+ 、 Fe 3+ 的检验 1.“ 铁三角”及应用 (c) (1) 铁的转化关系 (2)“ 铁三角”转化关系的应用 ①判断离子能否共存 ② 盐溶液的配制与保存 2.Fe 2+ 、 Fe 3+ 的检验方法 (c) (1) 用 KSCN 溶液和氯水 (2) 用 NaOH 溶液 (3) 含 Fe 2+ 、 Fe 3+ 的混合溶液中 Fe 3+ 、 Fe 2+ 的检验 (4)Fe 2+ 的特征检验方法 溶液 产生蓝色沉淀 , 说明溶液中含有 Fe 2+ ,3Fe 2+ +2[Fe(CN) 6 ] 3- ====Fe 3 [Fe(CN) 6 ] 2 ↓ 3. 含 Fe 2+ 、 Fe 3+ 的除杂问题 (c) 主要成分 杂质 除杂方法 FeCl 3 (aq) FeCl 2 (aq) 加入氯水或 H 2 O 2 FeCl 2 (aq) FeCl 3 (aq) 加过量铁粉后过滤 FeCl 2 (aq) CuCl 2 (aq) 加过量铁粉后过滤 4. 溶液中 Fe 2+ 、 Fe 3+ 的除去方法 (c) (1) 原理 :Fe 3+ 、 Fe 2+ 完全生成氢氧化物沉淀时 , 溶液的 pH 分别为 pH≥3.7 、 pH≥9.6 。 (2) 步骤 : ① 除去溶液中的 Fe 3+ 时 , 一般是加入能与酸反应的物质 ( 但不能引入新的杂质 ), 使溶液的 pH 至 3 ~ 4, 使 Fe 3+ 水解生成 Fe(OH) 3 沉淀而除去。 ② 除去溶液中的 Fe 2+ 时 , 先加入 H 2 O 2 ( 或其他氧化剂 , 但不引入新杂质 ) 使 Fe 2+ 转化为 Fe 3+ , 然后调节溶液的 pH 至 3 ~ 4, 使 Fe 3+ 水解生成 Fe(OH) 3 沉淀而除去。 (3) 示例 : ① 除去 MgCl 2 溶液中的 Fe 3+ 可在加热搅拌条件下 , 加入足量 MgO 或 MgCO 3 或 Mg(OH) 2 , 搅拌、充分反应后过滤除去。 ②除去 CuCl 2 溶液中的 Fe 2+ , 先加入 H 2 O 2 ( 或 Cl 2 ), 然后在加热搅拌条件下 , 加入足量 CuO 或 CuCO 3 或 Cu(OH) 2 , 搅拌、充分反应后过滤除去。 【 典例精析 】 【 典例 】 硫酸亚铁晶体 (FeSO 4 ·7H 2 O) 在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下 : 请回答下列问题 : (1) 证明步骤①滤液中含有 Fe 2+ 的方法是取样 , 先滴加 KSCN 溶液 , 再滴加 __________, 该过程的现象为 _______________________________________ 。 (2) 步骤②加入过量 H 2 O 2 的目的是 ___________ 。 (3) 步骤③反应的离子方程式是 _____________ 。 (4) 步骤④中一系列处理的操作步骤 : 过滤、 __________ 、 灼烧、 __________ 、称量。 (5) 若实验中铁无损耗 , 则每片补血剂中含铁元素的质量为 __________ g 。 【 解析 】 (1) 证明步骤 ① 滤液中含有 Fe 2+ 的方法是取样 , 先滴加 KSCN 溶液 , 再滴加氯水或双氧水、稀硝酸等 , 若滤液由浅绿色变为血红色 , 则说明滤液中含有 Fe 2+ 。 (2) 由于 H 2 O 2 具有氧化性 , 加入过量 H 2 O 2 的目的是将 Fe 2+ 全部氧化为 Fe 3+ 。 (3) 步骤 ③ 的目的是将 Fe 3+ 全部转化为 Fe(OH) 3 , 所以步骤 ③ 需加入过量的 NaOH 溶液 ( 或氨水 ), 反应的离子方程式是 Fe 3+ +3OH - ====Fe(OH) 3 ↓ 。 (4) 步骤 ④ 的目的是将产生的红褐色悬浊液分离 , 最终得到固体 Fe 2 O 3 , 所以步骤 ④ 的操作步骤是过滤、洗涤、灼烧、冷却、称量。 (5) 由于实验中铁无损耗 , 根据铁元素守恒得 , 每片补血 剂中 m(Fe)= ÷ 10=0.07a g 。 答案 : (1) 氯水 ( 或双氧水、稀硝酸等合理氧化剂 ) 溶液由浅绿色变为血红色 (2) 将 Fe 2+ 全部氧化为 Fe 3+ (3)Fe 3+ +3OH - ====Fe(OH) 3 ↓ (4) 洗涤 冷却 (5)0.07a 【 强化训练 】 1. 判断正误 ( 正确的打“√” , 错误的打“ ×”) (1)FeCl 3 溶液与 KSCN 溶液反应的离子方程式为 Fe 3+ +3SCN - ====Fe(SCN) 3 ↓ 。 ( ) 提示 : × 。 Fe(SCN) 3 是红色溶液。 (2) 向某溶液中 , 滴加氯水无现象 , 再滴加 KSCN 溶液溶液显红色 , 该溶液中一定含 Fe 2+ 。 ( ) 提示 : × 。应先滴加 KSCN 溶液无现象 , 滴加氯水后溶液显红色。 (3)FeCl 3 溶液腐蚀 Cu 刻制印刷电路板是由于铁比铜的金属性强。 ( ) 提示 : × 。 FeCl 3 溶液腐蚀 Cu 刻制印刷电路板是由于 2FeCl 3 +Cu====2FeCl 2 +CuCl 2 。 (4) 检验 Fe(NO 3 ) 2 晶体是否氧化变质的方法是将 Fe(NO 3 ) 2 样品溶于稀硫酸后 , 滴加 KSCN 溶液 , 观察溶液是否变红。 ( ) 提示 : × 。由于 Fe(NO 3 ) 2 溶液中含有 , 加入稀硫酸 后 , (H + ) 会将 Fe 2+ 氧化成 Fe 3+ 。故不能用 KSCN 溶液检 验 Fe 3+ 而判断 Fe(NO 3 ) 2 是否变质。 2. 下列关于 Fe 3+ 、 Fe 2+ 性质实验的说法错误的是 ( ) A. 用如图装置可以制备沉淀 Fe(OH) 2 B. 配制 FeCl 3 溶液时 , 先将氯化铁晶体溶于较浓的盐酸中 , 再加水稀释到所需要的浓度 C. 向某溶液中滴加 KSCN 溶液 , 溶液不变色 , 滴加氯水后溶液显红色 , 此现象不能确定溶液中含有 Fe 2+ D. 向 FeCl 2 溶液中加入少量铁粉是为了防止 Fe 2+ 被氧化 【 解析 】 选 C 。反应开始时生成的氢气进入 B 中 , 可排出 氧气 , 防止生成的氢氧化亚铁被氧化 , 一段时间后关闭 止水夹 C,A 中硫酸亚铁进入 B 中可生成 Fe(OH) 2 , 故 A 正确 ; FeCl 3 易水解 , 配制溶液时应防止溶液因水解而生成氢 氧化铁沉淀 , 可先将氯化铁晶体溶于较浓的盐酸中 , 再 加水稀释到所需要的浓度 , 故 B 正确 ; 溶液中加入 KSCN 溶液 , 溶液不变色 , 说明无 Fe 3+ , 但滴加氯水后溶液显红色 , 说明生成了 Fe 3+ , 则原溶液中含有 Fe 2+ ,C 错误 ;Fe 3+ 与铁反应可生成 Fe 2+ , 则向 FeCl 2 溶液中加入少量铁粉是为了防止 Fe 2+ 被氧化 , 故 D 正确。 3. 下列说法错误的是 ( ) ① 向 NaClO 溶液中滴入少量 FeSO 4 溶液 , 反应的离子方程 式为 2Fe 2+ +ClO - +2H + ====Cl - +2Fe 3+ +H 2 O ② 向 FeSO 4 溶液中先滴入 KSCN 溶液 , 再滴加 H 2 O 2 溶液 , 溶 液变成血红色 , 说明 Fe 2+ 既有氧化性又有还原性 ③将稀硝酸加入过量铁粉中 , 充分反应后滴加 KSCN 溶液 , 有气体生成 , 溶液呈血红色 , 则稀硝酸将 Fe 氧化为 Fe 3+ ④ 向某溶液中滴加氯水后再加入 KSCN 溶液 , 溶液呈红色 , 溶液一定含有 Fe 2+ ⑤ 在溶液中加 KSCN, 溶液显红色 , 证明原溶液中有 Fe 3+ , 无 Fe 2+ A.①②③④ B.①②③④⑤ C.②③④ D.②③④⑤ 【 解析 】 选 B 。① NaClO 溶液为碱性 , 滴入少量硫酸亚铁 溶液时 , 亚铁离子被 ClO - 氧化 , 离子方程式中不能写 H + 而 应写水 , 生成 Fe(OH) 3 , 错误 ;② 向 FeSO 4 溶液中先滴入 KSCN 溶液再滴加 H 2 O 2 溶液 ,H 2 O 2 溶液将 Fe 2+ 氧化为 Fe 3+ , 溶液变为红色 , 体现了 Fe 2+ 的还原性 , 错误 ;③ 将稀硝酸 加入过量铁粉中 , 生成 Fe(NO 3 ) 2 、 NO 和水 , 无 Fe 3+ , 因此 加入 KSCN 后溶液不会变红 , 错误 ;④ 若溶液中有 Fe 3+ 也会出现红色 , 证明溶液中含有 Fe 2+ 应先加入 KSCN 溶液 , 无明显现象 , 再滴入氯水呈红色可证明含 Fe 2+ , 错误 ;⑤ 加入 KSCN 溶液 , 溶液显红色 , 说明一定含有 Fe 3+ , 但无法确定是否有 Fe 2+ , 错误。 4. 某班同学用如下实验探究 Fe 2+ 、 Fe 3+ 的性质。 回答下列问题 : 世纪金榜导学号 (1) 分别取一定量氯化铁、氯化亚铁固体 , 均配制成 0.1 mol·L -1 的溶液。在 FeCl 2 溶液中需加入少量铁屑 , 其目的是 _______________________________ 。 (2) 甲组同学取 2 mL FeCl 2 溶液 , 加入几滴氯水 , 再加入 1 滴 KSCN 溶液 , 溶液变红 , 说明 Cl 2 可将 Fe 2+ 氧化。 FeCl 2 溶 液与氯水反应的离子方程式为 _________________ 。 (3) 乙组同学认为甲组的实验不够严谨 , 该组同学在 2 mL FeCl 2 溶液中先加入 0.5 mL 煤油 , 再于液面下依次 加入几滴氯水和 1 滴 KSCN 溶液 , 溶液变红 , 煤油的作用是 ____________________________________ 。 (4) 丙组同学取 10 mL 0.1 mol·L -1 KI 溶液 , 加入 6 mL 0.1 mol·L -1 FeCl 3 溶液混合。分别取 2 mL 此溶液于 3 支试管中进行如下实验 : ① 第一支试管中加入 1 mL CCl 4 充分振荡、静置 ,CCl 4 层显紫色 ; ② 第二支试管中加入 1 滴 K 3 [Fe(CN) 6 ] 溶液 , 生成蓝色沉淀 ; ③ 第三支试管中加入 1 滴 KSCN 溶液 , 溶液变红。 实验②检验的离子是 ________( 填离子符号 ); 实验①和③说明 : 在 I - 过量的情况下 , 溶液中仍含有 ________( 填离子符号 ), 由此可以证明该氧化还原反应为 ________________________________ 。 (5) 丁组同学向盛有 H 2 O 2 溶液的试管中加入几滴酸化的 FeCl 2 溶液 , 溶液变成棕黄色 , 发生反应的离子方程式为 ____________________________________ 。 一段时间后 , 溶液中有气泡出现 , 并放热 , 随后有红褐色 沉淀生成。产生气泡的原因是 ______________ 。 生成沉淀的原因是 _____________________( 用平衡移 动原理解释 ) 。 【 解析 】 (1)Fe 2+ 具有很强的还原性 , 易被空气中的 O 2 氧化为 Fe 3+ , 在 FeCl 2 溶液中加入少量铁屑 , 可防止 Fe 2+ 被氧化。 (2)Fe 2+ 被氧化为 Fe 3+ ,Cl 2 被还原为 Cl - , 反应的离子方程式为 2Fe 2+ +Cl 2 ====2Fe 3+ +2Cl - 。 (3)O 2 难溶于煤油 , 加入煤油能隔绝空气 , 排除 O 2 对实验的影响。 (4)KI 溶液与 FeCl 3 溶液反应的离子方程式为 2I - +2Fe 3+ ====I 2 +2Fe 2+ 。 K 3 [Fe(CN) 6 ] 是检验 Fe 2+ 的试剂。实验 ③ 溶液变红 , 说明溶液中仍存在 Fe 3+ , 由此可说明该氧化还原反应为可逆反应。 (5) 酸化的 FeCl 2 溶液与 H 2 O 2 反应 ,Fe 2+ 被氧化为 Fe 3+ ,H 2 O 2 被还原为 H 2 O, 反应的离子方程式为 H 2 O 2 +2Fe 2+ +2H + ==== 2Fe 3+ +2H 2 O 。 Fe 3+ 对 H 2 O 2 的分解起催化作用 , 当反应一段 时间后 , 会发生反应 :2H 2 O 2 2H 2 O+O 2 ↑, 故溶液中产 生气泡。由于 H 2 O 2 分解反应放热 , 促使 Fe 3+ +3H 2 O Fe(OH) 3 +3H + 平衡右移 , 最终出现 Fe(OH) 3 红褐色沉淀。 答案 : (1) 防止 Fe 2+ 被氧化 (2)2Fe 2+ +Cl 2 ====2Fe 3+ +2Cl - (3) 隔绝空气 ( 排除氧气对实验的影响 ) (4)Fe 2+ Fe 3+ 可逆反应 (5)2Fe 2+ +H 2 O 2 +2H + ====2Fe 3+ +2H 2 O Fe 3+ 催化 H 2 O 2 分解产生 O 2 H 2 O 2 分解反应放热 , 促进 Fe 3+ 的水解平衡正向移动 【 归纳总结 】 1.Fe 2+ 、 Fe 3+ 的检验方法对比 鉴别方法 Fe 2+ Fe 3+ 直接观色 浅绿色 棕黄色 利用显 色反应 与 KSCN 溶液 无现象 显红色 鉴别方法 Fe 2+ Fe 3+ 利用 Fe 3+ 的氧化性 与铜片 无现象 Cu 溶解 , 溶液 变为蓝绿色 与 KI- 淀粉溶液 无现象 溶液变蓝 利用 Fe 2+ 的还原性 与溴水 溴水褪色 无现象 与酸性 KMnO 4 溶液 紫色褪去 无现象 鉴别方法 Fe 2+ Fe 3+ 利用沉淀反应 Fe 2+ +2OH - ====Fe(OH) 2 ↓, 4Fe(OH) 2 +O 2 +2H 2 O==== 4Fe(OH) 3 白色→灰绿色→红褐色 Fe 3+ +3OH - ====Fe(OH) 3 ↓ 红褐色沉淀 2. 含 Fe 2+ 、 Fe 3+ 的混合溶液中 Fe 3+ 、 Fe 2+ 的检验 (1)Fe 3+ 的检验 : (2)Fe 2+ 的检验 : 考点 3: 铜及其化合物的性质 1. 自然界铜元素的存在形式 (a) 主要以 _______ 形式存在 , 常见铜矿有黄铜矿 ( 主要成分为 CuFeS 2 ), 孔雀石 [ 主要成分为 CuCO 3 ·Cu(OH) 2 ] 等。 化合态 2. 单质铜的化学性质 (b) (1) 与非金属的反应 ( 写出化学方程式 ) 。 ①与 O 2 反应。 加热 :_______________ 。 常温下在潮湿的空气中 : 2Cu+O 2 +H 2 O+CO 2 ====Cu 2 (OH) 2 CO 3 。 ②与 Cl 2 反应 :________________(_____ 色烟 ) 。 2Cu+O 2 2CuO Cu+Cl 2 CuCl 2 棕黄 △ ==== 点燃 ==== (2) 与氧化性酸的反应 ( 写出相应的化学方程式 ) 。 铜与非氧化性酸不反应 , 与氧化性酸反应。 ①与浓硫酸的反应 : _________________________________ 。 ②与浓硝酸的反应 : ___________________________________ 。 Cu+2H 2 SO 4 ( 浓 ) CuSO 4 +SO 2 ↑+2H 2 O Cu+4HNO 3 ( 浓 )====Cu(NO 3 ) 2 +2NO 2 ↑+2H 2 O △ ==== ③ 与稀硝酸的反应 : _____________________________________ 。 (3) 与盐溶液的反应 ( 用离子方程式表示 ) 。 与硝酸银溶液的反应 :___________________ 。 与氯化铁溶液的反应 :_____________________ 。 3Cu+8HNO 3 ( 稀 )====3Cu(NO 3 ) 2 +2NO↑+4H 2 O Cu+2Ag + ====Cu 2+ +2Ag 2Fe 3+ +Cu====2Fe 2+ +Cu 2+ 3. 氧化铜和氧化亚铜 名称 氧化铜 氧化亚铜 颜色 黑色 砖红色 与酸反应 (H + ) __________________ ____________ ___________ 与 H 2 反应 _________________ ___________________ 转化关系 ___________________ CuO+2H + ====Cu 2+ +H 2 O Cu 2 O+2H + ==== Cu 2+ +Cu+H 2 O CuO+H 2 Cu+H 2 O Cu 2 O+H 2 2Cu+H 2 O 4CuO 2Cu 2 O+O 2 ↑ △ ==== △ ==== 高温 ==== 4. 氢氧化铜 (1) 物理性质 :___ 色 ___ 溶于水的固体。 (2) 化学性质及应用 蓝 不 5. 硫酸铜 (1)CuSO 4 ·5H 2 O 为蓝色晶体 , 俗称 ___________, 受热易 分解为白色粉末 CuSO 4 和水。 (2) 无水 CuSO 4 遇水变蓝色 ( 生成 CuSO 4 ·5H 2 O), 可作为水 的检验试剂。 (3)CuSO 4 与石灰乳的混合液即为无机农药波尔多液 , 是 一种良好的杀菌剂 , 可以用来防治多种作物的病害。 蓝矾或胆矾 6. 铜的冶炼 (1) 高温炼铜 : 黄铜矿 粗铜 精铜 (2) 生物炼铜 : 硫化铜矿石 CuSO 4 Cu (3) 湿法炼铜 :CuSO 4 +Fe====FeSO 4 +Cu 【 典例精析 】 【 典例 】 铜及其化合物在工农业生产领域有着重要的用途 , 氯化铜、氯化亚铜经常用作催化剂。其中 CuCl 广泛应用于化工和印染等行业。 【 查阅资料 】 (ⅰ) 氯化铜 : 从水溶液中结晶时 , 在 15 ℃ 以下得到四水物 , 在 15 ~ 25.7 ℃ 得到三水物 , 在 26 ~ 42 ℃ 得到二水物 , 在 42 ℃ 以上得到一水物 , 在 100 ℃ 得到无水物。 (1) 实验室用如图所示的实验仪器及药品制备纯净、干燥的氯气并与铜反应 ( 铁架台、铁夹略 ) 制备氯化铜。 ①按气流方向连接各仪器接口的顺序是 a→________ 、 ________→________ 、 ________→________ 、 ________→________ 。 ②本套装置有两个仪器需要加热 , 加热的顺序为先 ________ 后 ________ 。 (2) 印刷电路板是由高分子材料和铜箔复合而成 , 刻制印刷电路板时 , 要用 FeCl 3 溶液作为“腐蚀液” , 写出该反应的化学方程式 :________________________ 。 (3) 现欲从 (2) 所得溶液获得纯净的 CuCl 2 ·2H 2 O, 进行如下操作 : ① 首先向溶液中加入 H 2 O 2 溶液然后再加试剂 X 用于调节 pH, 过滤 , 除去杂质 ,X 可选用下列试剂中的 ________( 填序号 ) 。 a.NaOH b.NH 3 ·H 2 O c.CuO d.CuSO 4 ② 要获得纯净 CuCl 2 ·2H 2 O 晶体的操作步骤 : 向①所得滤液中加少量盐酸 , 蒸发浓缩、 ________ 、 ________ 、洗涤、干燥。 (4) 用 CuCl 2 ·2H 2 O 为原料制备 CuCl 时 , 发现其中含有少 量的 CuCl 2 或 CuO 杂质 , 若杂质是 CuCl 2 , 则产生的原因是 ________________________________________ 。 (5) 设计简单的实验验证 0.1 mol·L -1 的 CuCl 2 溶液中的 Cu 2+ 对 H 2 O 2 的分解具有催化作用 :_______________ 。 【 解题思路 】 本题的解题关键有 : (1) 掌握铜及其化合物的性质。 (2) 明确物质制备的流程及方法。 【 解析 】 (1) ① 用装置 A 制备 Cl 2 , 制得的 Cl 2 中混有 HCl 、 H 2 O(g), 所以将气体先通过盛饱和食盐水的装置 C 除去 HCl, 再通过盛浓硫酸的装置 E 干燥 Cl 2 , 用纯净、干燥的 Cl 2 与 Cu 反应制备 CuCl 2 ; 由于 Cl 2 会污染大气 , 最后用盛放 NaOH 溶液的装置 B 吸收尾气 ; 同时注意洗气时导气管应长进短出 ; 按气流方向连接各仪器接口的顺序是 : a→d 、 e→h 、 i→f 、 g→b 。 ② 实验室用 MnO 2 和浓盐酸加热制 Cl 2 ,Cu 与 Cl 2 加热反应制备 CuCl 2 , 则装置 A 和装置 D 需要加热 ; 为了防止 Cu 与空气中的 O 2 反应生成 CuO, 所以实验时必须先加热装置 A 产生 Cl 2 , 用生成的 Cl 2 赶尽装置中的空气后再加热装置 D 。 (2)Cu 与 FeCl 3 溶液反应生成 CuCl 2 和 FeCl 2 。 (3) ① 向 (2) 所得溶液中加入 H 2 O 2 溶液将 Fe 2+ 氧化成 Fe 3+ , 加入试剂 X 调节 pH 除去 Fe 3+ 。 a 项 , 加入 NaOH 可调节 pH 除 去 Fe 3+ , 但引入新杂质 Na + ;b 项 , 加入 NH 3 ·H 2 O 可调节 pH 除 去 Fe 3+ , 但引入新杂质 ;c 项 , 加入 CuO 可调节 pH 除去 Fe 3+ , 且不引入新杂质 ;d 项 , 加入 CuSO 4 不能除去 Fe 3+ 。 ② 根据题给资料 ( ⅰ ) 要获得 CuCl 2 ·2H 2 O 需控制温度在 26 ~ 42 ℃ 。 (4) 根据资料 ( ⅱ ),CuCl 2 ·2H 2 O 在 HCl 气流中加热到 140 ℃ 失去结晶水生成 CuCl 2 , 继续加热到温度大于 300 ℃ 时生成 CuCl 和 Cl 2 , 若发现 CuCl 中含有杂质 CuCl 2 , 产生的原因是加热温度低或加热时间不够。 (5) 要证明 0.1 mol·L -1 CuCl 2 溶液中的 Cu 2+ 对 H 2 O 2 的分 解具有催化作用可采用控制变量法 , 控制 H 2 O 2 溶液等浓 度、等体积 , 两溶液中 Cl - 浓度相同。 答案 : (1) ① d e h i f g b ② A D (2)2FeCl 3 +Cu====2FeCl 2 +CuCl 2 (3) ① c ② 冷却到 26 ~ 42 ℃ 结晶 过滤 (4) 加热温度低 ( 或加热时间不够 ) (5) 取两支试管 , 加入等体积、等浓度的过氧化氢溶液 , 一支加入几滴 0.1 mol·L -1 的 CuCl 2 溶液 , 另一支加入几滴 0.2 mol·L -1 的 NaCl 溶液 , 滴加氯化铜溶液的试管产生气泡的速率快 ( 其他合理答案也可 ) 【 强化训练 】 1. 判断正误 ( 正确的打“√” , 错误的打“ ×”) (1) 除去铜粉中混有的 CuO, 加入稀硝酸 , 过滤、洗涤、干燥。 ( ) 提示 : × 。 Cu 、 CuO 都可溶于稀硝酸。 (2) 过量的铜与浓硝酸反应一定没有一氧化氮生成。 ( ) 提示 : × 。当浓硝酸变稀时生成 NO 。 (3) 利用无水硫酸铜遇水变成蓝色这一性质 , 来检验水的存在。 ( ) 提示 : √ 。无水硫酸铜遇水生成蓝色的 CuSO 4 ·5H 2 O 。 (4) 将铜丝插入浓硫酸加热 , 反应后把水加入反应器中 , 观察硫酸铜溶液的颜色。 ( ) 提示 : × 。应把反应液倒入水中。 (5) 将铜粉加入 1.0 mol·L -1 Fe 2 (SO 4 ) 3 溶液中 , 现象是溶液变蓝 , 有黑色固体出现。 ( ) 提示 : × 。铜粉不能置换出铁 , 故没有黑色固体出现。 (6)Cu 2 (OH) 2 CO 3 是铜锈的主要成分 , 在干燥的空气中不易生成。 ( ) 提示 : √ 。铜锈的生成需要水参加反应。 2.( 高考试题改编 ) 下列说法或转化正确的是 ( ) 世纪金榜导学号 A.MgCO 3 MgCl 2 (aq) Mg B. 工业上通过电解氯化钠溶液制备金属钠和氯气 C. 钢铁厂用热还原法冶炼铁 D. 工业上电解熔融状态的 Al 2 O 3 制备 Al 不涉及氧化还原反应 【 解析 】 选 C 。 Na 、 Mg 属于活泼金属 , 用电解熔融 NaCl 、 MgCl 2 的方法制备而不能电解 NaCl 溶液、 MgCl 2 溶液 ,A 、 B 错误 ; 电解熔融 Al 2 O 3 制取 Al 的反应为 2Al 2 O 3 ( 熔融 ) 4Al+3O 2 ↑, 该反应属于氧化还原反应 ,D 错误。 3. (2019· 济南模拟 ) 某化学兴趣小组对金牌成分提出猜想 : 甲认为金牌是由纯金制造 ; 乙认为金牌是由金银合金制成 ; 丙认为金牌是由黄铜 ( 铜锌合金 ) 制成。为了验证他们的猜想 , 请你选择一种试剂来证明甲、乙、丙猜想的正误 ( ) A. 硫酸铜溶液 B. 稀硝酸 C. 盐酸 D. 硝酸银溶液 【 解析 】 选 B 。当金牌是纯金时遇到稀硝酸不溶解 ; 当金牌是金银合金时遇到稀硝酸会部分溶解 ; 当金牌是黄铜时遇到稀硝酸会全部溶解。 4. 新制氢氧化铜存在平衡 :Cu(OH) 2 +2OH - Cu(OH) 4 2- ( 深蓝色 ) 。某同学进行下列实验 : 下列说法不正确的是 ( ) A.① 中出现蓝色沉淀 B.③ 中现象是 Cu(OH) 2 +2OH - Cu(OH) 4 2- 正向移动的结果 C.④ 中现象证明葡萄糖具有还原性 D. 对比②和④可知 Cu(OH) 2 氧化性强于 Cu(OH) 4 2- 【 解析 】 选 D 。 CuSO 4 溶液与 NaOH 溶液反应可生成蓝色沉 淀 Cu(OH) 2 ,A 正确。新制 Cu(OH) 2 存在平衡 :Cu(OH) 2 +2OH - Cu(OH) 4 2- , 加入 NaOH, 氢氧根离子的浓度增大 , 平 衡正向移动 ,B 正确。③中加入葡萄糖溶液有砖红色的 沉淀生成 , 说明葡萄糖中含有醛基 , 所以葡萄糖具有还原 性 ,C 正确。④中氧化葡萄糖的是 Cu(OH ) 4 2- , 而②中未生 成砖红色沉淀 , 可知氧化性 :Cu(OH) 2查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档