山东专用2020届高考化学二轮复习题组20化学平衡图像练习含解析
题组20 化学平衡图像
一、单项选择题
1.可逆反应:mA(s)+nB(g) pC(g)+qD(g),反应过程中其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
A.达到平衡后,使用催化剂,C%将增大
B.达到平衡后,若升高温度,化学平衡向逆反应方向移动
C.化学方程式中n>p+q
D.达到平衡后,增加A的量,有利于化学平衡向正反应方向移动
答案 B 可逆反应中当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短。由图像可知T1>T2,温度越高,平衡时C的百分含量越小,故此反应的正反应为放热反应;当其他条件一定时,压强越大,反应速率越大,达到平衡所用的时间越短。由图像可知p2>p1,压强越大,平衡时C的百分含量越小,可知正反应为气体物质的量增大的反应,即n
T2
B.图Ⅰ中,CO2的转化率:c>b>a
C.图Ⅱ中,T1之前随着温度升高,平衡向右移动
D.图Ⅱ中,CO2的转化率:f>e>d
答案 B A项,CO2和H2的反应是放热反应,当投料比一定时,升温使平衡向左移动,CH3OH的体积分数减小,故T2>T1;B项,CH3OH的体积分数与投料比有关,b点达到平衡,平衡后再增大H2与CO2的投料比,CO2的平衡转化率增大,但是因为H2和CO2加入总量一定,所以甲醇生成量较b点小,因此甲醇体积分数减小;C项,图Ⅱ中,T1
- 5 -
之前反应未达到平衡,不存在平衡移动。随着温度升高,反应速率增大,甲醇的浓度增大;D项,达到平衡之后,升高温度,平衡向左移动,甲醇浓度减小,CO2的转化率降低,即起始投料比一定,甲醇浓度越小,CO2的转化率越小,故CO2的转化率为e>d>f。
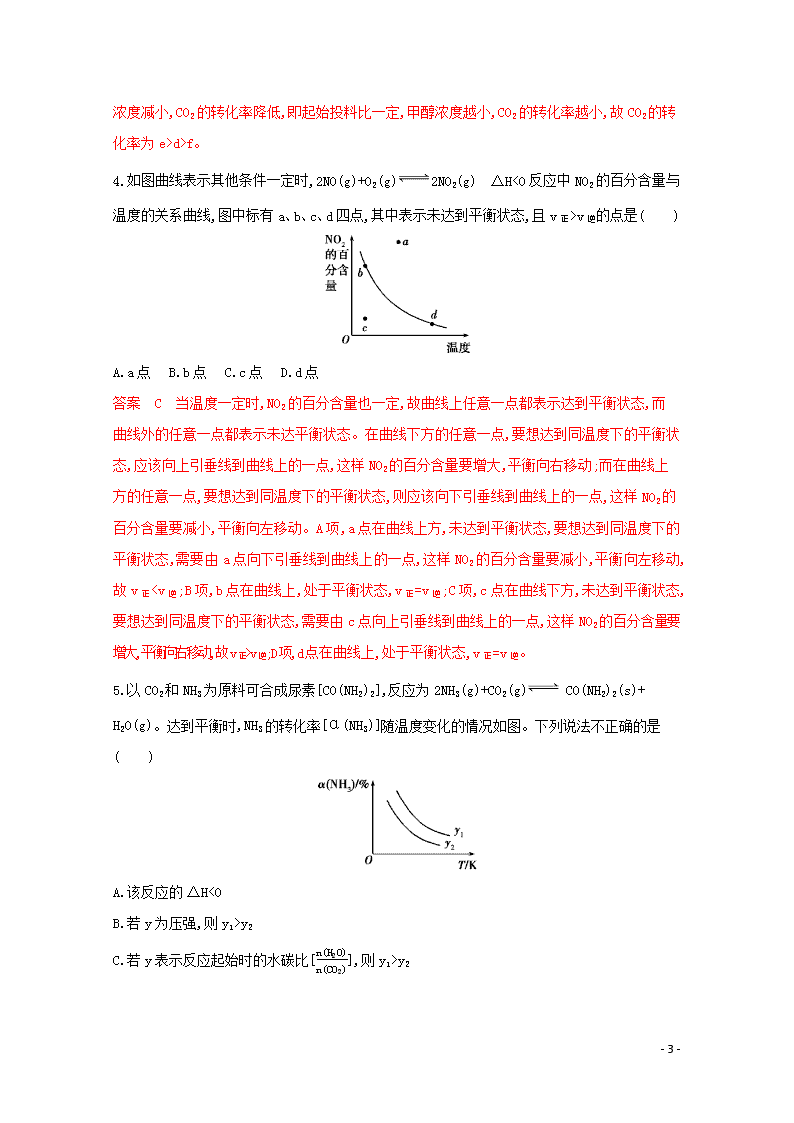
4.如图曲线表示其他条件一定时,2NO(g)+O2(g) 2NO2(g) ΔH<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v正>v逆的点是( )
A.a点 B.b点 C.c点 D.d点
答案 C 当温度一定时,NO2的百分含量也一定,故曲线上任意一点都表示达到平衡状态,而曲线外的任意一点都表示未达平衡状态。在曲线下方的任意一点,要想达到同温度下的平衡状态,应该向上引垂线到曲线上的一点,这样NO2的百分含量要增大,平衡向右移动;而在曲线上方的任意一点,要想达到同温度下的平衡状态,则应该向下引垂线到曲线上的一点,这样NO2的百分含量要减小,平衡向左移动。A项,a点在曲线上方,未达到平衡状态,要想达到同温度下的平衡状态,需要由a点向下引垂线到曲线上的一点,这样NO2的百分含量要减小,平衡向左移动,故v正v逆;D项,d点在曲线上,处于平衡状态,v正=v逆。
5.以CO2和NH3为原料可合成尿素[CO(NH2)2],反应为2NH3(g)+CO2(g) CO(NH2)2(s)+
H2O(g)。达到平衡时,NH3的转化率[α(NH3)]随温度变化的情况如图。下列说法不正确的是( )
A.该反应的ΔH<0
B.若y为压强,则y1>y2
C.若y表示反应起始时的水碳比[n(H2O)n(CO2)],则y1>y2
- 5 -
D.在恒温恒容(2 L)容器和绝热恒容(2 L)容器中,分别加入2 mol NH3(g)和1 mol CO2(g),达到平衡时,恒温恒容体系中氨气的转化率大于绝热恒容体系中氨气的转化率
答案 C A项,由图像可知,氨气的转化率随温度的升高而减小,因此,该反应是放热反应,即ΔH<0;B项,正反应方向为压强减小的反应,因此加压平衡正向移动,氨气的转化率增大,所以y1>y2;C项,起始时的水碳比越小,代表起始时CO2越多,则氨气的转化率越大,因此y1
查看更多