- 2021-05-12 发布 |
- 37.5 KB |
- 23页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】浙江省金华市方格外国语学校2019-2020学年高二上学期期中考试试题(解析版)
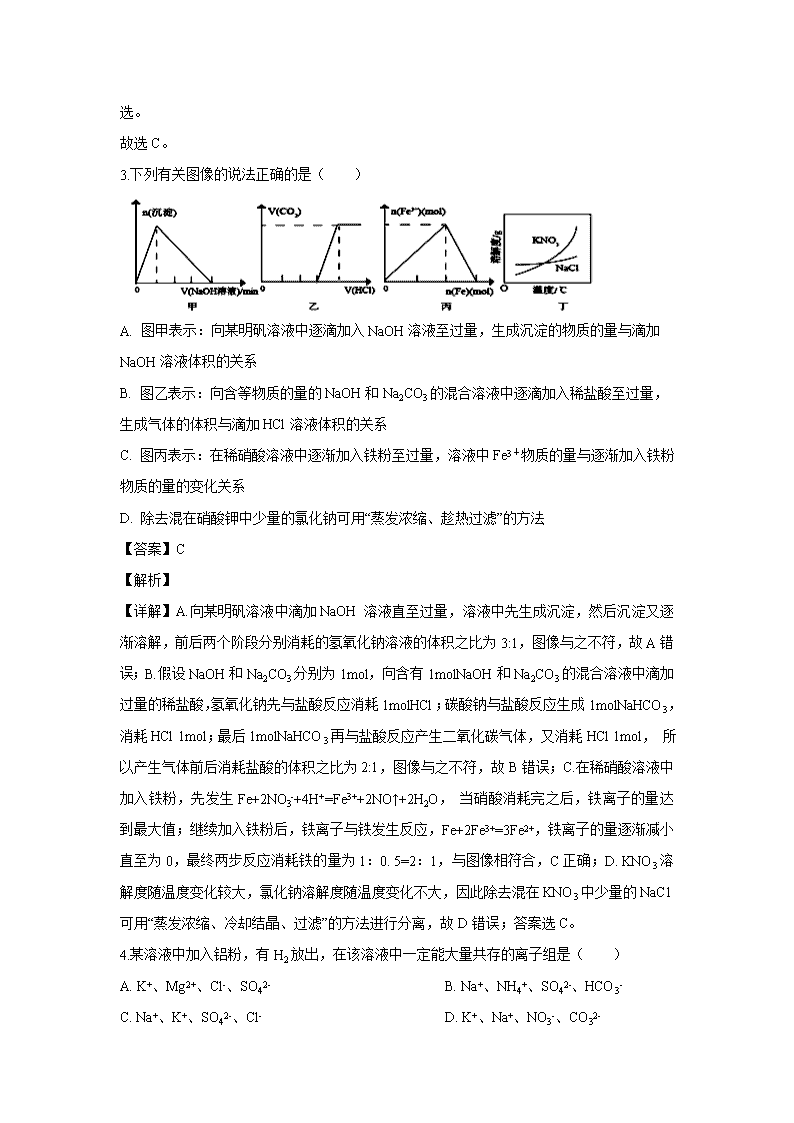
浙江省金华市方格外国语学校2019-2020学年高二上学期期中考试试题 第I卷(选择题) 一、选择题(每小题2分,共50分,每小题只有一个正确答案) 1.下列除杂方法中错误的是(括号中的物质为杂质)( ) A. NaCl(NH4C1):加热分解 B. NH3 (H2O):将气体通过碱石灰 C. CO2 (CO):将气体通过灼热的CuO D. Fe (A1):高温下与Fe2O3反应 【答案】D 【解析】 【详解】A. NaCl(NH4C1):加热时,氯化铵受热分解生成气体逸出,而氯化钠不分解,可用加热法除杂,与题意不符,A错误; B. NH3 (H2O):将气体通过碱石灰时,碱石灰除去水蒸气,不与氨气反应,氨气逸出,可用碱石灰除杂,与题意不符,B错误; C. CO2 (CO):将气体通过灼热的CuO,CO与CuO反应生成二氧化碳,可以除杂,与题意不符,C错误; D. Fe (A1):高温下A1与Fe2O3反应反应生成氧化铝固体、铁固体,不能除杂,符合题意,D正确; 答案为D。 2.下列离子方程式正确的是( ) A. 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ B. 氯气和冷水反应:Cl2+H2O=2H++Cl-+ClO- C. 铝和烧碱溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ D. AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O 【答案】C 【解析】 【详解】A. 电荷不守恒,正确的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故A不选; B. 氯气和冷水反应生成的HClO是弱酸,不能拆成离子形式,故B不选; C. 铝和烧碱溶液反应生成偏铝酸钠和氢气,正确,故C选; D. AlCl3 溶液中加入氨水生成氢氧化铝沉淀,即使氨水过量,氢氧化铝也不能溶解,故D不选。 故选C。 3.下列有关图像的说法正确的是( ) A. 图甲表示:向某明矾溶液中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与滴加NaOH溶液体积的关系 B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸至过量,生成气体的体积与滴加HCl溶液体积的关系 C. 图丙表示:在稀硝酸溶液中逐渐加入铁粉至过量,溶液中Fe3+物质的量与逐渐加入铁粉物质的量的变化关系 D. 除去混在硝酸钾中少量的氯化钠可用“蒸发浓缩、趁热过滤”的方法 【答案】C 【解析】 【详解】A.向某明矾溶液中滴加NaOH 溶液直至过量,溶液中先生成沉淀,然后沉淀又逐渐溶解,前后两个阶段分别消耗的氢氧化钠溶液的体积之比为3:1,图像与之不符,故A错误;B.假设NaOH和Na2CO3分别为1mol,向含有1molNaOH和Na2CO3的混合溶液中滴加过量的稀盐酸,氢氧化钠先与盐酸反应消耗1molHCl;碳酸钠与盐酸反应生成1molNaHCO3,消耗HCl 1mol;最后1molNaHCO3再与盐酸反应产生二氧化碳气体,又消耗HCl 1mol, 所以产生气体前后消耗盐酸的体积之比为2:1,图像与之不符,故B错误;C.在稀硝酸溶液中加入铁粉,先发生Fe+2NO3-+4H+=Fe3++2NO↑+2H2O, 当硝酸消耗完之后,铁离子的量达到最大值;继续加入铁粉后,铁离子与铁发生反应,Fe+2Fe3+=3Fe2+,铁离子的量逐渐减小直至为0,最终两步反应消耗铁的量为1:0. 5=2:1,与图像相符合,C正确;D. KNO3溶解度随温度变化较大,氯化钠溶解度随温度变化不大,因此除去混在KNO3中少量的NaC1可用“蒸发浓缩、冷却结晶、过滤”的方法进行分离,故D错误;答案选C。 4.某溶液中加入铝粉,有H2放出,在该溶液中一定能大量共存的离子组是( ) A. K+、Mg2+、Cl-、SO42- B. Na+、NH4+、SO42-、HCO3- C. Na+、K+、SO42-、Cl- D. K+、Na+、NO3-、CO32- 【答案】C 【解析】 【分析】加入铝粉能够产生氢气,溶液中可能存在大量的H+或OH-。 【详解】A.Mg2+与氢氧根离子反应生成氢氧化镁沉淀,在溶液中不能大量共存,故A错误; B.HCO3-能够与H+和OH-发生反应,NH4+与氢氧根离子反应,在溶液中一定不能大量共存,故B错误; C.Na+、K+、SO42-、Cl-离子之间不发生反应,都不与H+和OH-反应,在溶液中能够大量共存,故C正确; D.CO32-与H+发生反应生成二氧化碳和水,NO3-在酸性条件下具有强氧化性,加入铝粉不会生成氢气,故D错误; 故选C。 5.人类在提高自身生活水平的同时还应关注环境问题,下列叙述不正确的是( ) A. 化石燃料的高消耗、森林面积的锐减是造成大气中二氧化碳浓度增高的主要原因 B. 氮氧化物和硫的氧化物都是形成酸雨的主要物质 C. 冬季取暖大量燃烧煤所释放出的有害气体是造成城市光化学烟雾的最主要原因 D. 当进入水体的氮的含量增大时,会造成水体的富营养化从而破坏水质 【答案】C 【解析】 【详解】A项、化石燃料的使用生成二氧化碳,森林可吸收二氧化碳,所以化石燃料的高消耗、森林面积的锐减是造成大气中二氧化碳浓度增高的主要原因,故A正确; B项、氮氧化物和硫的氧化物使雨水酸性增强,都是形成酸雨的主要物质,故B正确; C项、汽车尾气是造成城市光化学烟雾的最主要原因,取暖大量燃烧煤所释放出的有害气体可导致酸雨和温室效应,故C错误; D项、N元素可导致水中藻类植物大量繁殖,会造成水体的富营养化从而破坏水质,故D正确; 故选C。 6.俗话说“雷雨发庄稼”这是因为雷雨天空气中的某些物质之间发生了一系列化学反应,最终产生了氮肥。下列不属于其中的反应的是( ) A. N2+O2 2NO B. 2NO+O2=2NO2 C. 3NO2+H2O===2HNO3+NO D. 4NH3+5O24NO+6H2O 【答案】D 【解析】 【分析】“雷雨发庄稼”是首先将空气中游离态的氮气转化为氮的氧化物,而后溶于水形成硝酸根离子,便于被植物吸收。 【详解】A. N2+O2 2NO为将空气中的氮气转化为化合态的过程,A正确; B. 2NO+O2=2NO2为一氧化氮在空气中被氧化,B正确; C. 3NO2+H2O===2HNO3+NO为氮氧化物溶于水,形成硝酸根离子的过程,C正确; D. 4NH3+5O24NO+6H2O为氨气的催化氧化,与“雷雨发庄稼”无关,D错误; 答案选D。 7.下列实验装置、试剂选用或操作正确的是( ) A. 除去CO2中的HCl B. 稀释浓硫酸 C. 制取少量氨气 D. 干燥Cl2 【答案】D 【解析】 【详解】A.CO2与碳酸钠溶液反应生成碳酸氢钠,违反了除杂原则,应该用饱和碳酸氢钠溶液除杂,故A错误; B.容量瓶只能用于配制一定浓度的溶液,不能在容量瓶中稀释浓硫酸,故B错误; C.加热分解氯化铵固体生成的氨气和氯化氢在试管口附近又化合生成氯化铵,收集不到氨气,故C错误; D.氯气不与硫酸反应,可以用浓硫酸干燥氯气,且导管长进短出,故D正确; 故选D。 8.在给定条件下,能顺利实现下列所示物质间直接转化的是( ) A. AlNaAlO2(aq) B. FeFeOFe2(SO4)3 C. NH3NOHNO3 D. SiO2H2SiO3Na2SiO3(aq) 【答案】A 【解析】 【详解】A.Al与氢氧化钠反应,直接生成偏铝酸根,A项正确; B.Fe与水蒸气在高温下发生氧化还原反应,生成Fe3O4,而不是FeO,B项错误; C.NH3可以发生催化氧化生成NO,但NO和水不反应,C项错误; D.二氧化硅不溶于水,不能和水反应生成硅酸,D项错误; 答案选A。 9.NA代表阿伏加德罗常数的值。下列说法正确的是( ) A. 常温常压下,1mol P4(P原子均达到8电子稳定结构)中所含P-P键数目为4NA B. 20mL 10mol·L-1的浓硝酸与足量铜加热反应转移电子数为0.2NA C. 0.1mol NH2-所含电子数约为6.02×1023个 D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数小于0.2NA 【答案】C 【解析】 【详解】A. P4为正四面体结构,1mol P4(P原子均达到8电子稳定结构)中所含P-P键为6mol,其数目为6NA,A项错误; B. 浓硝酸与足量铜反应时,会随着浓度的降低变为稀硝酸,转移电子数会发生改变,故无法计算,B项错误; C. NH2-所含电子数为7+2+1=10,0.1 molNH2-所含电子数约为6.02×1023个,C项正确; D. H2+I2⇌2HI是可逆反应,但此反应也是一个反应前后分子物质的量不变的反应,故反应后分子总数仍为0.2NA,D项错误; 答案选C。 10.下列反应属于吸热反应的是( ) A. 工业上制氨气的反应 B. 葡萄糖在人体内氧化分解 C. 锌粒与稀H2SO4反应制取H2 D. Ba(OH)2·8H2O与NH4Cl反应 【答案】D 【解析】 【详解】A选项,工业上制氨气的反应是放热反应,故A错误; B选项,葡萄糖在人体内氧化分解是放热反应,故B错误; C选项,锌粒与稀H2SO4反应制取H2是放热反应,故C错误; D选项,Ba(OH)2·8H2O与NH4Cl反应是吸热反应,故D正确; 综上所述,答案为D。 11.下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( ) A B C D 图示 相关 信息 温度计的水银柱不断上升 反应物总能量大于生成物总能量 反应开始后,甲处液面低于乙处液面 反应开始后,针筒活塞向右移动 【答案】D 【解析】 【详解】A.盐酸和氢氧化钠发生中和反应,为放热反应,可观察到温度计的水银柱不断上升,故A正确; B.从能量守恒的角度分析,反应物总能量大于生成物总能量,为放热反应,故B正确; C.反应开始后,甲处液面低于乙处液面,说明装置内压强增大,反应为放热反应,温度升高,压强增大,故C正确; D.硫酸和锌反应生成氢气,导致反应开始后针筒活塞向右移动,不能说明一定是反应放热,造成体积的膨胀,故D错误。 所以本题答案:选D。 12.实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是( ) ①CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol−1 ②CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=−890.3 kJ·mol−1 ③CH4(g)+2O2(g)CO2(g)+2H2O(g) ΔH=−890.3 kJ·mol−1 ④2H2(g)+O2(g)2H2O(l) ΔH=−571.6 kJ·mol−1 A. 仅有② B. 仅有②④ C. 仅有②③④ D. 全部符合要求 【答案】B 【解析】 【详解】①.甲烷燃烧是放热反应,①错误; ②.热化学方程式书写符合题意,②正确; ③.生成的水应该是液态,③错误; ④. 1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,则2 mol H2完全燃烧生成液态水,放出571.6 kJ的热量,热化学方程式书写符合题意,④正确; 答案选B。 13.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2═2H2O,下列有关说法正确的是( ) A. 电流通过外电路从a极流向b极 B. b极上的电极反应式为O2+2H2O+4e-═4OH- C. 每转移0.2 mol电子,在负极上消耗标况下1.12 L的O2 D. H+由a极通过固体酸电解质传递到b极 【答案】D 【解析】 【分析】根据图像可知,a极为负极,H2-2e-=2H+,b极为正极,发生O2+4e-+4H+=2H2O。 【详解】A.电流由正极流向负极,则外电路电流从b极流向a极,A错误; B.b极上的电极反应式为O2+4e-+4H+=2H2O,B错误; C.每转移0.2 mol电子,在正极上消耗标况下1.12 L的O2,C错误; D.电池内电路中阳离子向正极移动,则H+由a极通过固体酸电解质传递到b极,D正确; 答案为D。 14.锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH−+2H2OZn(OH)42-。下列说法不正确的是( ) A. 充电时,电解质溶液中K+向阴极移动 B. 充电时,电解质溶液中c(OH−)逐渐增大 C. 放电时,负极反应为:Zn+4OH−−2e−=Zn(OH)42- D. 放电时,电路中通过2 mol电子,消耗氧气11.2 L 【答案】D 【解析】 【详解】A. 充电时,为电解池,溶液中的阳离子向阴极移动,则电解质溶液中K+向阴极移动,A正确; B. 充电时,阴极发生Zn(OH)42--2e-=Zn+4OH-,电解质溶液中c(OH−)逐渐增大,B正确; C. 放电时,Zn作负极,失电子与溶液中氢氧根离子反应生成Zn(OH)42-,负极反应为:Zn+4OH−−2e−=Zn(OH)42-,C正确; D. 放电时,电路中通过2 mol电子,消耗标况下氧气体积为11.2 L,D不正确。 综上所述,相关说法不正确的是D,答案为D。 15.化学与生产、生活密切联系.下列有关说法正确的是( ) A. 光导纤维是一种新型的有机高分子材料 B. 二氧化硫有毒,禁止用作葡萄酒添加剂 C. 燃料电池是利用燃料在电池中燃烧实现热能转化为电能 D. 港珠澳大桥使用新一代环氧涂层钢筋,可有效抵御海水浸蚀 【答案】D 【解析】 【详解】A.光导纤维主要成分为二氧化硅,不属于有机高分子材料,A项错误; B.少量SO2能够杀菌,因此SO2可用于制作葡萄酒的食品添加剂,故B错误; C.燃料电池属于原电池,是将化学能转化为电能的装置,燃料在电池中不经过燃烧即可实现化学能转化为电能,故C错误; D.环氧树脂涂层钢筋是在普通钢筋表面制备一层环氧树脂薄膜保护层的钢筋.采用这种钢筋能有效地防止处于恶劣环境下的钢筋被腐蚀,故D正确; 本题选D。 16.在下列装置中(都盛有0.1mol·L-1H2SO4溶液)Zn片腐蚀最快的是( ) A. B. C. D. 【答案】C 【解析】 【分析】电化学腐蚀较化学腐蚀快,金属得到保护时,腐蚀较慢,作原电池正极和电解池阴极的金属被保护,腐蚀快慢为:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀。 【详解】A中发生化学腐蚀;B中锌作原电池正极,保护锌;C中锌作负极,发生电化学腐蚀,加快锌的腐蚀;D中锌作电解池阴极,不易被腐蚀,所以腐蚀速率由快到慢的顺序为CABD, 故选:C。 17.把X气体和Y气体混合于2L容器中使它们发生如下反应,3X(g)+Y(g)nZ(g)+2W(g),5 min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是( ) A. 1 B. 2 C. 3 D. 4 【答案】A 【解析】 【详解】5 min末已生成0.2molW,以W浓度变化来表示的反应平均速率为0.02 mol·L-1·min-1,以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,根据速率比等于系数比,则n=1,故选A。 18.对于一定条件下进行的化学反应:2SO3(g) 2SO2(g)+O2(g),改变下列条件,可以提高反应物活化分子百分数的是( ) ①增大压强②升高温度③加入催化剂④增大反应物浓度 A. ①② B. ②③ C. ①②③ D. ①②④ 【答案】B 【解析】 【详解】①增大压强,只能改变单位体积内活化分子数; ②升高温度,可以使能量较低的分子变成活化分子,所以既能改变单位体积内活化分子数,也能改变活化分子百分数; ③加入催化剂,降低反应的活化能,可以使更多的反应物分子变成活化分子,所以既能改变单位体积内活化分子数,也能改变活化分子百分数; ④增大反应物浓度,只能改变单位体积内活化分子数,所以②③符合题意; 答案选B。 19.反应4A(s)+3B(g)2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列有关说法正确的是( ) ①用A表示的反应速率是0.4 mol·L-1·min-1 ②在2 min末时,反应物B的反应速率是0.3 mol·L-1·min-1 ③在这2 min内用C表示的平均速率为0.2 mol·L-1·min-1 ④在2 min时,B、C、D的浓度比一定为3∶2∶1 ⑤若D的起始浓度为0.1 mol·L-1,则2 min时D的浓度为0.3 mol·L-1 A. ①②③ B. ②④ C. ④⑤ D. ③⑤ 【答案】D 【解析】 【详解】①A使固体,浓度是常数,不能用单位时间内浓度的变化量来表示,①错; ②B在2min内的平均反应速率0.3mol/(Lmin),2min末的反应速率是瞬时速率,比0.3mol/(Lmin)小,②错; ③v(C)=v(B)=0.2mol/(Lmin),③正确; ④不知各物质的起始浓度,由于最终浓度与方程式的化学计量数没有必然关系,④错误; ⑤经2 min B的浓度减少0.6 mol·L-1,B的系数为3,D的系数为1,所以生成了0.2 mol·L-1的D,所以2 min时D的浓度为0.3 mol·L-1,⑤正确,所以③⑤正确; 答案选D。 20.对于反应在容积为10L的密闭容器中进行。起始时和 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( ) A. 实验c条件下,从反应开始至达到平衡时 B. 实验a条件下,用浓度表示的平衡常数为100 C. 该反应的 D. 比较实验a、c可判断升高温度反应速率加快 【答案】C 【解析】 【详解】A. 实验c条件下,实验中60min到达平衡,恒温恒容下,利用压强之比等于物质的量之比计算平衡时混合气体总物质的量,再利用差量法代入公式计算得(0.2+0.2)mol×=0.32mol,0.4mol-0.32mol=0.08mol,所以,A项正确; B.恒温恒容下,压强之比等于物质的量之比,实验a中平衡时混合气体总物质的量为(0.2+0.2)mol×=0.3mol,这说明平衡时消耗反应物的物质的量和生成的生成物的物质的量均是0.4mol-0.3mol=0.1mol,剩余反应物均是0.2mol-0.1mol=0.1mol,容器容积为10L,则平衡常数K===100,B项正确; C. 根据c和a的反应判断,c起始压强较大,而投料量和容器的体积都没有变化,所以由公式PV=nRT来推断,是温度引起的,即c中温度高于a中温度,根据A和B可知c中反应物转化率低,说明升高温度,反应逆向进行,所以该反应为放热反应,C项错误; D. 根据以上分析可知c中温度高,反应首先达到平衡状态,所以比较实验a、c可判断升高温度反应速率加快,D项正确; 答案选C。 21.在一个不传热的固定容积的密闭容器中,发生可逆反应:,当m、n、p、q为任意整数时,反应达到平衡的标志是( ) ①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分质量分数不再改变 ⑤反应速率 ⑥单位时间内m mol A断键反应,同时p mol C也断键反应 ⑦体系的密度不再变化( ) A. ③⑤⑥ B. ②③④⑥ C. ①③④⑤ D. ④⑥⑦ 【答案】B 【解析】 【详解】①因为与的关系不确定,故容器内的压强随时间的变化不一定是变量,故①不一定是平衡状态; ②因容器是“不传热的固定容积的密闭容器”,反应过程中,体系中的温度应随时间发生变化,当温度不变时是平衡状态,故②能说明反应已达到平衡状态; ③④各组分的浓度不再改变和各组分质量分数不再改变,反应都一定是平衡状态,故③④能说明反应已达平衡状态; ⑤速率之比等于方程式中化学计量数之比是恒定的,不论反应是否达到平衡状态都存在这一关系,故⑤不一定是平衡状态; ⑥单位时间内m mol A断键反应,则说明有p mol C生成(同时p mol C也断键反应),故⑥能说明反应已达平衡状态; ⑦体系的总质量和总体积始终不变,体系的密度始终不变化,故⑦不能说明反应已达平衡状态。 答案选B。 22.在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是( ) A. 若b、c点的平衡常数分别为K1、K2,则K1>K2 B. a、b两点的反应速率:b>a C. 为了提高Br2(g)转化率,可采取增加Br2(g)通入量的方法 D. 若平衡后保持温度不变,压缩容器体积平衡一定不移动 【答案】B 【解析】 【详解】A、从图分析,在T2温度下平衡时氢气的体积分数小,说明平衡正向移动,温度低,平衡常数增大,所以K1查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档