- 2021-05-12 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考山东卷理科综合化学部分试题及答案有word 完美版
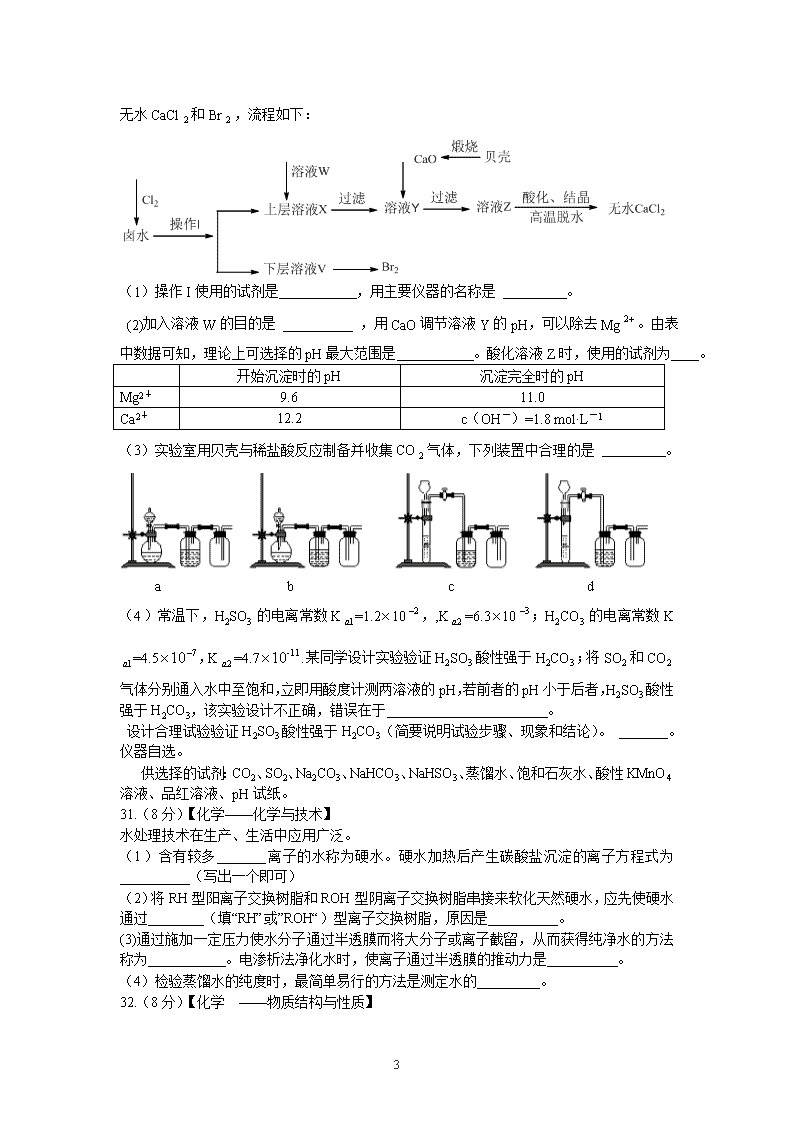
2011年普通高等学校招生全国统一考试(山东卷) 理科综合能力测试 第Ⅰ卷(必做,共88分) 一、选择题(本题共15小题,每小题4分,在每小题给出的四个选项中,只有一项是符合题目要求) 9、化学与生产、生活密切相关。下列叙述正确的是( ) A.煤的干馏和石油的分馏均属化学变化 B.BaSO4在医学上用作钡餐,Ba2+对人体无毒 C.14C可用于文物的年代鉴定,14C与13C互为同素异形体 D.葡萄糖注射液不能产生丁达尔现象,不属于胶体 10.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( ) A.在自然界中只以化合态存在 B.单质常用作半导体材料和光导纤维 C.最高价氧化物不与酸反应 D.气态氢化物比甲烷稳定 11、下列与有机物结构、性质相关的叙述错误的是( ) A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解 C.甲烷与氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 12、Al、Fe、Cu都是重要的金属元素。下列说法正确的是( ) A.三者对应的氧化物均为碱性氧化物 B.三者的单质放置在空气中均只生成氧化物 C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液蒸干的方法 D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极依次析出Cu、Fe、Al 13、元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( ) A.元素原子的最外层电子数等于元素的最高化合价 B.多电子原子中,在离核较近的区域内运动的电子能量较高 C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 14、室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( ) A.溶液中导电粒子的数目减小 B.溶液中的不变 C.醋酸的电离程度增大,c(H+)亦增大 D.再加入10mLpH=11的NaOH溶液,混合液pH=7 15、以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( ) A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 C.电镀时保持电流恒定,升高温度不改变电解反应速率 D.镀锌层破损后即对铁制品失去保护作用 28.(14分)研究NO2、SO2.CO等大气污染气体的处理具有重要意义。 6 (1) NO2可用水吸收,相应的化学反应方程式为__________________ 利用反应6NO2+8NH37N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。 (2)已知:2SO2(g)+O2(g)2SO3(g) △H=-196.6kJ·mol-1 2NO(g)+O2(g)==2NO2(g) △H=-113.0 kJ·mol-1 则反应SO2(g)+NO2(g)= SO3(g)+ NO(g)的△H=________ kJ·mol-1 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________ A.体系压强保持不变 B.混合气体颜色保持不变 C.SO2和NO的体积比保持不变 D.每消耗1molSO3的同时生成1mol NO2 测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________ (3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。 29.(14分)科研、生产中常涉及钠、硫及其化合物。 (1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为__________。要清洗附着在试管壁上的硫,可用的试剂是__________。 (2)右图为钠硫高能电池的结构示意图,该电池的工作温度为320°C左右,电池反应为2Na+xS==NaSx ,正极的电极反应式为 。M(由NaO和AIO制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。 (3)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4.溶液pH (填“增大”“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示) 30.(14分)实验室以含有Ca2+、Mg2+、Cl-、SO、Br 6 等离子的卤水为主要原料制备无水CaCl和Br,流程如下: (1)操作I使用的试剂是 ,用主要仪器的名称是 。 (2)加入溶液W的目的是 ,用CaO调节溶液Y的pH,可以除去Mg。由表中数据可知,理论上可选择的pH最大范围是 。酸化溶液Z时,使用的试剂为 。 开始沉淀时的pH 沉淀完全时的pH Mg2+ 9.6 11.0 Ca2+ 12.2 c(OH-)=1.8 mol·L-1 (3)实验室用贝壳与稀盐酸反应制备并收集CO气体,下列装置中合理的是 。 a b c d (4)常温下,H2SO3的电离常数K=1.210,,K=6.310;H2CO3的电离常数K=4.5,K=4.7.某同学设计实验验证H2SO3酸性强于H2CO3;将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,H2SO3酸性强于H2CO3,该实验设计不正确,错误在于 。 设计合理试验验证H2SO3酸性强于H2CO3(简要说明试验步骤、现象和结论)。 。仪器自选。 供选择的试剂:CO2、SO2、Na2CO3、NaHCO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。 31.(8分)【化学——化学与技术】 水处理技术在生产、生活中应用广泛。 (1)含有较多_______离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为__________(写出一个即可) (2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过________(填“RH”或”ROH“)型离子交换树脂,原因是__________。 (3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为 。电渗析法净化水时,使离子通过半透膜的推动力是 。 (4)检验蒸馏水的纯度时,最简单易行的方法是测定水的_________。 32.(8分)【化学 ——物质结构与性质】 6 氧是底壳中含量最多的元素。 (1)氧元素基态原子核外未成对电子数为______个 。 (2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为_________。 的沸点比高,原因是_________。 (3)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_________。 (4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag.c,表示阿伏加罗常数,则CaO晶胞体积为_________c. 33.(8分)【化学—有机化学基础】 美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。 (x为卤原子,R为取代基) 经由Heck反应合成M(一种防晒剂)的路线如下: 回答下列问题: (1)M可发生的反应类型是________。 a.取代反应 b.酯化反应 c.缩聚反应 d.加成反应 (2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是__________。 (3)在AB的反应中,检验A是否反应完全的试剂是_______。 (4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为______。 2011高考理综山东卷化学部分参考答案 9、D 10、A 11、B 12、C 13、C 14、B 15、C 28、(1)3NO2+H2O=2HNO3+NO 6.72 6 (2)-41.8 B 2.67或 (3)< 在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,而生产成本增加,故得不偿失。 29、(1)2CH3CH2OH+2Na2CH3CH2ONa+H2↑ CS2(或热NaOH溶液) (2)xS+2e‾Sx2‾ (或2Na++xS+2e‾Na2Sx) 离子导电(导电或电解质) 隔离钠与硫 4.5 (3)c(Na+)>c(S2‾)>c(OH‾)>c(HS‾)>c(H+) 减小 2S2‾+2H2O+O2=2S↓+4OH‾ 30、(1)四氯化碳 分液漏斗 (2)除去溶液中的SO42‾ 11.0查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档