云南省昆明市东川区明月中学2018-2019学年高二下学期期中考试化学试题
2019年春季学期高二年级期中考试化学学科试题
相对原子质量:H:1 C:12 N:14 O:16
一、选择题(每个小题只有一个选项,每小题2分共50分)
1.化学与生活密切相关,下列有关说法错误的是
A. 硅胶可用作袋装食品的干燥剂
B. 液化石油气与天然气主要成分相同
C. 煤属于一次能源,电力属于二次能源
D. 甲醛是室内空气污染主要污染物之一
【答案】B
【解析】
A. 由于硅胶具有很好的吸附性,且无毒,可以用作袋装食品的干燥剂,故A正确;B. 液化石油气主要成分一般是碳原子数在4个以下的石油气,天然气主要成分是甲烷,两者主要成分不同,B错误;C. 煤属于能从自然界直接获取的能源,为一次能源;电力无法从自然界直接获取,必须通过一次能源的消耗才能得到,二次能源。所以C正确;D. 对甲醛的不当使用会对人体产生危害,而室内装修大量使用的人造板材中会散发甲醛,从而成为室内空气污染的主要污染物之一,D正确。故选择B
2.下列关于化学反应方向的说法正确的是
A. 凡是放热反应都是自发反应 B. 凡是熵增大的反应都是自发反应
C. 凡是吸热反应都不是自发反应 D. 反应是否自发,不只与反应热有关
【答案】D
【解析】
【分析】
判断化学反应进行方向:△G=△H-T△S<0的反应可以自发进行,△G=△H-T△S>0的反应不能自发进行。
【详解】A.判断反应的自发性不能只根据焓变,要用熵变和焓变的复合判据,A项错误;
B.判断反应的自发性不能只根据熵变,要用熵变和焓变的复合判据,B项错误;
C.由分析可知,吸热反应也有可能是自发反应,C项错误;
D.反应是否自发,不只与反应热有关,还与熵变有关,D项正确;
答案选D
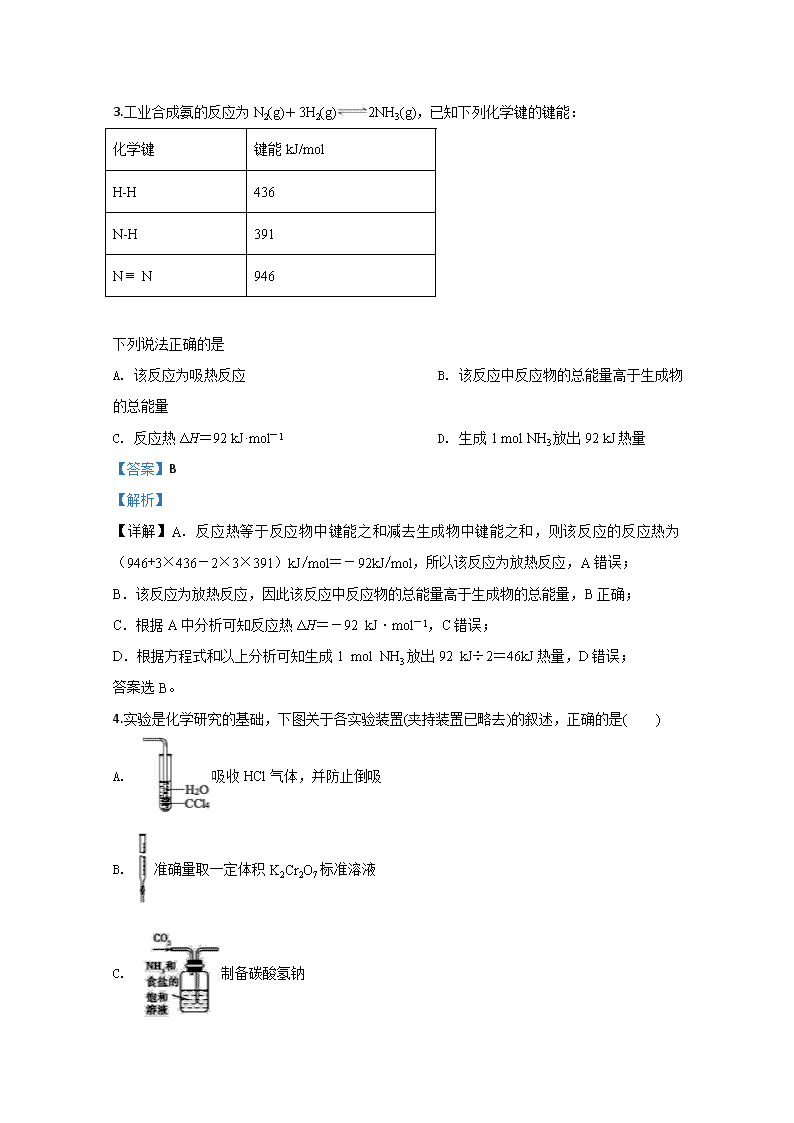
3.工业合成氨的反应为N2(g)+3H2(g)2NH3(g),已知下列化学键的键能:
化学键
键能kJ/mol
H-H
436
N-H
391
N N
946
下列说法正确的是
A. 该反应为吸热反应 B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1 D. 生成1 mol NH3放出92 kJ热量
【答案】B
【解析】
【详解】A. 反应热等于反应物中键能之和减去生成物中键能之和,则该反应的反应热为(946+3×436-2×3×391)kJ/mol=-92kJ/mol,所以该反应为放热反应,A错误;
B. 该反应为放热反应,因此该反应中反应物的总能量高于生成物的总能量,B正确;
C. 根据A中分析可知反应热ΔH=-92 kJ·mol-1,C错误;
D. 根据方程式和以上分析可知生成1 mol NH3放出92 kJ÷2=46kJ热量,D错误;
答案选B。
4.实验是化学研究的基础,下图关于各实验装置(夹持装置已略去)的叙述,正确的是( )
A. 吸收HCl气体,并防止倒吸
B. 准确量取一定体积K2Cr2O7标准溶液
C. 制备碳酸氢钠
D. 蒸干FeCl3溶液制备无水FeC13
【答案】A
【解析】
【详解】A项、HCl极易溶于水,不易溶于四氯化碳,将HCl通入四氯化碳中,隔绝与水的接触,四氯化碳有缓冲作用,能防止倒吸,故A正确;
B项、重铬酸钾具有强氧化性,能氧化橡胶而不能用碱式滴定管,应该用酸式滴定管,故B错误;
C项、二氧化碳气体应长导管进入,图中气体的进入方向不合理,故C错误;
D项、从FeCl3的溶液中获得无水FeCl3的操作方法是在不断通入HCl气流的条件下将FeCl3溶液蒸干可以获得无水FeCl3,用题给装置蒸干氯化铁溶液,氯化铁水解生成的氯化氢挥发会导致水解趋于完全,最后得到氢氧化铁,故D错误。
故选A。
【点睛】本题考查化学实验方案的评价,侧重分析与实验能力的考查,注意实验的评价性分析,把握实验装置的作用、物质的制备及性质实验、实验技能为解答的关键。
5.常温下,在下列溶液中一定能大量共存的离子组是
A. 含有0.1mol·L-1Fe2+的溶液:Na+、ClO-、SO42-、Cl-
B. 滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO42-、Cl-
C. 无色透明溶液:MnO4-、SO42-、K+、NO3-
D. 水电离产生的c(H+)=1×10-13mol·L-1的溶液:CO32-、NH4+、CI-、Ca2+
【答案】B
【解析】
【详解】A项、溶液中Fe2+与ClO-发生氧化还原反应和水解反应,不能大量共存,故A错误;
B项、滴加石蕊试剂呈红色的溶液是酸性溶液,溶液中离子之间不发生任何反应,可大量共存,故B正确;
C项、MnO4-在溶液中为紫色,无色溶液中不可能存在MnO4-,故C错误;
D项、溶液中CO32-与Ca2+反应生成碳酸钙沉淀,不能大量共存,故D错误。
故选B。
【点睛】本题考查离子共存问题,注意把握题给信息,明确离子的种类和性质为解答该题的关键。
6.下列反应的离子方程式不正确的是
A. 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B. 向NaHCO3溶液中加入稀HCl:HCO3-+H+=CO2↑+H2O
C. 向AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
【答案】C
【解析】
【分析】
A.反应生成硫酸钡和水;
B.反应生成氯化钠、水和二氧化碳;
C.反应生成氢氧化铝和氯化铵;
D.发生氧化还原反应,电子、电荷守恒。
【详解】A. 向Ba(OH)2溶液中滴加稀硫酸的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,所以A选项是正确的;
B. NaHCO3在溶液中电离出碳酸氢根离子,碳酸氢根离子不能拆开,故B正确;
C.氢氧化铝不溶于弱碱氨水中,正确的是Al3++3NH3·H2O= Al(OH)3↓+3NH4+,故C不正确;
D. 酸性介质中KMnO4氧化H2O2的离子反应为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,所以D选项是正确的。
故选C。
7.X、Y、Z、W是原子序数依次增大的短周期元素。X的氢化物常用于刻蚀玻璃,Y在同周期中金属性最强,Z的单质是人类将太阳能转化为电能的常用材料,W与X同主族。下列说法正确的是
A. 简单氢化物沸点:X>W
B. 简单离子半径:r(X)
0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
A. 图Ⅰ研究的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
【答案】B
【解析】
【分析】
A. 增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大;B.若加入催化剂,平衡不移动只加快化学反应速率;C.加入催化剂,平衡不移动。D.根据图三中乙先达到平衡可知,乙的温度更高。
【详解】A.增大氧气的浓度,平衡破坏的瞬间逆反应速率应不变,图中条件变化应为增大压强,A项错误;
B.图Ⅱ中正、逆反应速率同等程度的增大,化学平衡不移动,应为催化剂对反应速率的影响,
B项正确;
C.催化剂能同等程度改变正逆反应速率,但平衡不移动,图中条件变化应为温度对平衡的影响,C项错误;
D.图像Ⅲ中乙首先到达平衡状态,则乙的温度高于甲的温度,D项错误;
答案选B。
【点睛】增大氧气的浓度,平衡破坏的瞬间逆反应速率应不变,与改变温度和压强有区别。
20.在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
【答案】D
【解析】
【详解】进行到4min时,测得n (SO2)=0.4mol,此时反应的速率为v(SO2)==0.2mol/L•min;反应进行到前2min末时设二氧化硫物质的量为x,依据速率定义可得v′(SO2)=;进行到2min时的物质浓度大于4min时的物质的浓度,所以反应时4min的反应速率小于2min的反应速率,即v′(SO2)= >0.2mol/L•min;整理得,x<1.2mol,故选D。
21.常温下,下列说法正确的是
A. 稀释酸溶液,溶液中所有离子的浓度均减小
B. 用CH3COOH溶液做导电性实验,灯泡很暗,说明CH3COOH是弱电解质
C. 相同物质的量浓度的盐酸与醋酸分别稀释相同倍数,稀释后溶液pH:盐酸<醋酸
D. pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合,混合液呈碱性
【答案】C
【解析】
【分析】
【详解】A. 稀释酸溶液,溶液中氢氧根离子的浓度增大,A错误;
B. 用CH3COOH溶液做导电性实验,灯泡很暗,溶液中的导电性与离子的浓度有关,与强弱电解质无关,B错误;
C. 相同物质的量浓度的盐酸与醋酸中,氢离子浓度盐酸>醋酸,分别稀释相同倍数,稀释后氢离子浓度仍旧为盐酸>醋酸,则溶液pH:盐酸<醋酸,C正确;
D. pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合,醋酸为弱酸,则醋酸的物质的量大于氢氧化钠的,混合后酸过量,则混合液呈酸性,D错误;
答案为C。
【点睛】溶液中水的离子积为常数,酸溶液加水稀释,氢离子浓度减小,则氢氧根离子浓度增大。
22.下列说法正确的是
A. 向溶液中逐滴加入溶液至刚好沉淀完全,反应的离子方程式为
B. 25℃时,加水稀释,溶液中不断增大
C. 用浓盐酸分别和、反应制备氯气,转移的电子数均为(为阿伏加德罗常数的值)
D. 相同物质的量浓度的下列溶液中,①、②、③、④其由大到小的顺序是:①>②>③>④
【答案】D
【解析】
【详解】A. 酸式盐和碱反应,按照1:1反应,铵根离子会和氢氧根离子结合为氨水,Ba2++2OH-+NH4++H++SO42-=BaSO4↓+H2O+NH3•H2O,A项错误;
B. =,因NH4Cl的水解平衡常数只与温度有关,与各物质的浓度变化无关,B项错误;
C. MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,当生成1mol氯气,转移的电子数均为2NA,
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,当生成1mol氯气,转移的电子数均为NA,C项错误;
D. 前三溶液均为铵盐,c(NH4+)大于等浓度的一水合氨(弱酸)电离出的c(NH4+),NH4Cl溶液中NH4+部分水解,而NH4Al(SO4)2中NH4+及铝离子均水解呈酸性,抑制了NH4+的水解,CH3COONH4中的醋酸根离子水解呈碱性,促进NH4+的水解,故等浓度的四溶液中,c(NH4+)由大到小的顺序是:①>②>③>④,D项正确;
答案选D。
【点睛】本题的难点是C项,准确分析出KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中电子转移数是解题的突破口,要了解浓盐酸起着还原性与酸性作用。
23.在一定条件下,Na2CO3溶液中存在+H2O+OH-平衡。下列说法不正确的是( )
A. 加入NaOH固体,减小
B. 通入CO2,溶液pH减小
C. 升高温度,平衡常数增大
D. 稀释溶液,增大
【答案】D
【解析】
【详解】A.加入氢氧化钠固体,增加了溶液中OH-浓度,平衡逆向移动,CO32-浓度增加,HCO3-子浓度减小,所以减小,A项正确;
B.通入二氧化碳会使OH-浓度减小,所以溶液的pH也变小,B项正确;
C.升高温度时,水解平衡向吸热方向移动,所以水解平衡常数增大,C项正确;
D.所给的式子为水解平衡常数的表达式,而水解平衡常数只随温度的变化而变化,D项错误;
所以答案选择D项。
24.室温下,用0.100mol•L﹣1 NaOH溶液分别滴定20.00mL 0.100mol•L﹣1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
A. Ⅱ表示的是滴定醋酸的曲线
B. V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
C. pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
D. V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
【答案】C
【解析】
【详解】A. 0.100mol·L-1的HCl溶液和醋酸溶液,醋酸属于弱酸,存在电离平衡,所以起点pH较小的Ⅱ表示的是滴定盐酸的曲线,故A错误;
B. V(NaOH)= 20.00mL时,酸碱恰好完全反应,因为CH3COO-水解而消耗,所以两份溶液中c(Cl-)>c(CH3COO-),故B错误;
C. 当醋酸与氢氧化钠恰好完全反应时,形成醋酸钠溶液,醋酸钠水解使溶液pH>7,所以pH =7时,滴定醋酸消耗的V(NaOH)<20.00mL,故C正确;
D. V(NaOH)=10.00mL时,生成的醋酸钠与剩余醋酸浓度相等,由于醋酸的电离程度大于醋酸钠的水解程度,所以溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误。
故选C。
【点睛】本题考查酸碱中和滴定及盐类的水解,注意等物质的量浓度的醋酸与醋酸钠的混合溶液,醋酸的电离程度大于醋酸钠的水解程度。
25.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g) ⇌nY(g);ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
下列说法正确的是
A m>n B. Q<0
C. 温度不变,压强增大,Y的质量分数减少 D. 体积不变,温度升高,平衡向逆反应方向移动
【答案】C
【解析】
【详解】A. 容器的体积可变,说明该容器为恒压装置;在温度相同的条件下,气体体积扩大到原来的两倍时,Y的浓度本该降低为0.5mol·L-1,但实际上为0.75 mol·L-1,说明平衡正向移动,由于是恒压,气体体积增大,根据阿伏加德罗定律,平衡正向移动,说明正反应方向是气体物质的量增多的方向,即m0,B错误;
C. 温度不变,压强增大,平衡向气体体积减小的方向移动,由于m”、“=”或“<”),溶液中的离子浓度由大到小的顺序为____________
(3)在常温下,将100mL的②与100mL的⑥溶液混合后(假设混合后溶液的体积为混合前溶液的体积之和),溶液的pH=____________(已知)
(4)在常温下,六种液体的pH由大到小的顺序是____________
(5)若将③溶液和⑥溶液按体积比2:1混合后溶液呈酸性,则混合后溶液中 __________ (填“>”、“=”或“<”)
(6)常温下将③溶液加水稀释过程中,下列表达式的数据一定变大的是______
A、 B、 C、 D、
【答案】 (1). c(NH4+)>c(SO42-)>c(H+)>c(OH-) (2). > (3). c(Na+)=c(CH3COO-)>c(H+)=c(OH-) (4). 3.3 (5). ⑥>⑤>④>③>①>② (6). > (7). B D
【解析】
【详解】(1)④为(NH4)2SO4,水解溶液呈酸性,但水解是微弱的,不会达到50%
,溶液中c()>c(),c(H+)>c(OH−),所以离子浓度大小为:c()>c()>c(H+)>c(OH−),
故答案为:c()>c()>c(H+)>c(OH−);
(2)③为CH3COOH,⑥为NaOH,若恰好反应生成CH3COONa,CH3COONa水解溶液为碱性,为使溶液呈纵中性需要稍过量的CH3COOH,所以消耗量溶液的体积为③>⑥,溶液为中性,c(H+)=c(OH−),根据电荷守恒:c(Na+)+c(H+)=c(OH−)+c(CH3COO−),所以c(Na+)=c(CH3COO−),则溶液中离子浓度大小关系为:c(Na+)=c(CH3COO−)>c(H+)=c(OH−),
故答案为:>;c(Na+)=c(CH3COO−)>c(H+)=c(OH−);
(3)常温下,将100mL的②与100mL的⑥溶液混合,发生反应:H2SO4+2NaOH═Na2SO4+2H2O,等体积等浓度反应,酸过量,则反应后溶液中c(H+)=
mol/L=5×10−4mol/L,则溶液pH=−lgc(H+)=3.3,
故答案:3.3;
(4)硫酸为二元酸,同浓度的条件下,硫酸酸性强于盐酸,醋酸为弱电解质,酸性弱于盐酸,硫酸铵水解为酸性,酸性更弱,氨水为弱碱,氢氧化钠为强碱,酸性越弱,pH值越大,所以五种液体的pH由大到小的顺序是:⑥>⑤>④>③>①>②,
故答案为:⑥>⑤>④>③>①>②;
(5)将③溶液和⑥溶液按体积比2:1混合后溶液呈酸性,相当于等量的CH3COOH和CH3COONa的条件下溶液为酸性,则醋酸的电离程度大于水解程度,则混合后溶液中c(CH3COO−)>c(CH3COOH),
故答案为:>;
(6)A.稀释过程中,n(H+)增大,但溶液体积增加更大,整体来说c(H+)减小,故A不选;
B.稀释过程中c(H+)减小,则c(OH−)= 增大,故B选;
C.Kw= 只随温度改变而改变,故C不选;
D.= ,稀释过程中c(H+)减小,则增大,故D选,
故答案为:BD。
【点睛】
考查弱电解质的电离、弱碱阳离子的水解、中和滴定、溶液中离子浓度大小比较、水的电离及pH计算、电离平衡常数计算等重要知识点,难度中等,侧重弱电解质原理的考查,关键是理解原理、灵活运用原理,把好基础关
28.大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃
400
500
830
1 000
平衡常数K
10
9
1
0.6
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) 2CO2(g) ΔH=−566.0 kJ·mol−1
②N2(g)+O2(g) 2NO(g) ΔH=+180.0 kJ·mol−1
③2NO(g)+O2(g) 2NO2(g) ΔH=−116.5 kJ·mol−1
回答下列问题:
①CO的燃烧热为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为 ____________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A.2υ正(NO2)=υ逆(N2)
B. 混合气体的平均相对分子质量保持不变
C.气体总压强不再变化
D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___mol⋅L−1⋅min−1。
③25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
A.缩小容器体积
B.增加NO2的浓度
C.降低温度
D.升高温度
【答案】 (1). 放 (2). 50% (3). 283kJ/mol (4). 631.75 (5). 2NO2(g)+4CO(g)=N2(g)+4CO2(g) ΔH= -1196kJ/mol (6). BC (7). 0.032 (8). D
【解析】
【分析】
(1)①由表中数据可知,升高温度,K变小,说明反应逆向进行,即正反应为放热反应;
②在830 ℃下,K=1,故可利用K和三段式计算CO的转化率;
(2) ①根据燃烧热的概念判断,反应热与键能的关系计算;
②根据盖斯定律计算此反应的反应热,写出热化学方程式;
(3)①可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
②前5min 内N2变化浓度为0.04mol/L,根据平均反应速率公式计算CO的平均反应速率;
③根据反应的特点,浓度、压强、温度对化学平衡的影响分析解答。
【详解】(1)①由表中数据可知,升高温度,K变小,说明反应逆向进行,即正反应为放热反应;
②在830 ℃下,K=1,设转化CO物质的量为x
CO(g)+H2O(g) H2(g)+CO2(g)
起始(mol) 1 1 0 0
转化(mol) x x x x
平衡(mol) 1-x 1-x x x
平衡常数K===1,解得,x=0.5,即CO转化率为100%=50%;
因此,本题正确答案是:放;50%;
(2) ①已知2CO(g)+O2(g) 2CO2(g) ΔH=−566.0 kJ·mol−1,可以知道1molCO完全燃烧生成1molCO2时释放的能量为=283kJ,则CO的燃烧热为283kJ/mol;
由反应②可知,1molN2(g)和1molO2反应生成2molNO(g)吸收180.0 kJ热量,根据反应热与键能的关系可得946 kJ·mol−1+498 kJ·mol−1-2E(氮氧键)= 180.0 kJ·mol−1,则有E(氮氧键)= 631.75 kJ·mol−1;
②CO将NO2还原为单质的化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO2(g),结合反应:
①2CO(g)+O2(g) 2CO2(g) ΔH=−566.0 kJ·mol−1
②N2(g)+O2(g) 2NO(g) ΔH=+180.0 kJ·mol−1
③2NO(g)+O2(g) 2NO2(g) ΔH=−116.5 kJ·mol−1
根据盖斯定律可以知道,①2-②-③可得: 2NO2(g)+4CO(g)=N2(g)+4CO2(g),则ΔH =(−566.0 kJ·mol−1)2-(+180.0 kJ·mol−1)-(−116.5 kJ·mol−1),则CO将NO2还原为单质的热化学方程式为:2NO2(g)+4CO(g)=N2(g)+4CO2(g) ΔH= -1196kJ/mol,
因此,本题正确答案是:283kJ/mol ;631.75 ;2NO2(g)+4CO(g)=N2(g)+4CO2(g) ΔH= -1196kJ/mol;
(3)①A. 反应2NO2(g)+4CO(g) ⇌N2(g)+4CO2(g)中,若2υ正(NO2)=υ逆(N2),说明正反应速率和逆反应速率不相等,不能说明反应达到平衡状态;
B. 混合气体的质量始终不变,气体的总物质的量不确定,则混合气体的相对分子质量为变量,当容器内混合气体的平均相对分子质量保持不变时,说明反应达到平衡状态;
C. 在恒温、恒容条件下,反应2NO2(g)+4CO(g) ⇌N2(g)+4CO2(g)进行过程中气体总物质的量不断变化,压强也在变化,当容器内混合气体的压强保持不变,说明达到平衡状态;
D. 反应热大小只与起始和终止状态有关,ΔH保持不变,不能说明反应达到平衡状态;
E.混合气体的质量和体积始终不变,则容器内混合气体的密度保持不变,混合气体的密度不再变化不能说明反应达到平衡状态。
因此,本题正确答案是:BC;
②2NO2(g)+4CO(g)=N2(g)+4CO2(g),从反应开始到5min,生成了0.08mol N2,
则5min内υ(CO)==0.032mol⋅L−1⋅min−1;
因此,本题正确答案是:0.032;
③由图像可知,25min时,改变条件的瞬间NO2和N2的浓度都不变,改变条件后,NO2浓度增大,N2浓度减小,说明平衡逆向移动,故改变的条件应该是升高温度,选D,
因此,本题正确答案是:D。
29.高分子化合物G的一种合成路线如下:
已知:①+RCHO;
②D溶液显酸性
③浓硫酸能与酚类物质发生取代反应,在苯环上引入-SO2H
回答下列问题:
(1)E分子中的含氧官能团名称为__。
(2)下列关于化合物B的说法不正确的是__(填标号)。
①苯环上一氯代物有2种
②分子式为C8H10O2
③既能与FeCl3溶液发生显色反应又能与溴水发生加成反应
④1mol化合物B与足量金属钠反应生成标准状况下氢气22.4L
(3)A→B的反应类型是__,D→E的目的是__,A的化学名称为__。
(4)写出F→G的化学方程式__。
(5)某烃的含氧衍生物X符合下列条件的同分异构体有种__(不含立体异构)。
①氧原子数与B相同但相对分子质量比B少36
②能发生水解反应
其中核磁共振氢谱只有2组峰的是__(写结构简式)
(6)写出用苯酚、为原料(其他无机试剂任选)制备化合物
的合成路线。__。
【答案】 (1). 羟基、醚键 (2). ③ (3). 加成反应 (4). 保护酚羟基 (5). 乙醛 (6). n+(n-1)H2O (7). 9 (8). HCOOC(CH3)3 (9).
【解析】
【分析】
根据已知①信息,可判断A为乙醛;B为;B发生消去反应,生成C;C与水发生加成反应生成D,D为;D与CH3I发生取代反应生成E;E发生氧化反应,醇羟基被氧化为羧基,再与HI反应,醚基变为酚羟基和CH3I,即生成F;F含有羧基、酚羟基,G为高分子化合物,则F进行分子间脱水,发生缩聚反应生成G。
【详解】(1)根据E的结构简式,含有的官能团为醚基、醇羟基;
(2)分析可知,B的结构简式为,
①B的苯环只有对位上有取代基,故其苯环上的一氯代物有2种,①正确;
②分子式为C8H10O2,②正确;
③含有酚羟基能与FeCl3溶液发生显色反应,能与溴水发生取代反应,不能发生加成反应,③不正确;
④B中的酚羟基、醇羟基,均可与Na发生反应,则1mol化合物B与足量金属钠反应生成1mol氢气,即标准状况下22.4L,④正确;
答案为③;
(3)A为乙醛,生成B为加成反应;已知酚类物质易被氧化,而生成F需氧化醇羟基,则D→E
的目的是保护酚羟基不被氧化;分析可知,A为乙醛;
(4)F进行分子间脱水,发生缩聚反应生成G,方程式为n+(n-1)H2O;
(5)B分子式为C8H10O2,①氧原子数与B相同但相对分子质量比B少36,则只能是少3个C,即分子式为C5H10O2;②能发生水解反应,含有酯基,同分异构体中HCOOC4H9,有4种;CH3COOC3H7,有2种;CH3CH2COOC2H5,有1种;C3H7COOCH3,有2种;合计9种;核磁共振氢谱只有2组峰,则为对称结构,即含有3个相同位置的甲基,结构简式为HCOOC(CH3)3;
(6)根据题干信息,先被氧化为醛基,即可生成,再发生消去反应即可,流程为。
【点睛】氧原子数与B相同但相对分子质量比B少36,其中B只含有10个H原子,不可能是少2个C、12个H,则只能是少3个C。