2021版高考化学一轮复习核心素养微专题5化学反应速率和平衡图象的分析练习含解析鲁科版
- 1 -
化学反应速率和平衡图象的分析
化学反应速率平衡图象的基本类型
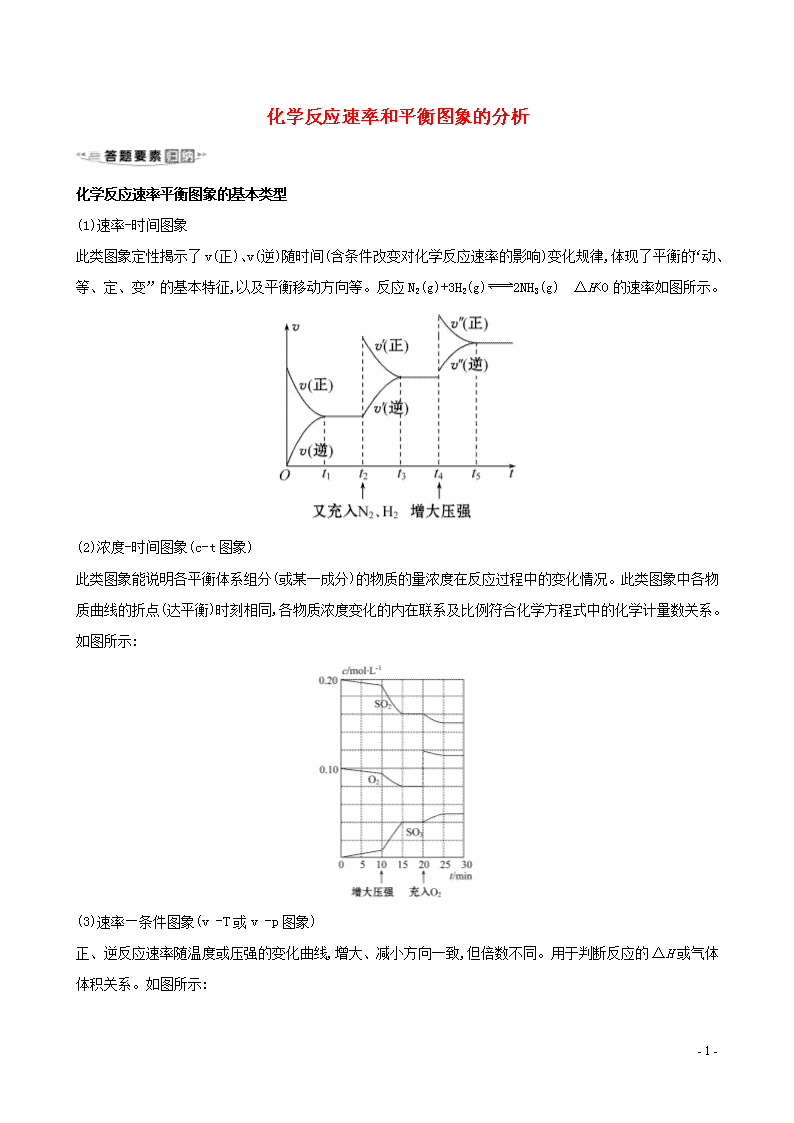
(1)速率-时间图象
此类图象定性揭示了 v(正)、v(逆)随时间(含条件改变对化学反应速率的影响)变化规律,体现了平衡的
“动、等、定、变”的基本特征,以及平衡移动方向等。反应 N2(g)+3H2(g) 2NH3(g) ΔH<0 的速率如图
所示。
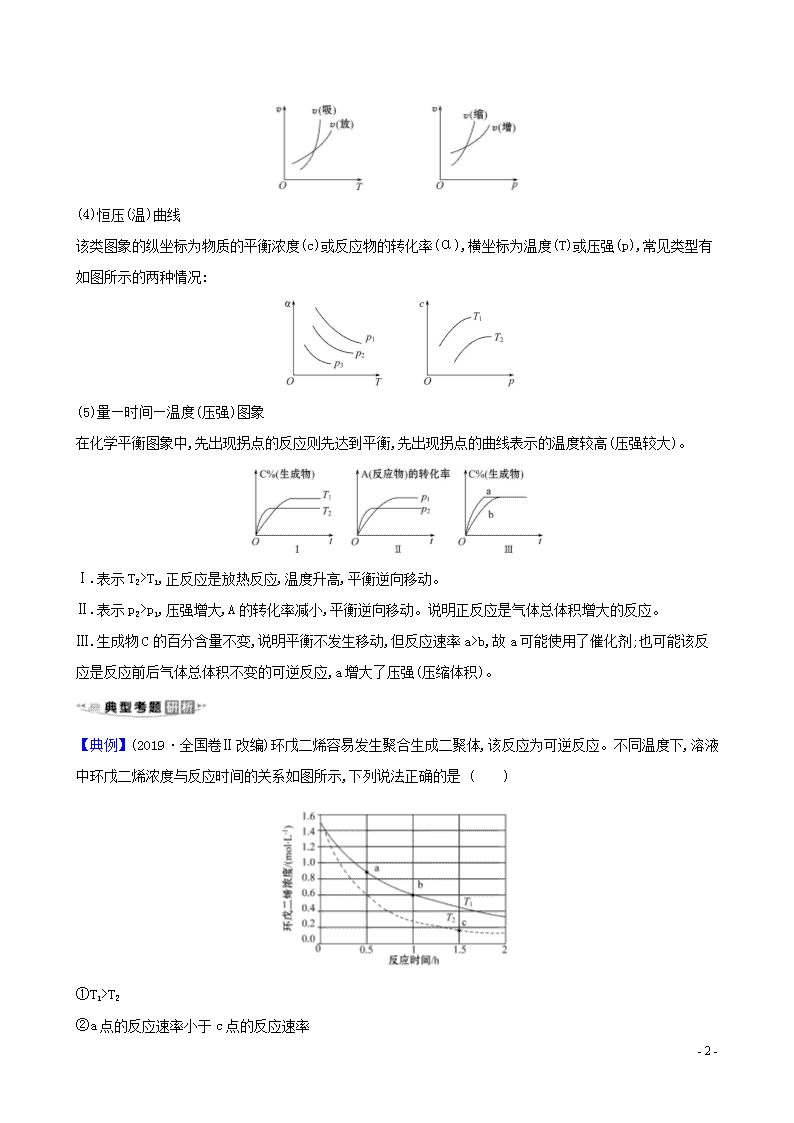
(2)浓度-时间图象(c-t 图象)
此类图象能说明各平衡体系组分(或某一成分)的物质的量浓度在反应过程中的变化情况。此类图象中各物
质曲线的折点(达平衡)时刻相同,各物质浓度变化的内在联系及比例符合化学方程式中的化学计量数关
系。如图所示:
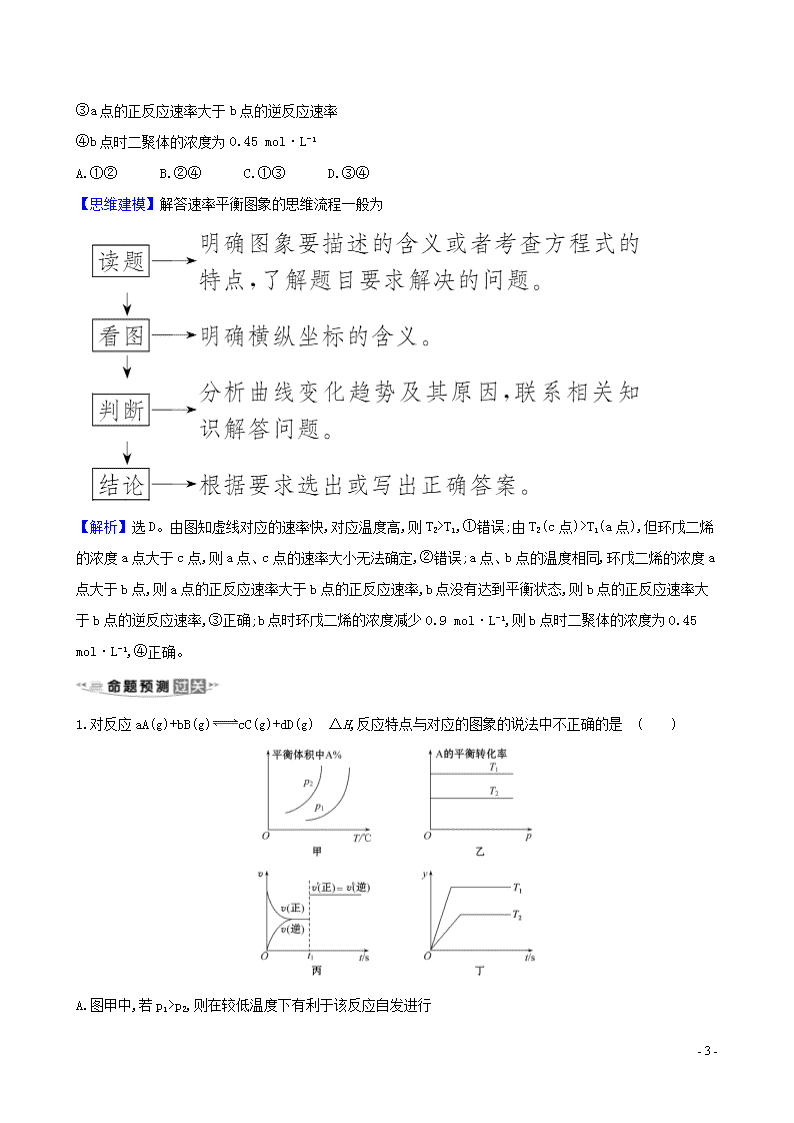
(3)速率—条件图象(v -T 或 v -p 图象)
正、逆反应速率随温度或压强的变化曲线,增大、减小方向一致,但倍数不同。用于判断反应的ΔH 或气体
体积关系。如图所示:
- 2 -
(4)恒压(温)曲线
该类图象的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横坐标为温度(T)或压强(p),常见类型有
如图所示的两种情况:
(5)量—时间—温度(压强)图象
在化学平衡图象中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(压强较大)。
Ⅰ.表示 T2>T1,正反应是放热反应,温度升高,平衡逆向移动。
Ⅱ.表示 p2>p1,压强增大,A 的转化率减小,平衡逆向移动。说明正反应是气体总体积增大的反应。
Ⅲ.生成物 C 的百分含量不变,说明平衡不发生移动,但反应速率 a>b,故 a 可能使用了催化剂;也可能该反应
是反应前后气体总体积不变的可逆反应,a 增大了压强(压缩体积)。
【典例】(2019·全国卷Ⅱ改编)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液
中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是 ( )
①T1>T2
②a 点的反应速率小于 c 点的反应速率
- 3 -
③a 点的正反应速率大于 b 点的逆反应速率
④b 点时二聚体的浓度为 0.45 mol·L-1
A.①② B.②④ C.①③ D.③④
【思维建模】解答速率平衡图象的思维流程一般为
【解析】选 D。由图知虚线对应的速率快,对应温度高,则 T2>T1,①错误;由 T2(c 点)>T1(a 点),但环戊二烯的
浓度 a 点大于 c 点,则 a 点、c 点的速率大小无法确定,②错误;a 点、b 点的温度相同,环戊二烯的浓度 a 点
大于 b 点,则 a 点的正反应速率大于 b 点的正反应速率,b 点没有达到平衡状态,则 b 点的正反应速率大于 b
点的逆反应速率,③正确;b 点时环戊二烯的浓度减少 0.9 mol·L-1,则 b 点时二聚体的浓度为 0.45 mol·L-1,④
正确。
1.对反应 aA(g)+bB(g) cC(g)+dD(g) ΔH,反应特点与对应的图象的说法中不正确的是 ( )
A.图甲中,若 p1>p2,则在较低温度下有利于该反应自发进行
- 4 -
B.图乙中,若 T2>T1,则ΔH<0 且 a+b=c+d
C.图丙中,t1 时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
【解析】选 C。图甲中压强一定时,温度越高,平衡体系中 A%越大,说明升高温度,平衡逆向移动,则有ΔH<0;
若p1>p2,温度一定时,压强越大,平衡体系中A%越小,则有a+b>c+d,ΔS<0;若使ΔH-TΔS<0,则在较低温度下
有利于该反应自发进行,A 正确。图乙中温度一定时,增大压强,A 的平衡转化率不变,则有 a+b=c+d;压强一
定时,若 T2>T1,温度越高,A 的平衡转化率越小,说明升高温度,平衡逆向移动,则有ΔH<0,B 正确。图丙中 t1
时刻,改变条件后 v(正)、v(逆)同等程度地改变,平衡不移动,则改变的条件可能是使用了催化剂,若
a+b=c+d 改变的条件也可能是增大了压强,C 错误。图丁中温度为 T1 时先达到平衡状态,则温度:T1>T2,若
ΔH<0,升高温度,平衡逆向移动,反应物的转化率降低,故纵坐标不可能表示的是反应物的转化率,D 正确。
2.合成乙烯的主要反应:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) ΔH<0。图中 L(L1、L2)、x 可分别代表压
强或温度。下列说法正确的是 ( )
A.L1
L2,选项 A 错误;x 代表温度,选项 B 错误;M、N 对应温度不同,所以两点对
应的平衡常数不相同,选项 C 错误;温度越高反应速率越快,所以 M 点的正反应速率 v(正)小于 N 点的逆反应
速率 v(逆),选项 D 正确。
3.有Ⅰ~Ⅳ四个体积均为 0.5 L 的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入 HCl 和 O2(如下表),
加入催化剂发生反应 4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(t)的关
系如图所示。下列说法正确的是 ( )
- 5 -
容器
起始时
t/℃ n(HCl)/mol Z
Ⅰ 300 0.25 a
Ⅱ 300 0.25 b
Ⅲ 300 0.25 4
A.ΔH>0,a<4v(逆),压强:p(R)>p(Q)
D.若起始时,在容器Ⅳ中充入 0.25 mol Cl2 和 0.25 mol H2O(g),300 ℃达平衡时容器中 c(HCl)=0.1 mol·L-1
【解析】选 C。图象中 HCl 转化率随温度升高而减小,说明升温平衡逆向移动,正反应为放热反应,ΔH<0,
增大氧气的物质的量,可促进 HCl 的转化,即投料比越小,HCl 转化率越大,可知 a<4v(逆),此时压
- 6 -
强大于平衡状态下的压强:p(R)>p(Q),故 C 正确;若起始时,在 0.5 L 容器Ⅳ中只充入 0.25 mol Cl2 和 0.25
mol H2O(g),等效于在 0.5 L 容器中充入 0.5 mol HCl 和 0.125 mol O2,充入的 HCl 和 O2 物质的量为容器Ⅲ
的两倍,相当于在容器Ⅲ的基础上增大压强,将体积缩小为原来的 ,增大压强平衡正向移动,300 ℃达到平
衡时 0.1 mol·L-1
”或“<”)。
348 K 时,以物质的量分数表示的化学平衡常数 Kx=______(保留 2 位有效数字)。
在曲线①、②、③中,k 正-k 逆值最大的曲线是________;A、B、C、D 四点中,v 正最大的是________,v 逆最大
的是_________________________________。
(2)343 K 时,己醇和乙酸甲酯按物质的量之比 1∶1、1∶2 和 2∶1 进行初始投料。则达到平衡后,初始投料
比为_____________________时,乙酸甲酯转化率最大;与按 1∶2 投料相比,按 2∶1 投料时化学平衡常数
Kx________(填“增大”“减小”或“不变”)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是________。
a.参与了醇解反应,但并不改变反应历程
b.使 k 正和 k 逆增大相同倍数
c.降低了醇解反应的活化能
d.提高乙酸甲酯的平衡转化率
- 7 -
【解析】(1)根据图象,①的速率最快,说明①对应的是最高温度 348 K,温度升高,平衡时转化率增大,说明
正向是吸热的,所以ΔH>0。348 K 时,设初始投入为
1 mol,则有:
CH3COOCH3(l)+C6H13OH(l) CH3COOC6H13(l)+CH3OH(l)
起始: 1 1 0 0
转化: 0.64 0.64 0.64 0.64
平衡: 0.36 0.36 0.64 0.64
代入平衡常数表达式:Kx=x(CH3COOC6H13)·x(CH3OH)/[x(CH3COOCH3)·x(C6H13OH)]=0.32×0.32/(0.18×0.18)
≈3.2
k 正、k 逆是温度的函数,根据平衡移动的规律,k 正受温度影响更大,因此温度升高,k 正增大的程度大于 k 逆,因
此,k 正-k 逆值最大的曲线是①。根据
v 正=k 正 x(CH3COOCH3)·x(C6H13OH),v 逆=k 逆
x(CH3COOC6H13)·x(CH3OH),A 点 x(CH3COOCH3)·x(C6H13OH)大,温度高,因此 A 点
v 正最大,C 点
x(CH3COOC6H13)·x(CH3OH)大且温度高,因此 C 点 v 逆最大。
(2)增大己醇的投入量,可以增大乙酸甲酯转化率,因此,2∶1 时乙酸甲酯转化率最大。化学平衡常数 Kx 只与
温度有关,因此不变。
(3)催化剂参与了醇解反应,改变了反应历程,a 错误;催化剂不影响化学平衡,说明催化剂使 k 正和 k 逆增大相
同倍数,b 正确;催化剂能够降低反应的活化能,c 正确;催化剂不改变化学平衡,d 错误。
答案:(1)> 3.2 ① A C
(2)2∶1 不变 (3)bc
【加固训练】
1.(2020·郑州模拟)在容积为 2 L 的三个恒容密闭容器中均加入 0.10 mol·L-1 的 N2 和 0.26 mol·L-1 的 H2,
进行合成氨反应:N2(g)+3H2(g) 2NH3(g)
ΔH=-92.4 kJ·mol-1。图 1 表示各容器的温度分别为 T1、T2、T3 且恒定不变,达到平衡时 NH3 的质量分数;
图 2 则表示不同反应条件下 N2 的浓度随时间的变化。
- 8 -
下列判断不正确的是 ( )
A.图 1 中 T1”“<”或“=”)0,理由是__ 。
②温度为 T1 时,0~10 min 内 NO2 的平均反应速率 v(NO2)=______________________。
③该反应达到平衡后,为在提高反应速率的同时提高 NO2 的转化率,可采取的措施有________(填标号)。
A.改用高效催化剂
B.升高温度
C.缩小容器的体积
D.增加 CH4 的浓度
【解析】①先达到平衡说明反应速率快,即 T2>T1,随着温度的升高,甲烷的物质的量增加,说明升高温度,平
衡向逆反应方向移动,即正反应方向ΔH<0;
②前 10 min,消耗甲烷的物质的量为(0.4-0.3)mol=0.1 mol,即消耗 NO2 的物质的量为 2×0.1 mol=0.2 mol,
根据化学反应速率的表达式,v(NO2)= ;③使用催化剂,只加快反应速率,对化学平衡无影
响,A 错误;正反应方向是放热反应,升高温度平衡向逆反应方向移动,NO2 的转化率降低,但化学反应速率加
- 10 -
快,B 错误;缩小容器的体积,相当于增大压强,平衡向逆反应方向进行,NO2 的转化率降低,但反应速率加
快,C 错误;增加 CH4 的浓度,平衡向正反应方向移动,NO2 的转化率增大,化学反应速率加快,D 正确。
答案:①< T1
查看更多