- 2021-05-12 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省叙州二中2019-2020学年高二下学期期末模拟考试
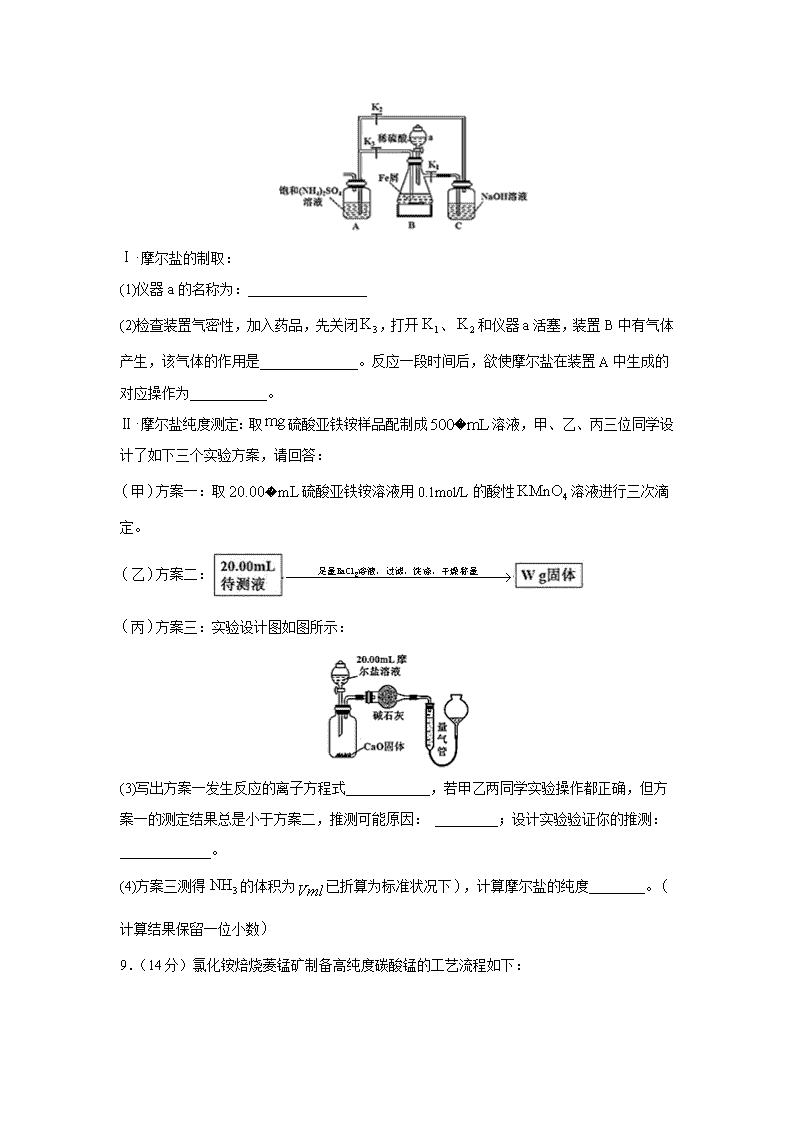
四川省叙州二中2019-2020学年高二下学期期末模拟考试 注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。2.答题时请按要求用笔。 3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。 6.考试时间:150分钟;物理化学生物同堂分卷考试,物理110分,化学100分,生物90分,共300分 7.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 23 P 31 S 32 Fe 56 Cu 64 第I卷 选择题(42分) 一、单选题(每小题6分,共7个小题,共42分) 1.化学与生产、生活和环境密切相关。下列有关说法正确的是 A.面粉生产中禁止添加的过氧化钙(CaO2)中阴、阳离子个数比为1:2 B.“文房四宝”中的砚台,用石材磨制的过程是化学变化 C.月饼中的油脂易被氧化,保存时常放入装有硅胶的透气袋 D.丝绸的主要成分是蛋白质,它属于天然高分子化合物 2.设NA表示阿佛加德罗常数,下列说法正确的是 A.1mol CaC2中有3NA个离子 B.1mol SiO2中含有2NA个共价键 C.1L 1mol/L CH3COONa溶液中含NA个CH3COO—离子 D.42g C2H4和C3H6的混合物中一定含有6NA个氢原子 3.NA代表阿伏加德罗常数的值,下列有关叙述正确的是 A.标准状况下,铁在22.4L氯气中完全燃烧时转移电子数为3NA B.1 L 0.1 mol·L−1的NaHCO3溶液中HCO3−和CO32-离子数之和为0.1NA C.常温常压下,NO2与N2O4的混合气体46g,所含氧原子数为2NA D.含有NA个Fe(OH)3胶粒的氢氧化铁胶体中,铁元素的质量为56g 4.已知短周期元素的离子都具有相同的电子层结构,则下列叙述正确的是A.原子半径A>B>D>C B.原子序数d>c>b>a C.离子半径C>D>B>A D.单质的还原性A>B>D>C 5.下列关于同分异构体判断正确的是 A.分子式为C8H10的芳香烃有3个,分别为 B.C4H10进行一氯取代后生成两种沸点不同的产物 C.C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3 D.甲苯在一定条件下与氢气加成产物的一氯代物的同分异构体有5种 6.半导体光催化CO2机理如图甲所示,设计成电化学装置如图乙所示,则下列说法正确的是 A.若导线上有4mol电子移动,则质子交换膜左侧产生22.4 L O2 B.装置中进行的总反应一定是自发的氧化还原反应 C.b极上的电极反应为:CO2+6H+-6e-=CH3OH+H2O D.图乙中的能量转化形式为:光能→电能→化学能 7.水的电离平衡曲线如图所示。下列说法正确的是 A.温度:a>b>c B.仅升高温度,可从a点变为c点 C.水的离子积常数Kw:b>c>d D.b点对应温度下,0.5 mol/L H2SO4溶液与1mol/L KOH溶液等体积混合,充分反应后,所得溶液中c(H+) = 1.0×10-7 mol • L-1 第II卷 非选择题(58分) 8.(14分)硫酸亚铁铵又称摩尔盐,某实验小组利用如图装置制取摩尔盐并测其纯度。 Ⅰ摩尔盐的制取: (1)仪器a的名称为:_________________ (2)检查装置气密性,加入药品,先关闭,打开、和仪器a活塞,装置B中有气体产生,该气体的作用是______________。反应一段时间后,欲使摩尔盐在装置A中生成的对应操作为___________。 Ⅱ摩尔盐纯度测定:取硫酸亚铁铵样品配制成溶液,甲、乙、丙三位同学设计了如下三个实验方案,请回答: 甲方案一:取硫酸亚铁铵溶液用0.1mol/L的酸性溶液进行三次滴定。 乙方案二: 丙方案三:实验设计图如图所示: (3)写出方案一发生反应的离子方程式____________,若甲乙两同学实验操作都正确,但方案一的测定结果总是小于方案二,推测可能原因: _________;设计实验验证你的推测:_____________。 (4)方案三测得的体积为已折算为标准状况下,计算摩尔盐的纯度________。计算结果保留一位小数 9.(14分)氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下: 已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。 ②相关金属离子[c0(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下: 金属离子 Al3+ Fe3+ Fe2+ Ca2+ Mn2+ Mg2+ 开始沉淀的pH 3.8 1.5 6.3 10.6 8.8 9.6 沉淀完全的pH 5.2 2.8 8.3 12.6 10.8 11.6 ③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。 回答下列问题: (1)“焙烧”时发生的主要反应的化学方程式为________。分析下列图1,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为500 ℃。分析选择反应温度为500 ℃的原因_____________。 (2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_______;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为________;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中=________。 (3)碳化结晶时,反应的离子方程式为_____________。 (4)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示,300 ℃~770 ℃范围内,发生反应的化学方程式为__________________________。 10.(15分)氨气是一种重要的化工产品,有广泛用途,工业上可以由氢气和氮气合成。 (1)已知键能:NN 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。 ①氮气、氢气合成氨的热化学方程式是______________。 ②未使用催化剂时,逆反应的活化能Ea(逆)=______ kJ·mol-1;使用催化剂之后正反应的总活化能为_______ kJ·mol-1。 (2)下表是当反应器中按n(N2):n(H2)=l:3投料后,在200℃、400℃、600℃,反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。 ①曲线a、b对应温度较高的是________ (填“a”或“b”) ②实验室模拟工业合成氨,一定温度和压强下在1L密闭容器中通入5 mol N2、15molH2,10min 后达到M点平衡状态,计算从反应开始至平衡时间段内的平均速率V(N2)___mol·L-1·min-1。 ③关于工业合成氨的反应,下列叙述正确的是_______(填字母)。 A.分离出NH3后的原料气循环利用,可以提高H2的平衡转化率 B.使州催化剂能加快反应速率且提高H2的平衡转化率 C.上图中M、Q、R点平衡常数K的大小关系是K(M)= K(Q)> K(R) ④列出R点平衡常数的计算式Kp=____(MPa)-2。(用平衡分压代替平衡浓度计箅,分压=总压×物质的量分数。不要求计算结果) 11-12题题选一题做答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做的第一题计分。 11.(15分)教材插图具有简洁而又内涵丰富的特点。请回答以下问题: (1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有___种不同运动状态的电子。 (2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___。 (3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于___晶体。 (4)第一电离能介于Al、P之间的第三周期元素有___种。GaCl3原子的杂化方式为___。 (5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有___个紧邻分子。D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是___(填字母标号)。 a.极性键 b.非极性键 c.配位键 d.金属键 12.(15分)高分子聚合物P的合成路线如下: (1)写出反应所需试剂与条件。反应①________;反应⑦ ________。 (2)写出反应类型。反应③________;反应⑥________。 (3)写出结构简式。E________________;P ________________。 (4)设计反应⑥⑦的目的是______________。 (5)写出符合下列要求的G的同分异构体的结构简式(不考虑立体结构)。_______________ Ⅰ.能发生银镜反应 Ⅱ.只含两种化学环境不同的氢原子 Ⅲ.不含-O-O-结构 (6)写出用A的一种同分异构体为原料合成的合成路线(无机原料任选).________(合成路线的常用表示方法为:AB... 目标产物) 参考答案 1. D 2.D 3.C 4.C 5.D 6.D 7.C 8.分液漏斗 排除装置A中的氧气,避免氧化 打开,关闭和 摩尔盐中被空气部分氧化 取少量硫酸亚铁铵溶液于试管中,加入少量KSCN溶液,若溶液变为血红色,说明已被空气部分氧化 9.MnCO3+2NH4ClMnCl2+2NH3↑+CO2↑+H2O 温度低,速率慢浸出率低;温度过高,浸出率变化不大,成本增加 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 5.2≤pH<8.8 1.97 Mn2++2HCO3-MnCO3↓+CO2↑+H2O 3MnO2Mn3O4+O2↑ 10. N2(g) + 3H2(g) 2NH3(g) ΔH= -93 kJ·mol-1 428 126 b 0.375 AC (其它合理答案都给分) 11.12 SiH4 原子 3 sp2杂化 12 abc 12.氯气、光照 氢氧化钠醇溶液、加热 消去反应 加成反应 HOCH2CH=CHCH2OH 保护碳碳双键,防止被氧化 查看更多