- 2021-05-12 发布 |
- 37.5 KB |
- 51页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017届二轮复习无机化工流程专题练习课件(共51张)(全国通用)
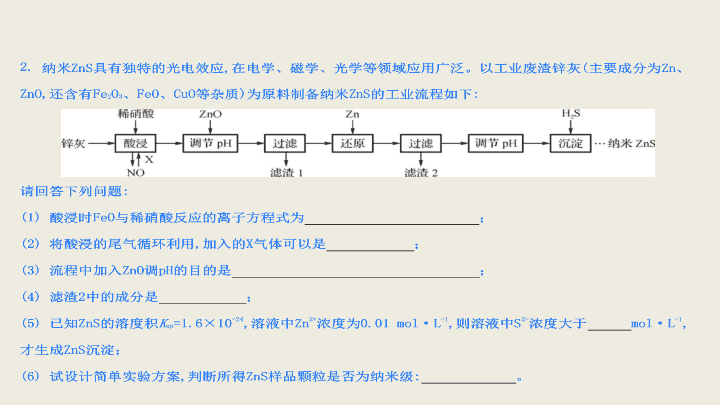
2017 届高考化学二轮总复习 无机化工流程专题练习 B 1. 下列有关金属及其合金的说法不正确的是 ( ) A .目前我国流通的硬币是由合金材料制造的 B .生铁、普通钢和不锈钢中的碳含量依次增加 C .镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 D .日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 【 解析 】 本题考查金属的相关知识,主要涉及 Mg 、 Al 。 B 项中生铁、普通钢、不锈钢中碳含量应是依次减少的,故 B 错。 【 答案 】B 【 解析 】 (1) FeO 中的亚铁离子被氧化成三价铁离子,稀硝酸被还原成 NO 。 (2) 鼓入空气或氧气可将 NO 氧化,与水反应生成硝酸,可以循环使用。 (3) 加入 ZnO 可以消耗 H + ,增大 pH ,使 Fe 3+ 转化为 Fe(OH) 3 沉淀。 (4) 加入 Zn 粉可置换出 Cu , 滤渣 2 中应有置换出的 Cu 与多余的 Zn 粉。 (6) 胶体中分散质的微粒直径为 1~100 nm ,胶体有丁达尔效应,所以应取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是。 (2) 用连接好的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞, __________________( 请按正确的顺序排列下列步骤 ) ; A .加热反应一段时间 B .收集气体并检验纯度 C .关闭分液漏斗活塞 D .停止加热,充分冷却 (3) 实验结束后,某同学取少量产物,小心加入热水中,观察到有气泡冒出,该反应的化学方程式为 ____________ ; (4) 氢化钠也是一种金属氢化物,常用作缩合剂、烷化剂。请你设计一个实验,用化学方法区分氢化钠与氢化镁,写出简要的实验步骤及观察到的现象: _____________________________________________ 。 【 解析 】 (1) 制备氢化镁的原料是镁粉和氢气,氢气中混有 HCl 和水蒸气,先通过氢氧化钠溶液除去 HCl ,再通过浓硫酸除去水蒸气,即可得到纯净的氢气。为防止空气中的水蒸气进入反应装置,应在最后加一个干燥管。 (2) 实验步骤:制备氢气、收集气体并检验纯度,如果氢气已经纯净,则可开始制备氢化镁。实验结束,还要再通入一段时间的氢气,直至试管冷却至室温。 (3) 所生成的气体肯定是氢气,另一种产物是氢氧化镁。 (4) 最简单的方法是,观察与水反应时是否有沉淀出现。因为氢氧化镁难溶于水,而氢氧化钠易溶于水。 【 答案 】 (1)idcghjka(jk 可颠倒 ) (2)BADC (3)MgH 2 + 2H 2 O===Mg(OH) 2 + 2H 2 ↑ (4) 将少许固体放入适量水中,如果出现浑浊,则为 MgH 2 ,如果不出现浑浊,则为 NaH 5. 某学生对 SO 2 与漂粉精的反应进行实验探究: 操作 现象 取漂粉精固体,加入 100 mL 水 部分固体溶解,溶液略有颜色 过滤,测漂粉精溶液的 pH pH 试纸先变蓝 ( 约为 12) ,后褪色 ⅰ . 液面上方出现白雾; ⅱ . 稍后,出现浑浊,溶液变为黄绿色; ⅲ . 稍后,产生大量白色沉淀,黄绿色退去 (1)Cl 2 和 Ca(OH) 2 制取漂粉精的化学方程式是 _______ ; (2)pH 试纸颜色的变化说明漂粉精溶液具有的性质是 ________ ; (3) 向水中持续通入 SO 2 ,未观察到白雾。推测现象 ⅰ 的白雾由 HCl 小液滴形成,进行如下实验: a .用湿润的碘化钾淀粉试纸检验白雾,无变化; b .用酸化的 AgNO 3 溶液检验白雾,产生白色沉淀。 ①实验 a 的目的是 ____________________________________ ; ②由实验 a 、 b 不能判断白雾中含有 HCl ,理由是 ________________________ ; (4) 现象 ⅱ 中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和 Cl - 发生反应。通过进一步实验确认了这种可能性,其实验方案是 __________________________________ ; (5) 将 A 瓶中混合物过滤、洗涤,得到沉淀 X 。 ①向沉淀 X 中加入稀 HCl ,无明显变化。取上层清液,加入 BaCl 2 溶液,产生白色沉淀。则沉淀 X 中含有的物质是 ________ ; ②用离子方程式解释现象 ⅲ 中黄绿色褪去的原因: ________________________ 。 6. 为了探究 AgNO 3 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。 Ⅰ.AgNO 3 的氧化性 将光亮的铁丝伸入 AgNO 3 溶液中,一段时间后将铁丝取出。为检验溶液中 Fe 的氧化产物,将溶液中的 Ag + 除尽后,进行了如下实验。可选用的试剂: KSCN 溶液、 K 3 [Fe(CN) 6 ] 溶液、氯水。 (1) 请完成下表: 操作 现象 结论 取少量除尽 Ag + 后的溶液于试管中,加入 KSCN 溶液,振荡 ________ 存在 Fe 3 + 取少量除尽 Ag + 后的溶液于试管中,加入 ________ ,振荡 ________ 存在 Fe 2 + 【 实验结论 】Fe 的氧化产物为 Fe 2 + 和 Fe 3 + 。 Ⅱ.AgNO 3 的热稳定性用如图所示的实验装置 A 加热 AgNO 3 固体,产生红棕色气体,在装置 D 中收集到无色气体。当反应结束后,试管中残留固体为黑色。 (2) 装置 B 的作用是 ___________________________________ ; (3) 经小组讨论并验证该无色气体为 O 2 ,其验证方法是 ___________________________ ; (4)【 查阅资料 】Ag 2 O 和粉末状的 Ag 均为黑色; Ag 2 O 可溶于氨水。 【 提出设想 】 试管中残留的黑色固体可能是: ⅰ.Ag ; ⅱ.Ag 2 O ; ⅲ.Ag 和 Ag 2 O 。 【 实验验证 】 该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。 实 验编 号 操作 现象 a 加入足量氨水,振荡 黑色固体不溶解 b 加入足量稀硝酸,振荡 黑色固体溶解,并有气体产生 【 实验评价 】 根据上述实验,不能确定固体产物成分的实验是 ________( 填实验编号 ) ; 【 实验结论 】 根据上述实验结果,该小组得出 AgNO 3 固体热分解的产物有 ________ 。 【 解析 】 (1)Fe 3 + 与 KSCN 溶液反应生成红色溶液, Fe 2 + 与 K 3 [Fe(CN) 6 ] 溶液反应生成蓝色沉淀。 (2)B 装置起安全瓶作用,可防止装置 C 中的溶液进入加热的试管中。 (3) 氧气可使带火星的木条复燃,据此可进行实验设计。 (4) 结合题干信息,氨水能溶解 Ag 2 O ,因此 a 实验可确定产物只含 Ag ,而 b 实验只能确定含有 Ag ,不能判断是否含有 Ag 2 O 。 【 答案 】 (1) 溶液呈红色 K 3 [Fe(CN) 6 ] 溶液 产生蓝色沉淀 (2) 防倒吸 (3) 用带火星的木条伸入集气瓶内,木条复燃,证明无色气体为 O 2 (4)b Ag 、 NO 2 、 O 2 7. K 2 SO 4 是无氯优质钾肥 ,Mn 3 O 4 是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备 K 2 SO 4 和 Mn 3 O 4 的工艺流程如下 : 图 1 图 2 (1) 几种盐的溶解度见图 1 。反应 Ⅲ 中 , 向 (NH 4 ) 2 SO 4 溶液中加入 KCl 溶液充分反应后 , 进行蒸发浓缩、 、洗 涤、干燥等操作即得 K 2 SO 4 产品。 (2) 检验 K 2 SO 4 样品是否含有氯化物杂质的实验操作是 ; (3) 反应 Ⅳ 的化学方程式为 ; (4) Mn 3 O 4 与浓盐酸加热时发生反应的离子方程式为 ; (5) 图 2 是煅烧 MnSO 4 ·H 2 O 时剩余固体质量与温度的变化曲线; ①该曲线中 B 点所表示物质的化学式为 ; ②煅烧过程中固体锰含量随温度的升高而增大 , 但当温度超过 1 000 ℃时 , 再冷却后 , 测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因 : 。 (5) ① MnSO 4 ·H 2 OMnO x 169 55+16x 100 45.17 x=4/3 该曲线中 B 点所表示物质的化学式为 Mn 3 O 4 。②产物总锰含量减小的原因 : 部分 Mn 3 O 4 又被氧化为 Mn 2 O 3 或 MnO 2 ,造成总锰含量减小。 8. 某课外活动小组根据 Mg 与 CO 2 的反应原理,探究 Mg 与 NO 2 的反应及固体产物。该小组通过实验确认 Mg 能在 NO 2 中燃烧,并对固体产物提出三种假设: Ⅰ . 固体产物为 MgO 。 Ⅱ.______________________________________________ ; Ⅲ.______________________________________________ ; 请回答下列问题: 资料信息: 2NO 2 + 2NaOH===NaNO 3 + NaNO 2 + H 2 O (1) 如图连接好仪器,装药品前如何检验装置的气密性: ____________________________________ ; (2) 装置 B 中盛装的干燥剂可以是 ( 填序号 )________ ; ①浓硫酸 ②无水 CaCl 2 ③碱石灰 ④五氧化二磷 (3) 开始打开活塞 K ,让 A 中反应进行一段时间,待 C 中充满红棕色气体后,关闭活塞 K ,再点燃 C 处酒精灯,同时 D 中碱液盛得很满,这样做的目的都是 ________________ ; (4)E 中收集到的气体对氢气的相对密度是 14 ,该气体是 ________________ ; (5) 实验得到固体残留物的质量是实验前 Mg 粉质量的 1.5 倍,则假设 ________ 成立。 C 中发生反应的化学方程式为 ________________ ; (6) 本实验中存在明显缺陷,改进措施是 __________________________________________________ 。 【 解析 】 镁与二氧化碳反应生成的固体为氧化镁和单质碳,则镁与二氧化氮反应生成的固体为氧化镁或氮化镁或二者的混合物。 (1) 有气体制备的反应,实验前都要检查装置的气密性,然后再加入药品进行实验。 (2) 装置 B 中应盛装固体干燥剂,而 NO 2 与碱石灰反应,所以干燥剂可以是无水氯化钙或五氧化二磷。 (3) 开始打开活塞 K ,让 A 中反应一段时间,待 C 中充满红棕色气体后,关闭活塞 K ,再点燃 C 处酒精灯,同时 D 中盛满碱液,目的都是排净装置中的空气,防止空气干扰实验。 (4)E 中气体对氢气的相对密度是 14 ,则 E 是 N 2 。 (5) 实验得到固体残留物的质量是实验前 Mg 粉质量的 1.5 倍,如果生成的全是 MgO ,则大于 1.5 倍,如果生成的全是 Mg 3 N 2 ,则小于 1.5 倍,所以生成的是二者的混合物,假设 Ⅲ 成立。反应的化学方程式为 9. 以电石渣 [ 主要成分为 Ca(OH) 2 和 CaCO 3 ] 为原料制备 KClO 3 的流程如下: (1) 氯化过程控制电石渣过量,在 75 ℃左右进行。氯化时存在 Cl 2 与 Ca(OH) 2 作用生成 Ca(ClO) 2 的反应, Ca(ClO) 2 进一步转化为 Ca(ClO 3 ) 2 ,少量 Ca(ClO) 2 分解为 CaCl 2 和 O 2 。 ①生成 Ca(ClO) 2 的化学方程式为 ; ②提高 Cl 2 转化为 Ca(ClO 3 ) 2 的转化率的可行措施有 ( 填字母 ) 。 A. 适当减缓通入 Cl 2 的速率 B. 充分搅拌浆料 C. 加水使 Ca(OH) 2 完全溶解 (2) 氯化过程中 Cl 2 转化为 Ca(ClO 3 ) 2 的总反应方程式为 6Ca(OH) 2 +6Cl 2 Ca(ClO 3 ) 2 +5CaCl 2 +6H 2 O 。氯化完成后过滤; ①滤渣的主要成分为 ( 填化学式 ) ; ②滤液中 Ca(ClO 3 ) 2 与 CaCl 2 的物质的量之比 n[Ca(ClO 3 ) 2 ] ∶ n(CaCl 2 ) ( 填“ > ”、“ < ”或“ = ” )1 ∶ 5 ; (3) 向滤液中加入稍过量 KCl 固体可将 Ca(ClO 3 ) 2 转化为 KClO 3 。若溶液中 KClO 3 的含量为 100g·L -1 ,从该溶液中尽可能多地析出 KClO 3 固体的方法是 。 【 解析 】 (1) ① Cl 2 与 Ca(OH) 2 发生歧化反应生成 CaCl 2 和 Ca(ClO) 2 ,化学方程式为 2Cl 2 +2Ca(OH) 2 === CaCl 2 +Ca(ClO) 2 +2H 2 O 。②减缓通入氯气的速率,会使电石渣相对过量,减少 Cl 2 与水反应生成 HClO 和 HCl , HCl 能与 CaCO 3 反应、 HClO 受热能分解,故可提高氯气的转化率, A 项选;充分搅拌浆料能加快反应速率,减少 Ca(ClO) 2 分解为 CaCl 2 和 O 2 ,可提高氯气的转化率, B 项选; Ca(OH) 2 是微溶物,加水很难使其全部溶解, C 项不选。 (2) ①氯化过程在 75 ℃左右进行,此时 CaCl 2 、 Ca(ClO 3 ) 2 均易溶于水 ( 图中信息 ) ,故滤渣的成分为 CaCO 3 和未反应完的 Ca(OH) 2 。②根据题给信息“少量 Ca(ClO) 2 分解为 CaCl 2 和 O 2 ”知 CaCl 2 的量要多一些,故 n[Ca(ClO 3 ) 2 ] ∶ n(CaCl 2 )<1 ∶ 5 。 (3) 根据图示信息 KClO 3 的溶解度随温度升高而急剧增大,故从该溶液中尽可能多地析出 KClO 3 的方法是加热浓缩、冷却结晶。 【 答案 】 (1) ① 2Cl 2 +2Ca(OH) 2== CaCl 2 +Ca(ClO) 2 +2H 2 O ② AB (2) ① CaCO 3 、 Ca(OH) 2 ② < (3) 蒸发浓缩、冷却结晶 10. 以磷石膏 ( 主要成分 CaSO 4 ,杂质 SiO 2 、 Al 2 O 3 等 ) 为原料可制备轻质 CaCO 3 。 (1) 匀速向浆料中通入 CO 2 ,浆料清液的 pH 和 c(SO 4 2-- ) 随时间变化见右图。清液 pH>11 时 CaSO 4 转化的离子方程式为 , 能提高其转化速率的措施有 ( 填字母 ) ; A. 搅拌浆料 B. 加热浆料至 100 ℃ C. 增大氨水浓度 D. 减小 CO 2 通入速率 (2) 当清液 pH 接近 6.5 时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为 和 ( 填离子符号 ) ; 检验洗涤是否完全的方法是 ; (3) 在敞口容器中,用 NH 4 Cl 溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中 c(Ca 2+ ) 增大的原因是 。 【 解析 】 (1) 由于向清液中通入 CO 2 ,故当 pH>11 时, CaSO 4 转化为 CaCO 3 。搅拌能增大物质接触面积,反应速率增大, A 正确;加热到 100 ℃时,气体溶解度减小, NH 3 大量挥发,反应速率减小, B 错误;增大氨水的浓度能加快反应速率, C 正确;减小 CO 2 的通入速率时,转化速率也减小, D 错误。 (2) 在通入 CO 2 时,对 SO 4 2- 无影响,在 pH 为 6.5 时,通入的 CO 2 主要以 HCO 3 - 的形式存在;由于沉淀从含有 SO 4 2- 的溶液中析出,故只需检验洗涤滤液中是否含有 SO 4 2- 即可判断是否洗涤干净,常用盐酸酸化的 BaCl 2 溶液来检验 SO 4 2- 的存在。 (3) 升高温度促进 NH 4 Cl 的水解,溶液中的 c(H + ) 增大,促进了 Ca 2+ 的浸出。 【 答案 】 (1)CaSO 4 +2NH 3 ·H 2 O+CO 2== CaCO 3 +2NH 4 + + SO 4 2- +H 2 O ( 或 CaSO 4 +CO 3 2- ==CaCO 3 + SO 4 2- ) AC (2) SO 4 2- HC O 3 - 取少量最后一次洗涤滤液于试管中,向其中滴加盐酸酸化的 BaCl 2 溶液,若不产生白色沉淀,则表明已洗涤完全 (3) 浸取液温度上升,溶液中 c(H + ) 增大,促进固体中 Ca 2+ 浸出 11. 烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰 ( 主要含 Al 2 O 3 、 SiO 2 等 ) 制备碱式硫酸铝 [Al 2 (SO 4 ) x (OH) 6-2x ] 溶液,并用于烟气脱硫研究。 (1) 酸浸时反应的化学方程式为 , 滤渣 Ⅰ 的主要成分为 ( 填化学式 ) ; (2) 加 CaCO 3 调节溶液的 pH 至 3.6 ,其目的是中和溶液中的酸,并使 Al 2 (SO 4 ) 3 转化为 Al 2 (SO 4 ) x (OH) 6-2x 。滤渣 Ⅱ 的主要成分为 ( 填化学式 ) , 若溶液的 pH 偏高,将会导致溶液中铝元素的含量降低,其原因是 ( 用离子方程式表示 ) ; (3) 上述流程中经完全热分解放出的 SO 2 量总是小于吸收的 SO 2 量,其主要原因是 , 与吸收 SO 2 前的溶液相比,热分解后循环利用的溶液的 pH 将 ( 填“增大”、“减小”或“不变” ) 。 【 解析 】 (1) 酸浸时氧化铝与硫酸反应,二氧化硅不与硫酸反应,过滤得到 SiO 2 。 (2) 加入 CaCO 3 ,生成微溶于水的 CaSO 4 ;若 pH 偏高,将会生成氢氧化铝沉淀。 (3) 亚硫酸具有较强的还原性,易被氧气氧化为硫酸,使溶液酸性增强。 12. 铝是一种应用广泛的金属,工业上用 Al 2 O 3 和冰晶石 (Na 3 AlF 6 ) 混合熔融电解制得。 ①铝土矿的主要成分是 Al 2 O 3 和 SiO 2 等。从铝土矿中提炼 Al 2 O 3 的流程如下: ②以萤石 (CaF 2 ) 和纯碱为原料制备冰晶石的流程如下: 回答下列问题: (1) 写出反应 1 的化学方程式 _________________________ ; (2) 滤液 Ⅰ 中加入 CaO 生成的沉淀是 ________ ,反应 2 的离子方程式为 ________________________ ; (3)E 可作为建筑材料,化合物 C 是 ________ ,写出由 D 制备冰晶石的化学方程式 ________________ ; (4) 电解制铝的化学方程式是 _________________________ ; 以石墨为电极,阳极产生的混合气体的成分是 ________ 。 12 . 【 解析 】 (1) 因为铝土矿的主要成分为二氧化硅、氧化铝,前者与 NaOH 反应生成硅酸钠,后者与 NaOH 反应生成偏铝酸钠 (NaAlO 2 ) 。 (2)CaO 加入水溶液中先生成氢氧化钙,氢氧化钙电离出的 Ca 2 + 与 SiO 反应生成 CaSiO 3 ;反应 2 为偏铝酸钠与 CO 2 反应生成氢氧化铝。 (3) 浓硫酸与萤石反应生成 HF 气体和硫酸钙,故 C 为浓硫酸, D 为 HF , E 为硫酸钙;结合制备冰晶石的反应物 HF 、碳酸钠和氢氧化铝及生成物 Na 3 AlF 6 ,由元素守恒可知该反应的生成物中还有二氧化碳和水。 (4) 工业上利用熔融的氧化铝,通过电解可制得单质铝,并有氧气生成;阳极生成物氧气可与石墨反应,生成碳的氧化物。查看更多