- 2021-05-12 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
上海市交通大学附属中学2019-2020学年高二下学期期中考试化学试题 Word版含答案
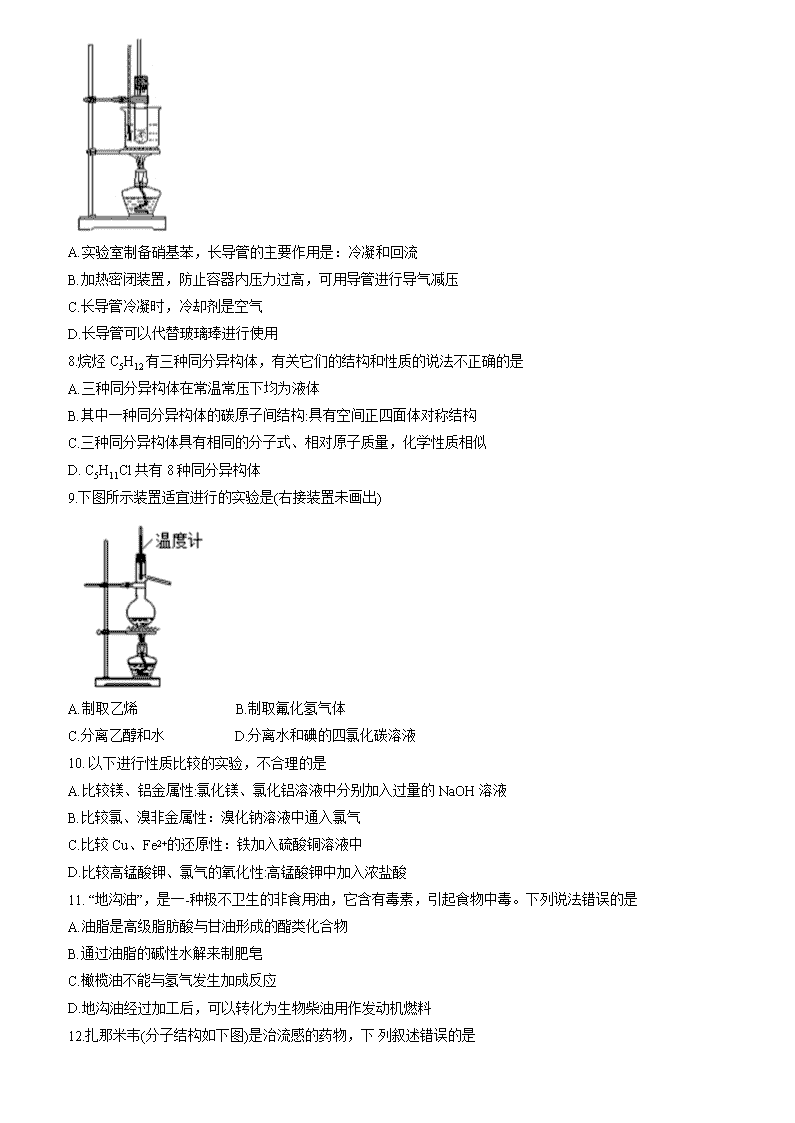
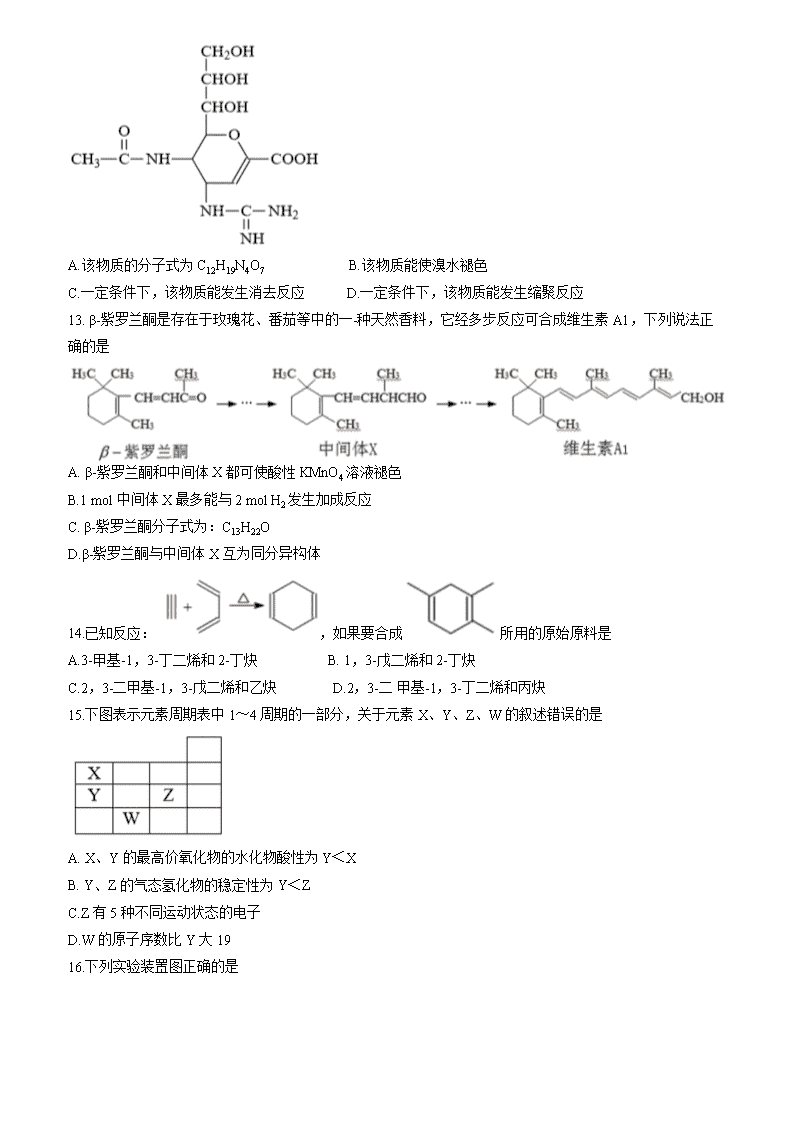
上海市交通大学附属中学2019-2020学年高二第二学期期中考试 化学试题 相对原子质量: H-1 C-12 O-16 S-32 Ca-40 一、选择题(只有一个正确答案) 1.下列有关化学用语表达正确的是 A. Cl-的最外层电子排布式: 1s22s22p63s23p6 B.聚丙烯的结构简式: C. CH2Br2 只能表示一种物质 D. NH3的电子式: 2.有机物CH3CH(C2H5)CH(OH)CH3命名正确的是 A. 2-乙基-1-丁醇 B. 3-甲基-2-戊醇 C. 3-乙基-2-丁醇 D. 2-羟基-3-甲基戊烷 3.下 列表达式正确的是 A.次氯酸电子式: B. CI-的结构示意图: C.乙醇结构简式: CH3CH2OH D. 磷原子的最外层电子轨道表示式: 4.关于石油炼制的说法正确的是 A.石油的炼制过程是将相对分子质量较大分子变成相对分子质量较小分子的过程 B.石油分馏的目的是将含碳原子数较多的烃先气化,经冷凝而分离出来 C.石油经过分馏、裂化等工序后得到大量乙烯、苯等不饱和烃 D.石油经分馏得到的各馏分仍然是多种烃的混合物 5.在"绿色化学工艺"中,理想状态是原子利用率为100%。在用CH3C≡CH合成CH2=C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要的其它反应物有 A. CO和CH3OH B. CO2和H2O C.H2和CO2 D. CH3OH 和H2 6.NA表示阿伏伽德罗常数,下列叙述错误的是 A.1 mol Cu和足量浓硝酸反应可收集的气体分子数小于2NA B.4°C时, 3.6 g重水所含的电子数小于2NA C.1.45 g 熟石膏中的钙离子数目大于0.009NA D.200 mL 0.5 mol/L的Na2CO3溶液:阴离子数目小于0.1NA 7.在各类化学实验中常常用到导管,如实验室制备硝基苯,装置如图。下列关于长导管的用途的叙述中错误的是 A.实验室制备硝基苯,长导管的主要作用是:冷凝和回流 B.加热密闭装置,防止容器内压力过高,可用导管进行导气减压 C.长导管冷凝时,冷却剂是空气 D.长导管可以代替玻璃琫进行使用 8.烷烃C5H12有三种同分异构体,有关它们的结构和性质的说法不正确的是 A.三种同分异构体在常温常压下均为液体 B.其中一种同分异构体的碳原子间结构:具有空间正四面体对称结构 C.三种同分异构体具有相同的分子式、相对原子质量,化学性质相似 D. C5H11Cl共有8种同分异构体 9.下图所示装置适宜进行的实验是(右接装置未画出) A.制取乙烯 B.制取氟化氢气体 C.分离乙醇和水 D.分离水和碘的四氯化碳溶液 10. 以下进行性质比较的实验,不合理的是 A.比较镁、铝金属性:氯化镁、氯化铝溶液中分别加入过量的NaOH溶液 B.比较氯、溴非金属性:溴化钠溶液中通入氯气 C.比较Cu、Fe2+的还原性:铁加入硫酸铜溶液中 D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 11. “地沟油”,是一-种极不卫生的非食用油,它含有毒素,引起食物中毒。下列说法错误的是 A.油脂是高级脂肪酸与甘油形成的酯类化合物 B.通过油脂的碱性水解来制肥皂 C.橄榄油不能与氢气发生加成反应 D.地沟油经过加工后,可以转化为生物柴油用作发动机燃料 12.扎那米韦(分子结构如下图)是治流感的药物,下 列叙述错误的是 A.该物质的分子式为C12H19N4O7 B.该物质能使溴水褪色 C.一定条件下,该物质能发生消去反应 D.一定条件下,该物质能发生缩聚反应 13. β-紫罗兰酮是存在于玫瑰花、番茄等中的一-种天然香料,它经多步反应可合成维生素A1,下列说法正确的是 A. β-紫罗兰酮和中间体X都可使酸性KMnO4溶液褪色 B.1 mol中间体X最多能与2 mol H2发生加成反应 C. β-紫罗兰酮分子式为:C13H22O D.β-紫罗兰酮与中间体X互为同分异构体 14.已知反应:,如果要合成所用的原始原料是 A.3-甲基-1,3-丁二烯和2-丁炔 B. 1,3-戊二烯和2-丁炔 C.2,3-二甲基-1,3-戊二烯和乙炔 D.2,3-二 甲基-1,3-丁二烯和丙炔 15.下图表示元素周期表中1~4周期的一部分,关于元素X、Y、Z、W的叙述错误的是 A. X、Y的最高价氧化物的水化物酸性为Y<X B. Y、Z的气态氢化物的稳定性为Y<Z C.Z有5种不同运动状态的电子 D.W的原子序数比Y大19 16.下列实验装置图正确的是 A.实验室制乙烯 B. 实验室制氨 C.实验室制氯气 D.实验室制乙酸乙酯 17.除去下列物质中少量杂质采用的方法与制取无水乙醇的方法相同的是 A.己烷(杂质为己烯) B.乙醇(杂质为乙酸) C.硝基苯(杂质为苯) D.苯(杂质为甲苯) 18. X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是 A.X元素的氢化物的水溶液显碱性 B. Z元素的离子半径大于W元素的离子半径 C. Z元素的单质在一-定条件下能与X元素的单质反应 D.Y元素最高价氧化物的晶体具有很高的熔点和沸点 19.往AgNO3溶液中逐滴加入氨水,先产生沉淀,后沉淀不断溶解得到溶液A。取溶液A加入葡萄糖(CH2OH(CHOH)4CHO)溶液水浴加热,有银镜产生;另取溶液A加入NaC1和硝酸混合溶液,有白色沉淀产生。以上实验涉及多个反应,以下反应的离子方程式错误的是 A. Ag++NH3·H2O- →AgOH↓+NH4+ B. AgOH+2NH3·H2O→Ag(NH3)2++OH-+2H2O C. CH2OH(CHOH)4CHO+2Ag(NH3)2+CH2OH(CHOH)4COOH+ 2Ag↓+4NH3+H2O D. Ag(NH3)2++OH-+C1-+3H+→AgC1↓+2NH4++H2O 20. CH3CH2CH2OH、 和浓硫酸混合物共热,产生的有机产物有 A.4种 B.5种 C.6种 D.7种 二、综合分析题 (一)氮元素可以形成多种化合物。回答以下问题: 21.氮原子的最外层的轨道式是______________; 氮元素有多种化合价,列举一例含2种氮元素化合价的化合物________(化学式)。 22.肼(N2H4)分 子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间构型是___________;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是_____(写化学式)。 23.肼可用作火箭燃料,燃烧时发生的反应是:N2O4(1)+ 2N2H4(1)→3N2(g)+4H2O(g)+ 1038.7 kJ 若该反应中有4 mol N-H键断裂,则形成的气体有_____mol,其中转移电子数目为________。 24.肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在_____(填标号) a.离子键 b.共价键 c.金属键 d.范德华力 (二)短周期元素W、X、Y和Z的原子序数依次增大。金属元素W是制备--种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。 25. W元素的原子核外共有____种 不同运动状态的电子、_______种不同能量的电子。 26.元素Z与元素X形成共价化合物XZ2是______(选填“极性”或“非极性")分子,其电子式为______。 27. Y原子的最外层电子排布式为_______,Y元素最高价氧化物对应的水化物的电离方程式为_____。 28.两种非金属元素中,非金属性较强的元素是________(写元素符号),试写出一个能说明这一事实的化学方程式_______________。 (三)苯甲酸甲酯是一种重要的工业原料,某化学小组采用如下图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯。有关物质的物理性质见下表所示: 苯甲酸 甲醇 苯甲酸甲酯 熔点/°C 122.4 -97 -12.3 沸点/°C 249 64.3 199.6 密度/g.cm-3 1.2659 0.792 1.0888 水溶性 微溶 互溶 不溶 I.合成苯甲酸甲酯粗产品 在圆底烧瓶中加入0.1 mol苯甲酸和0.4 mol甲醇,再小心加入3 mL浓硫酸,混匀后,投入几粒沸石,小心加热60分钟,得苯甲酸甲酯粗产品。 29.甲装置的作用是:____________________。 30.化学小组在实验中用过量的反应物甲醇,其理由是_______________________。 II.粗产品的精制 苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制。 31.试剂1可以是_________(填编号),作用是________________。 A.稀硫酸 B.碳酸钠溶液 C.乙醇 32.第一次蒸馏时,控制的温度应在___________°C左右,操作1的名称是____________。 33.实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为_____________。 34.这个实验的最高产率可达90%,本次实验制得的苯甲酸甲酯的产率低于最佳产率,可能的原因是____ (填编号)。 A.甲醇用量多了 B.反应时加热时间还不够长 C.减压蒸馏后烧瓶内剩余液体太多 (四)化合物M是一种药物。以乳酸为原料合成M以及高分子化合物N的路线如下图所示。根据题意完成下列填空: 35.写出反应类型:C→N_________反应;E→F______________反应。 36.C8H10有多种同分异构体,其中一溴代物最多的芳香烃的名称是_________________。 37.写出由乳酸生成A的化学方程式:______________________。 38. D生成E时,会有邻、对位三取代的副产物生成,写出此三取代产物的结构简式_____________。 39.下列关于M的说法错误的是____________(选填编号)。 a.能发生还原反应 b.能使酸性高锰酸钾溶液褪色 c.能与盐酸反应生成盐 d.属于氨基酸 40.仿照乙烯制取乙酸乙酯的反应流程图,写出丙烯制得乳酸的反应流程图。 (乙烯制取乙酸乙酯: CH2=CH2 CH3CH2OH CH3COOC2H5) 。查看更多