【新高考】2021高考化学一轮考评特训:课练27 盐类的水解
www.ks5u.com
课练27 盐类的水解
————————[狂刷小题 夯基础]—————————
[练基础]
1.下列各物质对水的电离不会产生影响的是( )
A.氯化钠 B.氯化铵 C.氯化铁 D.氯化氢
2.下列说法正确的有
①pH=0的溶液中,Fe3+与S2-因发生相互促进的水解反应而不能共存;②MgCl2溶液蒸干灼烧后得MgO固体,如果想要得到MgCl2固体应通入HCl的气流;③将0.1 mol的Na2CO3溶于水中,形成的溶液中阴离子总数小于0. 1NA;④HCO和AlO在溶液中因为互相抑制的水解而能大量共存;⑤将I2加入NaHSO3溶液中发生反应:HSO+I2+3OH-===SO+2I-+2H2O;⑥pH=2的盐酸和醋酸,均稀释到pH=5,醋酸加水量大;⑦向NaHSO3溶液中加入少量NaOH固体,c(SO)/c(HSO)将增大( )
A.2个 B.4个 C.5个 D.7个
3.已知酸H2B在水溶液中存在下列关系:①H2B===H++HB-,②HB-H++B2-,则下列说法一定正确的是( )
A.在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-)+2c(H2B)
B.NaHB溶液中可能存在以下关系:c(Na+)>c(HB-)>c(OH-)>c(H+)
C.NaHB溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-)
D.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
4.常温下,下列溶液中的微粒浓度关系不正确的是( )
A.pH=8.3的某酸式盐NaHB的水溶液中:c(Na+)>c(HB-)>c(H2B)>c(B2-)
B.pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH)>c(OH-)
C.含等物质的量的NaHC2O4和Na2C2O4的溶液中:2c(Na+)=3[c(HC2O)+c(C2O)+c(H2C2O4)]
D.0.10 mol·L-1 CH3COONa溶液中通入HCl至溶液的pH恰好等于7,则c(Na+)>c(CH3COOH)=c(Cl-)
5.10 ℃时加热NaHCO3溶液,测得溶液pH发生如下变化:
温度/℃
10
20
30
加热煮沸后
冷却到50 ℃
pH
8.3
8.4
8.5
8.8
下列判断正确的是( )
A.50 ℃时,c(OH-)=1×10-5.2 mol·L-1
B.30 ℃时,c(Na+)=c(HCO)+2c(CO)
C.升高温度,c(Na+)/c(HCO)增大
D.将NaHCO3溶液蒸干并灼烧,得到NaOH固体
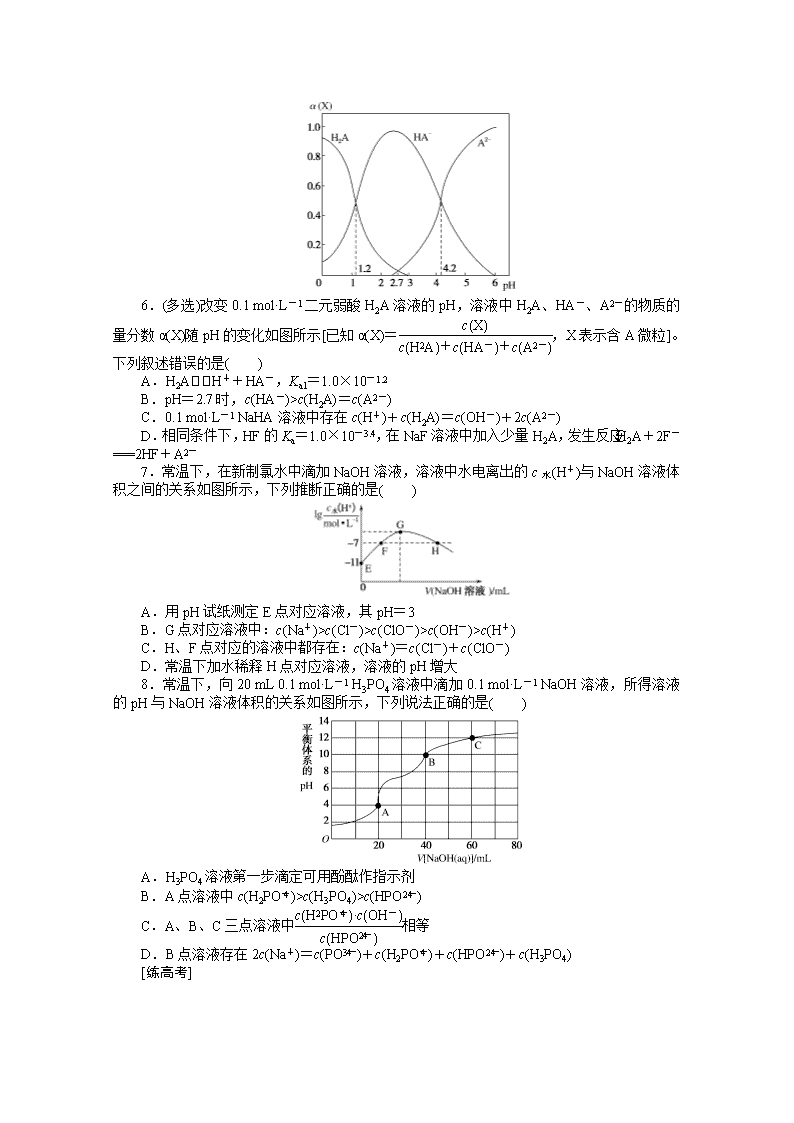
6.(多选)改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中H2A、HA-、A2-的物质的量分数α(X)随pH的变化如图所示[已知α(X)=,X表示含A微粒]。下列叙述错误的是( )
A.H2AH++HA-,Ka1=1.0×10-1.2
B.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
C.0.1 mol·L-1 NaHA溶液中存在c(H+)+c(H2A)=c(OH-)+2c(A2-)
D.相同条件下,HF的Ka=1.0×10-3.4,在NaF溶液中加入少量H2A,发生反应:H2A+2F-===2HF+A2-
7.常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出的c水(H+)与NaOH溶液体积之间的关系如图所示,下列推断正确的是( )
A.用pH试纸测定E点对应溶液,其pH=3
B.G点对应溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
C.H、F点对应的溶液中都存在:c(Na+)=c(Cl-)+c(ClO-)
D.常温下加水稀释H点对应溶液,溶液的pH增大
8.常温下,向20 mL 0.1 mol·L-1 H3PO4溶液中滴加0.1 mol·L-1 NaOH溶液,所得溶液的pH与NaOH溶液体积的关系如图所示,下列说法正确的是( )
A.H3PO4溶液第一步滴定可用酚酞作指示剂
B.A点溶液中c(H2PO)>c(H3PO4)>c(HPO)
C.A、B、C三点溶液中相等
D.B点溶液存在2c(Na+)=c(PO)+c(H2PO)+c(HPO)+c(H3PO4)
[练高考]
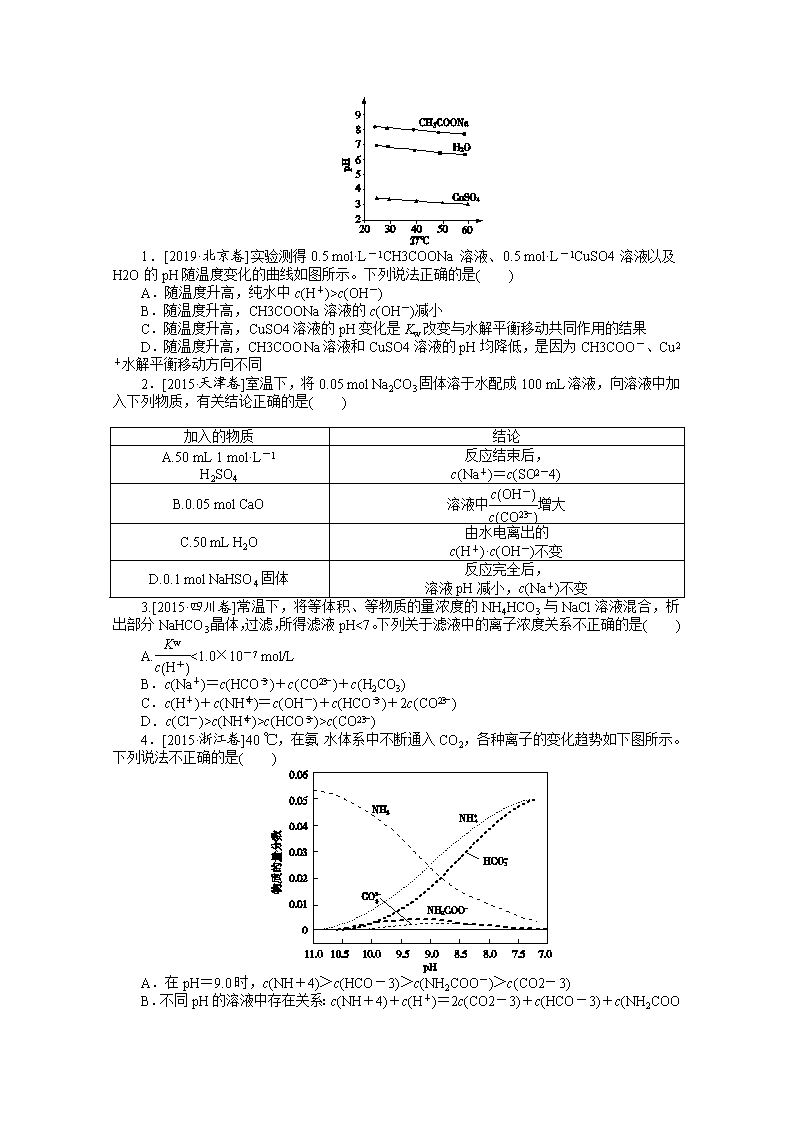
1.[2019·北京卷]实验测得0.5 mol·L-1CH3COONa溶液、0.5 mol·L-1CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )
A.随温度升高,纯水中c(H+)>c(OH-)
B.随温度升高,CH3COONa溶液的c(OH-)减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
2.[2015·天津卷]室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入的物质
结论
A.50 mL 1 mol·L-1
H2SO4
反应结束后,
c(Na+)=c(SO4)
B.0.05 mol CaO
溶液中增大
C.50 mL H2O
由水电离出的
c(H+)·c(OH-)不变
D.0.1 mol NaHSO4固体
反应完全后,
溶液pH减小,c(Na+)不变
3.[2015·四川卷]常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
A.<1.0×10-7 mol/L
B.c(Na+)=c(HCO)+c(CO)+c(H2CO3)
C.c(H+)+c(NH)=c(OH-)+c(HCO)+2c(CO)
D.c(Cl-)>c(NH)>c(HCO)>c(CO)
4.[2015·浙江卷]40 ℃,在氨水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
A.在pH=9.0时,c(NH+4)>c(HCO-3)>c(NH2COO-)>c(CO2-3)
B.不同pH的溶液中存在关系:c(NH+4)+c(H+)=2c(CO2-3)+c(HCO-3)+c(NH2COO-)+c(OH-)
C.随着CO2的通入,不断增大
D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
5.[2016·浙江卷]苯甲酸钠(COONa,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A-)不变
C.当pH为5.0时,饮料中=0.16
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO)+c(CO)+c(OH-)-c(HA)
[练模拟]
1.[2019·湖北武汉华中师大一附中期末]下列事实中与盐类的水解有关的叙述有( )
①NaHSO4溶液呈酸性;
②铵态氮肥与草木灰不能混合使用;
③加热能增加纯碱溶液的去污能力;
④配制CuCl2溶液,用稀盐酸溶解CuCl2固体;
⑤NaHS溶液中c(H2S)>c(S2-);
⑥氯化铵溶液可去除金属制品表面的锈斑;
⑦蒸发FeCl3溶液制得FeCl3固体时可加入SOCl2;
⑧向NaAlO2溶液中加入NaHCO3溶液可产生Al(OH)3白色沉淀。
A.8项 B.7项
C.6项 D.5项
2.[2019·黑龙江哈尔滨六中月考]常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
A.HA为强酸
B.该混合液的pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
3.[2019·河北唐山一模]下列说法错误的是( )
A.0.1 mol·L-1的Na2CO3溶液加适量水稀释后,溶液中变大
B.若使Na2S溶液中接近于2:1,可加入适量的KOH固体
C.25 ℃时,浓度均为0.1 mol·L-1 NaOH和NH3·H2O混合溶液中:c(OH-)>c(Na+)=c(NH3·H2O)
D.0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
4.(多选)25 ℃时,配制一组c(PO)+c(HPO)+c(H2PO)+c(H3PO4)=0.10 mol·L-1的H3PO4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A.pH=6的溶液中:c(H3PO4)+c(HPO)>c(H2PO)
B.c(Na+)=0.10 mol·L-1的溶液中:c(H3PO4)=2c(PO)+c(HPO)
C.pH=7的溶液中:c(Na+)>2c(HPO)+c(H2PO)
D.c(H3PO4)=c(H2PO)的溶液中:c(Na+)<0.10 mol·L-1+2c(PO)+c(HPO)-c(H2PO)
————————[综合测评 提能力]—————————
一、选择题:本题共7小题,每小题2分,共14分。每小题只有一个选项符合题意。
1.[2019·广东惠州期末]常温下,下列溶液中有关物质的量浓度关系正确的是( )
A.Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
B.Na2CO3溶液中:c(Na+)=2c(CO)+2c(HCO)
C.pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.pH=7的氨水与氯化铵混合溶液中:c(Cl-)>c(NH)
2.[2019·黑龙江大庆铁人中学二模]常温下,浓度均为0.1 mol·L-1的四种盐溶液,其pH如表所示,下列说法正确的是( )
序号
①
②
③
④
溶液
CH3COONa
NaHCO3
Na2CO3
NaClO
pH
8.8
9.7
11.6
10.3
A.等浓度的CH3COOH和HClO溶液,pH小的是HClO
B.Na2CO3和NaHCO3溶液中离子种类不同
C.溶液中水的电离程度:①>②>④>③
D.NaHCO3溶液中:c(Na+)=c(CO)+c(HCO)+c(H2CO3)
3.[2019·广西柳州一模]常温时,下列溶液的pH或微粒的物质的量浓度关系错误的是( )
A.某溶液中由水电离出的c(H+)=1×10-a mol·L-1若a>7时,该溶液pH一定为14-a
B.0.1 mol·L-1的KHA溶液,其pH=10:c(K+)>c(HA-)>c(OH-)>c(A2-)
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-)
D.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:2c(Na+)=3c(CO)+3c(HCO)+3c(H2CO3)
4.[2019·山东临沂国际学校月考]下列有关电解质溶液的说法不正确的是( )
A.向Na2CO3溶液中通入NH3,减小
B.将0.1 mol·L-1 K2C2O4溶液从25 ℃升高到35 ℃,增大
C.向0.1 mol·L-1 HF溶液中滴加NaOH溶液至中性,=1
D.pH=4的0.1 mol·L-1 NaHC2O4溶液中:c(HC2O)>c(H+)>c(H2C2O4)>c(C2O)
5.[2019·辽宁协作体模拟]常温下,向1 L 0.1 mol·L-1NH4Cl溶液中,不断加入固体NaOH,NH与NH3·H2O的浓度变化趋势如图所示(不考虑溶液体积变化和氨的挥发),下列说法正确的是( )
A.M点溶液中水的电离程度比原溶液大
B.随着NaOH的加入,NH与NH3·H2O的总物质的量减小
C.当n(NaOH)=0.05 mol时,溶液中有:c(Cl-)>c(Na+)>c(NH)>c(OH-)>c(H+)
D.在M点时,n(OH-)+0.05 mol=a mol+n(H+)
6.[2019·潍坊统考]室温下,用0.1 mol·L-1的盐酸分别滴定50 mL的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断错误的是( )
A.从反应开始至恰好完全反应,水电离出的c(H+)始终增大
B.滴定至P点时,溶液中:c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+)
C.pH=7时,三种溶液中c(A+)=c(B+)=c(D+)
D.当盐酸体积为50 mL时,将三种溶液混合后:c(H+)=c(AOH)+c(BOH)+c(DOH)+c(OH-)
7.[2019·山东八校联考]25 ℃时,一定量的Na2CO3与盐酸混合所得溶液中,部分含碳微粒的物质的量分数(α)与pH的关系如图所示。下列说法正确的是( )
A.曲线X表示的含碳微粒为CO
B.pH=6.3时,α(CO)+α(HCO)+α(H2CO3)=1.0
C.pH=7.0时,c(HCO)>c(CO)>c(H2CO3)>c(OH-)=c(H+)
D.pH=10.3时,c(Na+)+c(H+)=c(Cl-)+c(OH-)+3c(HCO)
二、选择题:本题共3小题,每小题4分,共12分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得1分,有选错的得0分。
8.常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
A.在0.1 mol·L-1Na2CO3溶液中:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-)
B.当溶液的pH为7时,溶液的总体积为20 mL
C.在B点所示的溶液中,离子浓度最大的是HCO
D.在A点所示的溶液中:c(CO)=c(HCO)>c(OH-)>c(H+)
9.25 ℃时,向10 mL NH4Al(SO4)2溶液中滴加0.6 mol·L-1的NaOH溶液。溶液的pH、产生沉淀的质量与加入NaOH溶液体积的关系如图所示。下列说法错误的是( )
A.滴加NaOH溶液体积在30~40 mL时的离子方程式为NH+OH-===NH3·H2O
B.a点到b点过程中,的值逐渐增大
C.由题中数据计算,Kb(NH3·H2O)的数量级为10-6
D.pH=7时,c(NH)>c(SO)>c(Na+)
10.常温下,关于下列水溶液叙述正确的是( )
A.稀醋酸溶液电离平衡正移,则醋酸的电离度一定增大,且酸性增强
B.三种稀溶液①CH3COONa溶液、②NaHCO3溶液、③NaClO溶液的pH相等,则三种溶液的浓度从大到小排序:①>②>③
C.浓度相等的Na2CO3和NaHCO3混合稀溶液中:2c(OH-)-2c(H+)=2c(H2CO3)+c(HCO)-c(CO)
D.浓度均为0.1 mol/L的NaCl溶液和NaF溶液,后者离子浓度之和更大
三、非选择题:本题共3小题。
11.(12分)[2019·郑州一测]测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
(1)Na2SO3水解的离子方程式为________________。
(2)请根据题给信息判断Kw的关系①________(填“>”“<”或“=”,下同)④,Kh的关系①________________________________________________________________________②。
(3)实验过程中,取①、④时刻相同体积的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生的白色沉淀比①多。该白色沉淀的成分是________,沉淀④比①多的原因是________________。
(4)数据显示,①→③的过程中,________(填“温度”或“浓度”)
对水解平衡移动方向的影响程度更大。
12.(12分)[2019·湖北枣阳高中模拟]NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛。
请回答下列问题:
(1)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。
①溶液中的Kw=________(填数值),由水电离出的c(H+)=________mol·L-1。
②溶液中c(NH)+c(NH3·H2O)________c(Al3+)+c[Al(OH)3](填“>”“=”或“<”);2c(SO)-c(NH)-3c(Al3+)=________mol·L-1(填数值)。
(2)80 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是________________________________________________________________________
________________________________________________________________________。
(3)常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
①图中a、b、c、d四点中水的电离程度最小的是________。
②向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为________________________________________________________________________。
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是________________。
13.(14分)[2019·山东临沂月考]醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐[已知:25 ℃,Ka(CH3COOH)=1.69×10-5]。请回答下列问题:
(1)写出醋酸钠溶液中存在的平衡(离子方程式):________________。
(2)0.1 mol·L-1 CH3COONa溶液中离子浓度由大到小的顺序为________________。
(3)25 ℃时,醋酸的电离平衡常数表达式为Ka=____。0. 10 mol·L-1的醋酸溶液的pH约为______(提示:醋酸的电离常数很小,lg 1.3=0.114,结果保留2位小数)。
(4)下列对于醋酸溶液和醋酸钠溶液的说法正确的是________(填序号,下同)。
A.加水稀释,醋酸的电离程度增大,醋酸钠的水解程度减小
B.升高温度,可以促进醋酸的电离,抑制醋酸钠的水解
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解,醋酸钠抑制醋酸的电离
(5)物质的量浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合(混合前后体积变化忽略),混合液中的下列关系式正确的是______。
A.c(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
B.c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
(6)常温时,pH=3的醋酸溶液和pH=11的NaOH溶液等体积混合后,溶液中c(Na+)________c(CH3COO-)(填“>”“<”或“=”,下同),该溶液中电荷守恒表达式为________________。
(7)常温时,将m mol·L-1的醋酸溶液和n mol·L-1的NaOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是m________n,醋酸溶液中c(H+)________ NaOH溶液中c(OH-)。
课练27 盐类的水解
[狂刷小题 夯基础]
[练基础]
1.A 氯化钠在水中完全电离产生的氯离子和钠离子都不水解,所以氯化钠对水的电离不会产生影响,A正确;氯化铵是强酸弱碱盐,铵根离子水解促进水的电离,B错误;氯化铁是强酸弱碱盐,铁离子水解促进水的电离,C错误;氯化氢在水中完全电离产生氢离子和氯离子,氢离子使溶液中氢离子浓度增大,抑制水的电离,D错误。
2.A ①pH=0的溶液中,Fe3+与S2-会发生氧化还原反应生成硫沉淀和硫化亚铁沉淀,错误;②MgCl2溶液蒸干时氯化镁会水解,生成氢氧化镁沉淀,灼烧时氢氧化镁分解,得到MgO固体,如果想要得到MgCI2固体应通入HCl的气流,以抑制氯化镁水解,正确;③在Na2CO3溶液中存在碳酸根的水解,阴离子总数增多,错误;④HCO存在电离平衡,电离出的H+会与AlO反应生成氢氧化铝沉淀,进而促进碳酸氢根离子的电离,错误;⑤I2具有氧化性,由于NaHSO3呈酸性,加入NaHSO3溶液中发生反应:HSO+I2+H2O===SO+2I-+3H+,错误;⑥没有注明稀释前溶液的体积是否相等,故无法判断,错误;⑦向NaHSO3溶液中加入少量NaOH固体,会促进HSO的电离,c(SO)/c(HSO)将增大,正确。正确的有2个,故选A。
3.D 酸H2B在水溶液中第一步完全电离,第二步部分电离,所以B2-只能发生一步水解,故溶液中不存在H2B,溶液中存在质子守恒:c(OH-)=c(H+)+c(HB-) ,A错误;HB-在水溶液里只能电离不能水解,导致溶液呈酸性,所以c(OH-)
c(HB-)>c(H2B)>c(B2-),A项正确;两溶液等体积混合后,NH3·H2O过量,得到NH3·H2O和NH4Cl的混合溶液,溶液呈碱性,故c(NH)>c(Cl-)>c(OH-)>c(H+),B项错误;含等物质的量的NaHC2O4和Na2C2O4的溶液,根据物料守恒,可知2c(Na+)=3[c(HC2O)+c(C2O)+c(H2C2O4)],C项正确;根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),溶液呈中性,c(H+)=c(OH-),则c(Na+)=c(CH3COO-)+c(Cl-),c(Na+)>c(Cl-),根据物料守恒c(Na+)=c(CH3COO-)+c(CH3COOH),结合c(Na+)=c(CH3COO-)+c(Cl-),得c(CH3COOH)=c(Cl-),故c(Na+)>c(CH3COOH)=c(Cl-),D项正确。
5.C 50 ℃时,溶液的pH=8.8,但此时Kw≠1×10-14,故c(OH-)≠1×10-5.2 mol·L-1,A错误;根据电荷守恒,c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-),但此时c(H+)≠c(OH-),故B错误;升高温度,HCO的水解程度增大,c(HCO)减小,c(Na+)不变,故c(
Na+)/c(HCO)增大,C正确;蒸干并灼烧NaHCO3溶液,得到的固体是Na2CO3,得不到NaOH固体,故D错误。
6.CD 根据图像,pH=1.2时,α(H2A)=α(HA-),则有c(H2A)=c(HA-),根据H2A的第一步电离方程式H2AH++HA-,得出Ka1==c(H+)=1.0×10-1.2,A正确;pH=2.7时,α(HA-)>α(H2A)=α(A2-),则有c(HA-)>c(H2A)=c(A2-),B正确;0.1 mol·L-1 NaHA溶液中存在电荷守恒式:c(H+)+c(Na+)=c(OH-)+2c(A2-)+c(HA-),物料守恒式:c(Na+)=c(A2-)+c(HA-)+c(H2A),两式相减可得c(H+)+c(H2A)=c(OH-)+c(A2-),C错误;pH=4.2时,α(A2-)=α(HA-),则有c(A2-)=c(HA-),根据H2A的第二步电离方程式HA-H++A2-,得出Ka2==c(H+)=1.0×10-4.2,所以酸性:H2A>HF>HA-,根据强酸制弱酸原理可知,在NaF溶液中加入少量H2A,发生反应H2A+F-===HF+HA-,D错误。
7.B 由题图知,E点对应溶液为Cl2、HCl、HClO的混合液,HClO具有强氧化性,能使pH试纸褪色,故不能用pH试纸测其pH,A项错误;G点对应溶液的溶质为等物质的量的NaCl和NaClO,溶液因NaClO的水解而显碱性,故溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),B项正确;H点对应的溶液中溶质为NaCl、NaClO、NaOH,c(H+) c(Cl-)+c(ClO-),C项错误;H点对应溶液显碱性,常温下加水稀释H点对应溶液,溶液的pH变小,D项错误。
8.C 加入20 mL等浓度的NaOH溶液时生成NaH2PO4,此时溶液的pH=4,酚酞的变色范围为8~10,不能用酚酞作指示剂,故A错误;A点溶液的溶质为NaH2PO4,溶液的pH=4,说明H2PO的电离程度大于其水解程度,则溶液中c(HPO)>c(H3PO4),故B错误;为HPO的水解平衡常数,其只受温度的影响,所以A、B、C三点溶液中相等,故C正确;B点时加入等浓度的40 mL NaOH溶液,反应后溶液的溶质为Na2HPO4,根据物料守恒可得:c(Na+)=2c(PO)+2c(H2PO)+2c(HPO)+2c(H3PO4),故D错误。
[练高考]
1.C 纯水中H+和OH-的浓度永远相等,A错误;温度升高,醋酸钠溶液中醋酸根离子水解程度增大,溶液中氢氧根离子浓度变大,B错误;温度升高,使Cu2+的水解平衡正向移动,氢离子浓度变大,升温使水的离子积常数变大,二者作用的结果是溶液的pH减小,C正确;升高温度,盐类的水解平衡均正向移动,D错误。
2.B A项,由碳酸钠和硫酸的物质的量可知二者恰好完全反应,溶质为Na2SO4,根据物料守恒,c(Na+)=2c(SO),错误;B项,加入CaO发生反应CaO+H2O===Ca(OH)2,溶液中c(OH-)增大,Ca2++CO===CaCO3↓,使溶液中的c(CO)减小,正确;C项,加水后,c(CO)减小,虽其水解程度增大,但水电离出的c(OH-)减小,而水电离出的c(H+)=c(OH-),所以二者乘积减小,错误;D项,加硫酸氢钠固体,c(Na+)增大,错误。
3.C A项,滤液pH<7,=c(OH-)<1.0×10-7 mol·L-1;B项,物料守恒;c(Na+)=c(HCO)+c(CO)+c(H2CO3);C项,根据电荷守恒,等式左边缺少c(Na+),右边缺少c(Cl-);D项,NH、HCO发生水解,且析出部分NaHCO3晶体,故c(Cl-)>c(NH)>c(HCO)>c(CO)。
4.C B项,溶液中存在电荷守恒,正确;C项,随着CO2的通入,溶液的酸性逐渐增强,c(NH)变大,而Kb=,所以=不断减小,错误;D项,由图可知,当8.5c(S2-),说明水解程度大于电离程度,与盐类水解有关,故⑤符合题意;氯化铵属于强酸弱碱盐,铵根离子水解使溶液呈酸性,酸和锈斑反应生成盐和水,所以氯化铵溶液可去除金属制品表面的锈斑,与盐类水解有关,故⑥符合题意;FeCl3属于强酸弱碱盐,铁离子水解生成氢氧化铁和HCl,升高温度促进其水解,得不到FeCl3,SOCl2水解生成SO2和HCl,蒸发FeCl3溶液制FeCl3固体时加入SOCl2可抑制Fe3+水解,与盐类水解有关,故⑦符合题意;NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,反应的离子方程式为HCO+AlO+H2O===CO+Al(OH)3↓,与盐类水解无关,故⑧不符合题意。所以与盐类的水解有关的叙述有6项。
2.D 本题考查酸碱中和反应、盐类的水解及离子浓度的比较等。0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合恰好完全反应生成NaA和H2O,由图可知,溶液中c(A-)小于0.1 mol·L-1,说明A-发生了水解反应,则HA是弱酸,A错误;A-发生水解反应生成HA和OH-,混合液呈碱性,pH>7,B错误;该混合液中离子浓度关系为c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),故X、Y、Z分别表示OH-、HA和H+,C错误;所得溶液为NaA溶液,据物料守恒可得c(A-)+c(HA)=c(Na+),D正确。
3.C 本题考查盐溶液中粒子浓度大小判断。Na2CO3溶液加适量水稀释后,促进CO水解,OH-物质的量变大,CO物质的量减小,所以溶液中变大,即变大,A正确;Na2S溶液中存在水解平衡:S2-+H2OHS-+OH-,加入适量KOH固体,水解平衡逆向移动,使得S2-的物质的量浓度增大,而Na+的物质的量浓度不变,从而可使Na2S溶液中接近于2:1,B正确;混合溶液中,NaOH完全电离,NH3·H2O部分电离,故c(Na+)>c(NH3·H2O),C错误;0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合后,得到等物质的量浓度的醋酸和醋酸钠的混合溶液,根据物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因此可得:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),D正确。
4.CD 根据图示,pH=6的溶液中c(H2PO)>0.05 mol·L-1,而c(PO)+c(HPO)+c(H2PO)+c(H3PO4)=0.10 mol·L-1,故c(H3PO4)+c(HPO)c(OH-),故c(H3PO4)>2c(PO)+c(HPO),B项错误;pH=7的溶液中,根据电荷守恒有c(Na+)=3c(PO)+2c(HPO)+c(H2PO)>2c(HPO)+c(H2PO),C项正确;根据图示,c(H3PO4)=c(H2PO)的溶液呈酸性,结合电荷守恒可知,c(Na+)<3c(PO)+2c(HPO)+c(H2PO),又c(PO)+c(HPO)+c(H2PO)+c(H3PO4)=0.10 mol·L-1,c(H3PO4)=c(H2PO),可知3c(PO)+2c(HPO)+c(H2PO)=0.10 mol·L-1+2c(PO)+c(HPO)-c(H2PO),D项正确。
[综合测评 提能力]
1.A 本题考查离子浓度的比较,侧重考查电荷守恒、物料守恒等规律的应用。Na2S溶液中,据电荷守恒可得:c(H+)+c(Na+)=c(OH-)+c(HS-)+2c(S2-);据物料守恒可得:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S),综合上述两式可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),A正确。Na2CO3溶液中,CO分两步发生水解,分别生成HCO、H2CO3,据物料守恒可得:c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3),B错误。室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合,充分反应后醋酸剩余,混合液呈酸性,则有c(H+)>c(OH-),结合电荷守恒推知,c(CH3COO-)>c(Na+),C错误。氨水与氯化铵混合溶液中,据电荷守恒可得:c(Cl-)+c(OH-)=c(NH)+c(H+),溶液的pH=7,则有c(OH-)=c(H+),从而得出c(Cl-)=c(NH),D错误。
2.D 本题考查盐的水解平衡、水的电离程度、离子浓度的比较等。等浓度的CH3COONa和NaClO溶液相比,前者的pH小于后者,说明ClO-的水解程度大于CH3COO-的水解程度,根据盐类“越弱越水解”的规律推知,酸性:CH3COOH>HClO,故等浓度的CH3COOH和HClO溶液,pH小的是CH3COOH溶液,A错误。Na2CO3和NaHCO3溶液中均含有两种阳离子(Na+、H+)和三种阴离子(OH-、HCO、CO),B错误。盐的水解促进了水的电离,等浓度的四种盐溶液,盐的水解程度越大,溶液的pH越大,由表可知,水解程度:Na2CO3>NaClO>NaHCO3>CH3COONa,则水的电离程度:③>④>②>①,C错误。NaHCO3溶液中,据物料守恒可得:c(Na+)=c(CO)+c(HCO)+c(H2CO3),D正确。
3.A 本题考查溶液的pH、溶液中粒子浓度的比较等。常温时a>7,由水电离出的c(H+)<1×10-7 mol·L-1,说明水的电离受到抑制,该溶液可能为酸或碱溶液,则该溶液的pH可能为14-a或a,A错误。KHA溶液的pH=10,说明HA-的水解程度大于其电离程度,则c(H2A)>c(A2-),HA-水解及H2O的电离均产生OH-,则c(OH-)>c(H2A),即得c(OH-)>c(A2-),B正确。0.2 mol·L-1 HA溶液和0.1 mol·L-1 NaOH溶液等体积混合,所得溶液为等浓度的HA和NaA的混合液,溶液pH>7,说明A-的水解程度大于HA的电离程度,则有c(HA)>c(Na+)>c(A-),C正确。等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合,据物料守恒可得:2c(Na+)=3c(CO)+3c(HCO)+3c(H2CO3),D正确。
4.D 本题考查电解质溶液知识,涉及盐类的水解平衡及移动、离子浓度的比较等。Na2CO3溶液中存在水解平衡:CO+H2OHCO+OH-,通入NH3后,NH3与水反应生成的NH3·H2O电离产生NH和OH-,溶液中c(OH-)增大,使CO的水解平衡逆向移动,c(CO)增大,c(Na+)不变,故减小,A正确。K2C2O4溶液中存在水解平衡:C2O+H2OHC2O+OH-,从25 ℃升高到35 ℃,水解平衡正向移动,c(C2O)减小,c(K+)不变,故增大,B正确。HF溶液中滴加NaOH溶液至中性,则有c(H+)=c(OH-),此时所得溶液为NaF和HF混合液,据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(F-),则有c(Na+)=c(F-),故有=1,C正确。pH=4的0.1 mol·L-1 NaHC2O4溶液中,HC2O的电离程度大于其水解程度,溶液呈酸性,则有c(C2O)>c(H2C2O4),D错误。
5.D 向氯化铵溶液中加入NaOH固体,水的电离受到抑制,故M点溶液中水的电离程度比原溶液小,A项错误;随着NaOH的加入,NH逐渐转化为NH3·H2O,根据物料守恒可知,NH与NH3·H2O的总物质的量不变,B项错误;当原溶液中加入0.05 mol NaOH时,得到等物质的量浓度的NaCl、NH4Cl和NH3·H2O的混合溶液,由于NH3·H2O的电离程度大于NH的水解程度,故c(NH)>0. 05 mol·L-1,溶液中c(Cl-)>c(NH)>c(Na+)>c(OH-)>c(H+),C项错误;在M点时,根据电荷守恒有n(OH-)+n(Cl-)=n(Na+)+n(H+)+n(NH),将n(Cl-)=0.1 mol、n(Na+)=a mol、n(NH)=0.05 mol代入上式可得n(OH-)+0.05 mol=a mol+n(H+),D项正确。
6.C 滴定前为碱溶液,碱的电离抑制水的电离,恰好完全反应时生成强酸弱碱盐,弱碱根离子水解促进水的电离,故从反应开始至恰好完全反应,水电离出的c(H+)始终增大,
A项正确;滴定至P点时,得到等物质的量浓度的BOH、BCl的混合溶液,溶液呈碱性,说明BOH的电离程度大于B+的水解程度,故c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+),B项正确;根据图示,用盐酸滴定三种碱溶液至pH=7时,消耗盐酸的体积不同,故三种溶液中c(Cl-)不同,因此c(A+)、c(B+)、c(D+)互不相等,C项错误;当盐酸体积为50 mL时,将三种溶液混合后得到等物质的量浓度的ACl、BCl、DCl的混合溶液,根据质子守恒,可得:c(H+)=c(AOH)+c(BOH)+c(DOH)+c(OH-),D项正确。
7.D 随着pH逐渐增大,曲线X对应的含碳微粒的物质的量分数逐渐减小,曲线Y对应的含碳微粒的物质的量分数先增大后减小,曲线Z对应的含碳微粒的物质的量分数逐渐增大,故曲线X对应的含碳微粒为H2CO3,曲线Y对应的含碳微粒为HCO,曲线Z对应的含碳微粒为CO,A项错误;pH=6.3时,一部分含碳微粒以CO2的形式逸出溶液,故α(CO)+α(HCO)+α(H2CO3)<1.0,B项错误;pH=7.0时,由题图可知c(HCO)>c(H2CO3)>c(CO),C项错误;pH=10.3时,根据溶液呈电中性可知,c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(HCO)+2c(CO),由题图可知,pH=10.3时,c(HCO)=c(CO),故c(Na+)+c(H+)=c(Cl-)+c(OH-)+3c(HCO),D项正确。
8.AD 任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-),选项A正确;当混合溶液体积为20 mL时,二者恰好反应生成NaHCO3,HCO的电离程度小于其水解程度,所以其溶液呈碱性,要使混合溶液呈中性,则酸稍微过量,所以混合溶液体积稍微大于20 mL,选项B错误;溶液呈碱性,由图可知HCO的物质的量分数最大,溶质以碳酸氢钠为主,溶液呈碱性,阳离子有钠离子和氢离子,而氢离子是水微弱电离出来的,所以钠离子的浓度远大于氢离子的浓度,而HCO的浓度最多接近于钠离子浓度,故钠离子浓度最大,选项C错误;根据图像分析,A点为碳酸钠和碳酸氢钠的混合溶液,且c(HCO)=c(CO),溶液呈碱性,则c(OH-)>c(H+),盐溶液水解程度较小,所以c(CO)>c(OH-),则离子浓度大小顺序是c(HCO)=c(CO)>c(OH-)>c(H+),选项D正确。
9.CD 结合图像可知加入0~30 mL NaOH溶液时Al3+与OH-生成沉淀,加入30 mL NaOH溶液时Al3+恰好沉淀完全,加入30~40 mL NaOH溶液时NH与OH-生成NH3·H2O,A项正确;a点到b点过程中,溶液pH增大,c(H+)减小,故=逐渐增大,B项正确;结合Al3+与OH-的反应和NaOH溶液为0.6 mol·L-1,可知NH4Al(SO4)2溶液的浓度为0.6 mol·L-1,对于a点,溶液中c(NH)≈0.15 mol·L-1,根据NH+H2ONH3·H2O+H+和c(H+)=c(NH3·H2O)=10-5 mol·L-1,可求出NH的水解平衡常数Kh=,故Kb(NH3·H2O)==1.5×10-5,C项错误;当加入30 mL NaOH溶液时,所得溶液为Na2SO4和(NH4)2SO4的混合溶液,此时溶液呈酸性,当加入40 mL NaOH溶液时,所得溶液为NH3·H2O和Na2SO4的混合溶液,此时溶液呈碱性,故pH=7的溶液中NH大部分转化为NH3·H2O,加入的NaOH溶液的体积介于30~40 mL,溶液中c(Na+)>c(SO)>c(NH),D项错误。
10.B 醋酸溶液中加冰醋酸则平衡正移,醋酸的电离度减小,酸性增强;醋酸溶液中加水稀释,则平衡正移,醋酸的电离度增大,酸性减弱,所以A错误;酸性:CH3COOH>H2CO3>HClO,同浓度时,pH大小为①<②<③,现在三种溶液pH相等,所以三种溶液浓度排序:①>②>③,所以B正确;根据电荷守恒:c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-),物料守恒:2c(Na+)=3[c(HCO)+c(CO)+c(H2CO3)],合并得2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO)-c(CO),所以C错误;根据电荷守恒:NaCl溶液中c(Na+)+c(H+)=c(OH-)+c(Cl-);NaF溶液中c(Na+)+c(H+)=c(OH-)+c(F-),所以计算离子浓度大小时,只需看阳离子浓度大小即可,两份溶液c(Na+)相等,后者水解显碱性,c(H+)小,所以后者离子浓度之和更小,D错误。
11.答案:(1)SO+H2OHSO+OH-
(2)= <
(3)BaSO4 升温过程中部分SO被氧化为SO
(4)浓度
解析:(1)Na2SO3是强碱弱酸盐,SO水解使溶液显碱性,其离子方程式为SO+H2OHSO+OH-。(2)水的离子积常数Kw只与温度有关,由于①和④的温度相同,故二者Kw相同;盐的水解为吸热反应,升高温度,盐的水解平衡右移,Kh增大,故Kh的关系为①<②。(3)升高温度的过程中部分SO被氧化为SO,SO与Ba2+反应生成BaSO4白色沉淀,且BaSO4不溶于稀盐酸,故④中产生的白色沉淀比①中多。(4)①→③的过程中,温度升高,水解平衡右移,而升温过程中,部分SO被氧化为SO,SO浓度减小,水解平衡左移,由题表知,①→③溶液pH降低,说明浓度对水解平衡移动方向的影响程度更大。
12.答案:(1)①1×10-14 1×10-3 ②= 1×10-3
(2)温度升高,NH、Al3+的水解平衡正向移动,溶液中c(H+)增大
(3)①d ②H++OH-===H2O
③c(H+)>c(SO)>c(NH)>c(OH-)
解析:(1)①水的离子积常数与温度有关,与溶液的酸碱性无关,故常温时,水的离子积常数Kw=1×10-14。NH4Al(SO4)2溶液的pH=3,该溶液中H+全部来源于水的电离,故由水电离出的c(H+)=1×10-3 mol·L-1。
②NH4Al(SO4)2溶液中,NH、Al3+均发生水解反应,据物料守恒可得c(NH)+c(NH3·H2O)=c(Al3+)+c[Al(OH)3]。据电荷守恒可得2c(SO)+c(OH-)=c(NH)+3c(Al3+)+c(H+),则有2c(SO)-c(NH)-3c(Al3+)=c(H+)-c(OH-)=1×10-3 mol·L-1-1×10-11 mol·L-1≈1×10-3 mol·L-1。
(2)NH4Al(SO4)2溶液中存在NH、Al3+的水解平衡,而盐类水解是吸热反应,温度升高,水解平衡正向移动,溶液中c(H+)增大,故溶液的pH减小。
(3)①NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,先后发生反应的离子方程式为H++OH-===H2O、NH+OH-===NH3·H2O,a点V(NaOH)=100 mL,恰好完全中和H+,此时溶液所含溶质为(NH4)2SO4和Na2SO4,NH发生水解反应而促进水的电离;b、c两点溶液所含溶质均为(NH4)2SO4、Na2SO4和NH3·H2O,且c点时c(NH3·H2O)大于b点,由于NH3·H2O的存在抑制水的电离,则c点水的电离程度小于b点;d点NH4HSO4与NaOH溶液恰好完全反应,所含溶质为Na2SO4和NH3·H2O,此时c(NH3·H2O)较大,抑制水的电离,则四点中水的电离程度大小关系为a>b>c>d,其中水的电离程度最小的是d点。
②向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,H+与OH-发生反应,离子方程式为H++OH-===H2O。
③NH4HSO4溶液中,由电荷守恒可得2c(SO)+c(OH-)=c(H+)+c(NH),由物料守恒可得c(SO)=c(NH)+c(NH3·H2O),则c(SO)>c(NH),即得c(H+)>c(SO)+c(OH-),故各离子浓度由大到小的排列顺序为c(H+)>c(SO)>c(NH)>c(OH-)。
13.答案:(1)CH3COO-+H2OCH3COOH+OH-,H2OH++OH-
(2)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
(3) 2.89
(4)C (5)BC
(6)< c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
(7)> <
解析:本题考查电离平衡、酸碱中和反应、盐类的水解、离子浓度的比较等。
(1)CH3COONa溶液中存在CH3COO-的水解平衡和H2O的电离平衡:CH3COO-+H2OCH3COOH+OH-,H2OH++OH-。
(2)在0.1 mol·L-1 CH3COONa溶液中,CH3COO-发生水解而使溶液呈碱性,则有c(OH-)>c(H+);据电荷守恒可得:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),则有c(Na+)>c(CH3COO-),故离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
(3)醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,则电离平衡常数表达式为Ka=。0.10 mol·L-1的醋酸溶液中,c(H+)≈c(CH3COO-),c(CH3COOH)≈0.10 mol·L-1,则有Ka(CH3COOH)=≈=
=1.69×10-5,解得c(H+)≈1.3×10-3 mol·L-1,故pH=-lg(1.3×10-3)=3-lg 1.3=3-0.114≈2.89。
(4)加水稀释或升高温度,醋酸的电离平衡和醋酸钠的水解平衡均正向移动,则醋酸的电离程度、醋酸钠的水解程度均增大,A、B错误;醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解,醋酸钠抑制醋酸的电离,C正确。
(5)物质的量浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合,据电荷守恒可得:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),根据物料守恒有2c(Na+)=c(CH3COOH)+c(CH3COO-),综合以上式子可得2c(H+)+c(CH3COOH)=c(CH3COO-)+2(OH-),A错误,B正确。据物料守恒可得:c(CH3COO-)+c(CH3COOH)=2c(Na+)=0.1 mol·L-1,C正确。
(6)常温时,pH=3的醋酸和pH=11的NaOH溶液等体积混合,发生中和反应后,醋酸剩余,所得溶液呈酸性,则有c(H+)>c(OH-);据电荷守恒可得:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),从而推知:c(Na+)n。由于醋酸是弱电解质,部分电离,NaOH是强电解质,完全电离,若醋酸中c(H+)等于NaOH溶液中c(OH-),混合后醋酸远远过量,故醋酸溶液中c(H+)小于NaOH溶液中c(OH-)。