- 2021-05-11 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山西省忻州一中2019-2020学年高二下学期期中考试化学试题
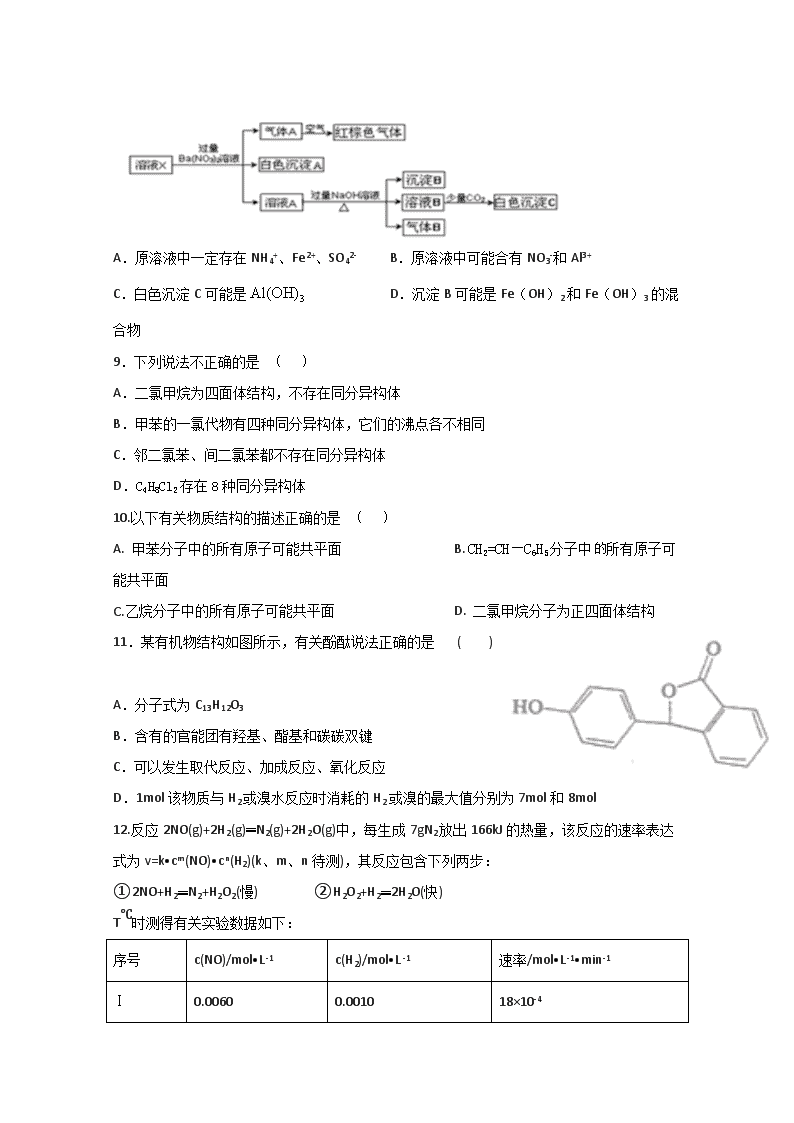
2019—2020学年第二学期高二月考化学试题 本试题分第Ⅰ卷和第Ⅱ卷两部分,满分100分,考试时间90分钟。第Ⅰ卷为选择题,第Ⅱ卷为非选择题。 注意事项: 1.答题前,考生务必用蓝、黑色墨水笔或圆珠笔将班级、姓名、考号填写在试卷上。 2.请把所有做在试卷上,交卷时只交试卷,不交试题,写在试题上无效。 相对原子质量:(H 1 C 12 O16 N14 Na 23 Cl 35.5 K 39 I 127 ) 第Ⅰ卷 选择题 一、选择题(每小题3分,共48分。每小题只有一个正确选项,将正确答案填在答题卡上) 1.化学与生活、社会密切相关,下列说法正确的是 ( ) A.通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2 B.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 C.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 D.以“地沟油”为原料生产的生物柴油与以“石油”为原料生产的柴油化学成分相似 2. 下列化学用语表示正确的是 ( )。 A. Cl-的结构示意图: B. 甲烷分子的球棍模型: C. 氢氧化钠的电子式: D. 次氯酸的结构式:H—O—Cl 3.设NA为阿伏加德罗常数的值,下列说法正确的是 ( ) A. 2.0gH218O与D2O的混合物中所含中子数为NA B. 常温常压下,4.4g乙醛所含σ键数目为0.7NA C. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA D. 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA 4.下列有关物质性质的叙述错误的是 ( ) A.将过量氨气通入CuSO4溶液中可得深蓝色溶液 B.蛋白质溶于水所得分散系可产生丁达尔效应 C.硅酸钠溶液与稀盐酸反应可生成硅酸胶体 D.过量铁粉在氯气中燃烧可生成氯化亚铁 5.反应A(g)+2B(g)C(g)的反应过程中能量变化如图所示。下列相关说法正确的是 ( ) A. 正反应活化能大于逆反应活化能 B. 曲线b表示使用催化剂后的能量变化 C. 由图可知该反应的焓变△H=+91kJ·mol-1 D. 将气体A换为固体,其他条件不变,反应放出热量大于91kJ 6.实验是化学研究的基础,关于下列各实验装置的叙述中正确的是 ( ) A.装置①常用于分离互不相溶液体混合物 B.装置②可用于吸收HCl气体,并防止倒吸 C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3 D.装置④b口进气,用排空气法可收集CO2、NO等气体 7.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于I A族,W与X属于同一主族。下列说法正确的是 ( ) A. 元素X、W的简单阴离子具有相同的电子层结构 B. W的简单气态氢化物的热稳定性比Y的强 C. 由Y、Z两种元素组成的化合物是离子化合物 D. 简单离子半径:r(X)<r(W)<r(Z)<r(Y) 8.某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32-、SO42-、Cl-、NO3-中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对X溶液进行如下实验,下列结论正确的是( )(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L) A.原溶液中一定存在NH4+、Fe2+、SO42- B.原溶液中可能合有NO3-和Al3+ C.白色沉淀C可能是 D.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物 9.下列说法不正确的是 ( ) A.二氯甲烷为四面体结构,不存在同分异构体 B.甲苯的一氯代物有四种同分异构体,它们的沸点各不相同 C.邻二氯苯、间二氯苯都不存在同分异构体 D.C4H8Cl2存在8种同分异构体 10.以下有关物质结构的描述正确的是 ( ) A. 甲苯分子中的所有原子可能共平面 B. CH2=CH—C6H5分子中所有原子可能共平面 C.乙烷分子中的所有原子可能共平面 D. 二氯甲烷分子为正四面体结构 11.某有机物结构如图所示,有关酚酞说法正确的是 ( ) A.分子式为C13H12O3 B.含有的官能团有羟基、酯基和碳碳双键 C.可以发生取代反应、加成反应、氧化反应 D.1mol该物质与H2或溴水反应时消耗的H2或溴的最大值分别为7mol和8mol 12.反应2NO(g)+2H2(g)═N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k•cm(NO)•cn(H2)(k、m、n待测),其反应包含下列两步: ①2NO+H2═N2+H2O2(慢) ②H2O2+H2═2H2O(快) T℃时测得有关实验数据如下: 序号 c(NO)/mol•L-1 c(H2)/mol•L-1 速率/mol•L-1•min-1 Ⅰ 0.0060 0.0010 18×10-4 Ⅱ 0.0060 0.0020 3.6×10-4 Ⅲ 0.0010 0.0060 3.0×10-5 Ⅳ 0.0020 0.0060 1.2×10-4 下列说法错误的是 ( ) A. 整个反应速度由第①步反应决定 B. 正反应活化能一定是①<② C. 该反应速率表达式:v=5000c2(NO)•c(H2) D. 该反应的热化学方程式为2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=—664kJ•mol-1 13.有可逆反应Fe(s)+CO2(g)FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。则下列说法不正确的是 ( ) A. 该反应的平衡常数表达式为K=c(CO)/c(CO2) B. 该反应的逆反应是放热反应 C. v正(CO2)=v逆(CO)时该反应达到平衡状态 D. c(CO2):c(CO)=1:1时该反应达到平衡状态 14.下列实验操作对应的实验现象及解释或结论都正确的是 ( ) 选项 实验操作 实验现象 解释或结论 A 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 溶液变为黄色 氧化性:H2O2>Fe3+ B 向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液 先产生白色沉淀,然后产生蓝色沉淀 Ksp[Cu(OH)2] >Ksp[Mg(OH)2] C 将充满NO2的密闭玻璃球浸泡在热水中 红棕色变深 2NO2(g)N2O4(g) ΔH<0 D 向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) 溶液紫色褪去 乙二醇被氧化为乙二酸 A. A B. B C. C D. D 15.以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图。下列说法正确的是 ( ) A.a电极为太阳能电池的正极 B.产生丙烯的电极反应式为: 3CO2+18H++18e— == 6H2O+CH3CH=CH2 C.装置中每转移2mole-,理论上有2molH+通过质子交换膜从左向右扩散 D.太阳能电池的原理与原电池的原理相同 16.25℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是 ( ) A.Ka(HA)=1×10-6 B.b点c(B+)=c(A-)=c(OH-)=c(H+) C.a→c过程中水的电离程度始终增大 D.c点时,c(A-)/[c(OH-)c(HA)]随温度升高而减小 第Ⅱ卷 非选择题(共52分) 17. (13分)高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题: (1)装置I中盛放浓盐酸的仪器名称是___________。 (2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________。 (3)装置Ⅱ中的试剂X的作用___________。 (4)上述炭置按气流由左至右各接口顺序为___________(用字母表示)。 (5)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析岀高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。 ①写出装置Ⅲ中发生反应的化学方程式:___________。 ②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________。 ③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取ag该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为bL。 已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O I2+2Na2S2O3===2NaI+N2S4O6 则该产品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。 18.(11分)研究CO2的利用对促进低碳社会的构建具有重要的意义。 (1)将CO2与焦炭作用生成CO,CO可用于炼铁等。 已知:Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1 C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1 则CO还原Fe2O3的热化学方程式为___________________________ (2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同温度条件下反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1 测得CH3OH的物质的量随时间变化如图所示,回答问题: ①该反应的平衡常数表达式K=_______________; ②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为:KⅠ_________KⅡ(填“>”、“=”或“<”)。 ③下列措施中能增大CO2转化率的是____________。(填序号) A.升高温度 B.充入He(g)使体系压强增大 C.将H2O(g)从体系中分离 D.再充入一定量CO2 ④下列图像正确且能表明在t时刻反应一定处于平衡状态的是__________。(填序号) 19(12分).已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题: (1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表: 溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN C6H5ONa pH 8.8 9.7 11.6 10.3 11.1 11.3 ①上述盐溶液中的阴离子,结合质子能力最强的是______________ ②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是____________;(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是__________ A HCN B HClO C C6H5OH D CH3COOH E H2CO3 ③据上表数据,请你判断下列反应不能成立的是 (填编号)。 A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH ④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为 (2)CaCO3是一种难溶物质,其KSp=2.8×l0-9。现将浓度为2×l0-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为___________mol/L。 20.(16分).东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题: (1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。 (2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。 ①[Ni(NH3)6]SO4中阴离子的立体构型是_____。 ②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。 ③氨的沸点_____(“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。 (3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1958kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。 (4)某镍白铜合金的立方晶胞结构如图所示。 ①晶胞中铜原子与镍原子的数量比为_____。 ②若合金的密度为dg/cm3,晶胞参数a=________nm。 2019—2020学年第二学期高二月考化学试题 答案CDADB CCADB CBDCB D 17、(13分) (1)分液漏斗(1分) (2)16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑(2分) (3)处理尾气氯气(2分) (4) aefcdb (2分) (5) ①2KOH+KIO3+Cl2KIO4+2KCl+ H2O (2分) ②降低KIO4的溶解度,减少晶体损失(2分)③ 100% (2分) 18.(11分) (1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-28.5 kJ·mol-1(3分) (2)① (2分) ②>(2分) ③C (2分) ④BC(2分) 19.(12分) (1)①CO32 -(2分) ②D(2分);C(2分) ③CD(2分) ④2Cl2+CO32 -+H2O=CO2↑+2Cl-+2HClO。(2分) (2)5.6×10-5(2分) 20.(16分) (1)1s22s22p63s23p63d84s2或[Ar]3d84s2(1分) 2 (1分) (2) ①正四面体(1分) ②配位键(1分) N (1分) ③高于 (1分) NH3分子间可形成氢键(2分) 极性(1分) sp3 (1分) (3)金属(1分) 铜失去的是全充满的3d10电子,镍失去的是4s1电子(2分) (4)3:1 (1分) (2分)查看更多