2020届二轮复习分子结构与性质课件(46张)(全国通用)
第
2
讲 分子结构与性质
【考纲点击】
1.
化学键与分子结构:
(1)
理解离子键的形成,能根据离子化合物的结构特征解释其物理性质;
(2)
了解共价键的形成、极性、类型
(σ
键和
π
键
)
,了解配位键的含义;
(3)
能用键能、键长、键角等说明简单分子的某些性质;
(4)
了解杂化轨道理论及简单的杂化轨道类型
(sp
、
sp
2
、
sp
3
)
;
(5)
能用价层电子对互斥理论或杂化轨道理论推测简单分子或离子的空间结构。
2.
分子间作用力与物质的性质:
(1)
了解范德华力的含义及对物质性质的影响;
(2)
了解氢键的含义,能列举存在氢键的物质,并能解释氢键对物质性质的影响。
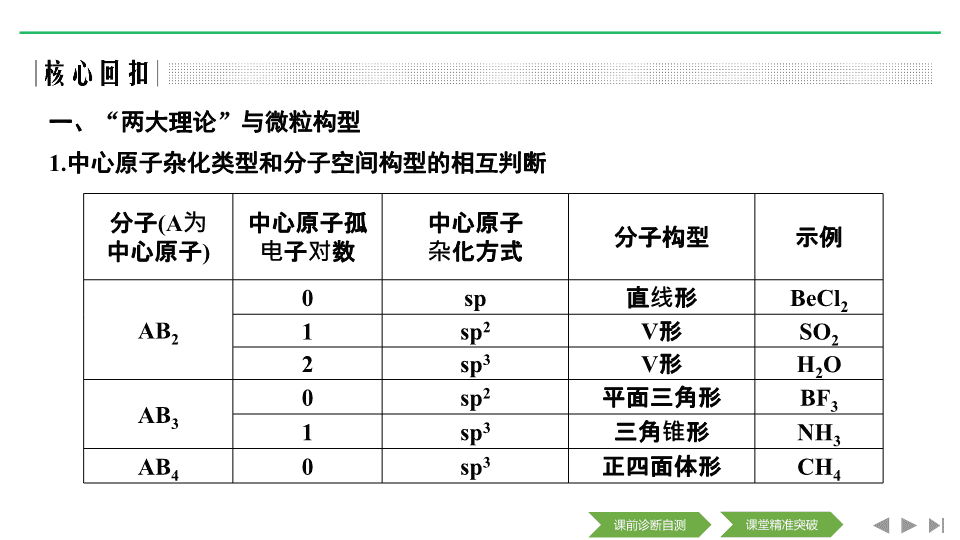
一、
“
两大理论
”
与微粒构型
1
.
中心原子杂化类型和分子空间构型的相互判断
分子
(A
为
中心原子
)
中心原子孤
电子对数
中心原子
杂化方式
分子构型
示例
AB
2
0
sp
直线形
BeCl
2
1
sp
2
V
形
SO
2
2
sp
3
V
形
H
2
O
AB
3
0
sp
2
平面三角形
BF
3
1
sp
3
三角锥形
NH
3
AB
4
0
sp
3
正四面体形
CH
4
2.
等电子原理
(1)
等电子体特征
原子总数相同、价电子总数相同的分子或离子具有相似的化学键特征。物理性质相似,化学性质不同。
(2)
常见等电子体
二、分子结构与性质
1
.
共价键
(1)
共价键的类型
①
按成键原子间共用电子对的数目分为单键、双键、三键。
②
按共用电子对是否偏移分为极性键、非极性键。
③
按原子轨道的重叠方式分为
σ
键和
π
键。
(2)
键参数
①
键能:气态基态原子形成
1 mol
化学键释放的最低能量,键能越大,化学键越稳定。
②
键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳定。
③
键角:在原子数超过
2
的分子中,两个共价键之间的夹角。
④
键参数对分子性质的影响
键长越短,键能越大,分子越稳定。
(3)σ
键、
π
键的判断
①
由轨道重叠方式判断
“
头碰头
”
重叠为
σ
键,
“
肩并肩
”
重叠为
π
键。
②
由共用电子对数判断
单键为
σ
键;双键或三键,其中一个为
σ
键,其余为
π
键。
③
由成键轨道类型判断
s
轨道形成的共价键全部是
σ
键;杂化轨道形成的共价键全部为
σ
键。
2.
配位键与配合物
3.
分子性质
(1)
分子构型与分子极性的关系
(2)
溶解性
①“
相似相溶
”
规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂,若存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
②“
相似相溶
”
还适用于分子结构的相似性,如乙醇和水互溶,而戊醇在水中的溶解度明显减小。
(3)
无机含氧酸分子的酸性
无机含氧酸可写成
(
HO)
m
RO
n
,如果成酸元素
R
相同,则
n
值越大,
R
的正电性越高,使
R—O—H
中
O
的电子向
R
偏移,在水分子的作用下越易电离出
H
+
,酸性越强,如
HClO
氢键
>
范德华力
影响强度的因素
①
随着分子极性和相对分子质量的增大而增大
②
组成和结构相似的物质,相对分子质量越大,范德华力越大
对于
A—H
…
B—
,
A
、
B
的电负性越大,
B
原子的半径越小,氢键键能越大
成键原子半径越小,键长越短,键能越大,共价键越稳定
对物质性质的影响
①
影响物质的熔沸点、溶解度等物理性质
②
组成和结构相似的物质,随相对分子质量的增大,物质的熔沸点升高
分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大
①
影响分子的稳定性,共价键键能越大,分子稳定性越强
②
影响原子晶体的熔沸点、硬度
角度一
“
两大理论
”
与微粒构型
1.(1)
[2019·
课标全国
Ⅰ
,
35(2)]
乙二胺
(H
2
NCH
2
CH
2
NH
2
)
是一种有机化合物,分子中氮、碳的杂化类型分别是
________
、
________
。乙二胺能与
Mg
2
+
、
Cu
2
+
等金属离子形成稳定环状离子,其原因是
____________________________
______________________________________________________
,
其中与乙二胺形成的化合物稳定性相对较高的是
________(
填
“
Mg
2
+
”
或
“
Cu
2
+
”
)
。
(2)
[2019·
课标全国
Ⅱ
,
35(1)]
元素
As
与
N
同族。预测
As
的氢化物分子的立体结构为
________
,其沸点比
NH
3
的
________(
填
“
高
”
或
“
低
”
)
,其判断理由是
______________________________________________________
______________________________________________________
。
答案
(1)sp
3
sp
3
乙二胺的两个
N
提供孤对电子给金属离子形成配位键
Cu
2
+
(2)
三角锥形 低
NH
3
分子间存在氢键
2.
[2018·
全国
Ⅰ
,
35(3)]
LiAlH
4
是有机合成中常用的还原剂,
LiAlH
4
中的阴离子空间构型是
________
、中心原子的杂化形式为
________
。
LiAlH
4
中存在
________(
填标号
)
。
A.
离子键
B.σ
键
C.π
键
D.
氢键
答案
正四面体
sp
3
AB
3.
[2018·
全国
Ⅱ
,
35(2)(4)]
(1)
根据价层电子对互斥理论,
H
2
S
、
SO
2
、
SO
3
的气态分子中,中心原子价层电子对数不同于其他分子的是
________________
。
(2)
气态三氧化硫以单分子形式存在,其分子的立体构型为
________
形,其中共价键的类型有
________
种;固体三氧化硫中存在如图所示的三聚分子,该分子中
S
原子的杂化轨道类型为
________
。
答案
(1)H
2
S
(2)
平面三角
2
sp
3
杂化
4.
[2018·
全国
Ⅲ
,
35(4)]
《中华本草》等中医典籍中,记载了炉甘石
(ZnCO
3
)
入药,可用于治疗皮肤炎症或表面创伤。
ZnCO
3
中,阴离子空间构型为
________
,
C
原子的杂化形式为
________
。
答案 平面三角形
sp
2
杂化
(2)
与
O
3
分子互为等电子体的一种阴离子为
________(
填化学式
)
。
(3)N
2
分子中
σ
键与
π
键的数目比
n
(σ)
∶
n
(π
)
=
________
。
(2)
[2017·
课标全国
Ⅲ
,
35(2)]
CO
2
和
CH
3
OH
分子中
C
原子的杂化形式分别为
________
和
________
。
(3)
[2016·
全国卷
Ⅰ
,
37(5)
节选
]
Ge
单晶具有金刚石结构,其中
Ge
原子的杂化方式为
________
。
(4)
[2016·
全国卷
Ⅲ
,
37(3)]
AsCl
3
分子的立体构型为
________
,其中
As
的杂化轨道类型为
________
。
答案
(1)V
形
sp
3
(2)sp
sp
3
(3)sp
3
(4)
三角锥形
sp
3
角度二 微粒作用与分子性质
7.(1)
[2019·
课标全国
Ⅲ
,
35(2)(3)]
①
FeCl
3
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
FeCl
3
的结构式为
________
,其中
Fe
的配位数为
________
。
(2)
[2018·
课标全国
Ⅱ
,
35(3)]
如图为
S
8
的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
________________________________
______________________________________________________
。
(3)
[2018·
全国卷
Ⅲ
,
35(3)]
ZnF
2
具有较高的熔点
(872
℃
)
,其化学键类型是
________
;
ZnF
2
不溶于有机溶剂而
ZnCl
2
、
ZnBr
2
、
ZnI
2
能够溶于乙醇、乙醚等有机溶剂,原因是
______________________________________________________
。
(4)[Fe(H
2
O)
6
]
2
+
与
NO
反应生成的
[Fe(NO)(H
2
O)
5
]
2
+
中,
NO
以
N
原子与
Fe
2
+
形成配位键。请在
[Fe(NO)(H
2
O)
5
]
2
+
结构示意图的相应位置补填缺少的配体。
[Fe(NO)(H
2
O)
5
]
2
+
结构示意图
(5)
[2017·
课标全国
Ⅲ
,
35(4)]
硝酸锰是制备
CO
2
+
3H
2
=== CH
3
OH
+
H
2
O
反应催化剂的原料,
Mn(NO
3
)
2
中的化学键除了
σ
键外,还存在
________
。
(6)
[2017·
课标全国
Ⅲ
,
35(3)]
研究发现,在
CO
2
低压合成甲醇反应
(CO
2
+
3H
2
―→
CH
3
OH
+
H
2
O)
所涉及的
4
种物质中,沸点从高到低的顺序为
______________________________________________________
,
原因是
______________________________________________________
。
8.
[2017·
课标全国
Ⅱ
,
35(3)]
经
X
射线衍射测得化合物
R
的晶体结构,其局部结构如图所示。
(1)
从结构角度分析,
R
中两种阳离子的相同之处为
________
,不同之处为
________
。
(
填标号
)
A.
中心原子的杂化轨道类型
B.
中心原子的价层电子对数
C.
立体结构
D.
共价键类型
9.
[2016·
课标全国
Ⅰ
,
37(2)(3)]
锗
(
Ge
)
是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge
与
C
是同族元素,
C
原子之间可以形成双键、三键,但
Ge
原子之间难以形成双键或三键。从原子结构角度分析,原因是
____________________
。
(2)
比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
______________________________________________________
。
GeCl
4
GeBr
4
GeI
4
熔点
/
℃
-
49.5
26
146
沸点
/
℃
83.1
186
约
400
答案
(1)
锗的原子半径大,原子之间形成的
σ
单键较长,
p
-
p
轨道肩并肩重叠的程度很小或几乎不能重叠,难以形成
π
键
(2)GeCl
4
、
GeBr
4
、
GeI
4
的熔、沸点依次增高。原因是分子结构相似,相对分子质量依次增大,分子间作用力逐渐增强
10.
[2016·
课标全国
Ⅱ
,
37(2)]
硫酸镍溶于氨水形成
[Ni(NH
3
)
6
]SO
4
蓝色溶液。
①
[Ni(NH
3
)
6
]SO
4
中阴离子的立体构型是
________
。
②
在
[Ni(NH
3
)
6
]
2
+
中
Ni
2
+
与
NH
3
之间形成的化学键称为
________
,提供孤电子对的成键原子是
________
。
③
氨的沸点
________(
填
“
高于
”
或
“
低于
”
)
膦
(PH
3
)
,原因是
________
;氨是
________
分子
(
填
“
极性
”
或
“
非极性
”
)
,中心原子的轨道杂化类型为
________
。
答案
①
正四面体
②
配位键
N
③
高于
NH
3
分子间可形成氢键 极性
sp
3
1.(1)
“
分子机器设计和合成
”
的研究对象之一为
“
分子开关
”
,
“
分子开关
”
与大环主体分子苯芳烃、杯芳烃等有关。
①
上图为对叔丁基杯
[4]
芳烃,由
4
个羟基构成杯底,羟基间的相互作用力是
________
。对叔丁基杯
[4]
芳烃中碳原子的杂化方式有
________
。
②
杯芳烃可用于某些
Ⅲ
B
族元素金属离子如
57
La
3
+
及
21
Sc
2
+
的萃取,基态
Sc
2
+
核外电子排布式为
________
。
(2)SO
2
与
SO
3
的键角相比,键角更大的是
________
,将纯液态
SO
3
冷却到
289.8 K
时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态
SO
3
中
S
原子的杂化轨道类型是
________
。该结构中
S—O
键键长有两类,一类键长约
140 pm
,另一类键长约为
160 pm
,较短的键为
________(
填图中字母
)
。
解析
(1)
①
O
的非金属性很强,在羟基之间存在氢键;对叔丁基杯
[4]
芳烃中含有苯环和饱和烃基,故碳原子的杂化方式有
sp
2
和
sp
3
;
②
Sc
是
21
号元素,
Sc
原子核外有
21
个电子,失去
2
个电子变成
Sc
2
+
,根据构造原理可知
Sc
2
+
核外电子排布式为
1s
2
2s
2
2p
6
3s
2
3p
6
3d
1
或
[Ar]3d
1
。
(2)SO
2
中
S
原子采取
sp
2
杂化,含有一对孤对电子,分子构型为
V
形,
SO
3
中
S
原子采取
sp
2
杂化,无孤对电子,分子构型为平面三角形,孤对电子与成键电子对间的排斥作用大于成键电子对间的排斥作用,故
SO
3
的键角大于
SO
2
;由图可知,该固态
SO
3
中
S
原子形成
4
个
σ
键,无孤对电子,采取
sp
3
杂化,
a
为氧硫双键,键能较大,键长较短,另一类为配位键,为单键,键能较小,键长较长,即较短的键为
a
答案
(1)
①
氢键
sp
2
、
sp
3
②
1s
2
2s
2
2p
6
3s
2
3p
6
3d
1
或
[Ar]3d
1
(2)SO
3
sp
3
a
2.(1)BF
3
与一定量的水形成晶体
Q[(H
2
O)
2
·BF
3
]
,
Q
在一定条件下可转化为
R
:
晶体
Q
中各种微粒间的作用力不涉及
________(
填序号
)
。
a.
离子键
b.
共价键
c.
配位键
d.
金属键
e.
氢键
f.
范德华力
3.
碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(4)
偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈图所示的无限链状结构,则偏钒酸铵的化学式为
________
。