- 2021-05-11 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年内蒙古集宁一中高一下学期期中考试化学试题
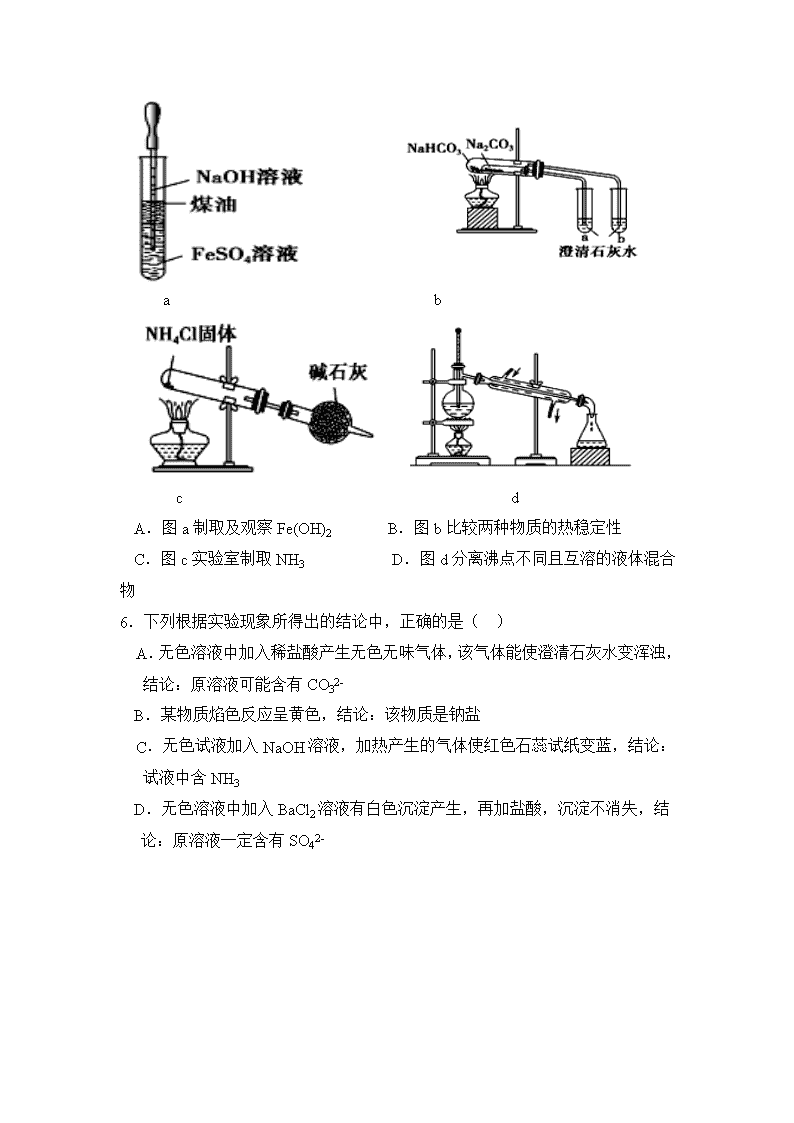
2018-2019学年内蒙古集宁一中高一下学期期中考试化学试题 本试卷满分100分,考试时间100分钟 第一卷(选择题 共42分) (相对原子质量C-12 O-16 S-32 Fe-56 Cu-64 ) 一、 选择题(在下列各题的四个选项中,只有一项是最符合题意的,每小题 3分,共42分。) 1.对下列污染现象叙述错误的是( ) A.臭氧空洞的形成主要与SO2有关 B.酸雨的形成主要与SO2有关 C.光化学烟雾的形成主要与NO2等有关 D.水体富营养化的形成主要与含磷污水的排放有关 2.NA表示阿伏伽德罗常数。下列说法正确的是 A.44 g 14CO2中氧原子数目为2NA B.56 g铁片投入足量浓H2SO4中,电子转移数目为2NA C.32 g硫在足量的纯氧中燃烧,生成NA个SO2分子 D.1 mol的铁分别于足量的氧气、氯气和硫完全反应转移的电子数目均为2NA 3.下列关于化学键的叙述中,正确的是 ( ) A.氢键是一种特殊的共价键 B.离子化合物中可能含有共价键 C.I2的挥发破坏了共价键 D.非极性键只能存在双原子单质中 4.某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是 ( ) A.肯定有SO2和NO B.肯定没有O2和NO2,可能有Cl2 C.可能有Cl2和O2 D.肯定只有NO 5.关于下列各装置图的叙述中,正确的是( ) a b c d A.图a制取及观察Fe(OH)2 B.图b比较两种物质的热稳定性 C.图c实验室制取NH3 D.图d分离沸点不同且互溶的液体混合物 6.下列根据实验现象所得出的结论中,正确的是( ) A.无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液可能含有CO32- B.某物质焰色反应呈黄色,结论:该物质是钠盐 C.无色试液加入NaOH溶液,加热产生的气体使红色石蕊试纸变蓝,结论:试液中含NH3 D.无色溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,结论:原溶液一定含有SO42- 7.已知X+结构示意图如下图,则X在周期表中的位置是( ) A.第二周期0族 B.第四周期ⅠA族 C.第三周期ⅠA族 D.第三周期ⅦA族 8.下列有关物质所含化学键类型和化合物类型判断完全正确的一组是 ( ) A.Na2O2 离子键 离子化合物 B.MgCl2 离子键、共价键 离子化合物 C.F2 共价键 共价化合物 D.NaOH 离子键、共价键 离子化合物 9.短周期元素A和B,其中A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两种元素形成的化合物的化学式可能表示为( ) A.B3A2 B.AB2 C.A3B2 D.BA2 10.下列有关化学用语的表示方法中正确的是 A.次氯酸的电子式: B.M2+离子核外有a个电子,b个中子,M原子符号为 C.用电子式表示MgCl2的形成过程为: D.Na+的结构示意图: 11.CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是( ) A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为2:3 B.利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mL C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③ D.与途径①、③相比,途径②更好地体现了绿色化学思想 12.下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是 A.气态氢化物的稳定性:R>W B.X与Y可以形成原子个数比为1:1和1:2的两种离子化合物 C.由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2- D.Y和Z两者最高价氧化物对应的水化物能相互反应 13.下列热化学方程式和结论之间的关系正确的是( ) A.常温常压下,1g H2在足量Cl2中燃烧生成HCl放出92.3kJ的热量,则热化学方程式可表示为H2(g)+Cl2(g)=2HCl(g)△H= -184.6kJ B.甲烷的燃烧热为890.3kJ·mol-1则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1 C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1,则1molNaOH的稀溶液与足量的稀盐酸完全中和,其中和热为57.3kJ·mol-1 D.500℃.30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g) △H= -38.6kJ·mol-1 14.某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是( ) A.溶液中的阳离子只有H+、Mg2+、Al3+ B.溶液中n(NH4+)=0.2mol C.溶液中可能含CO32-、SO42-、NO3- D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1 第二卷 (非选择题 共58分) 15.(12分)(1)下列反应中,属于放热反应的是 ______ ,属于吸热反应的是 ______ (填序号) ①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 ⑦灼热的木炭与CO2反应 写出Ba(OH)2·8H2O晶体与NH4Cl晶体反应的化学反应方程式: _________. (2)已知下列各种共价键的键能:C—H:a kJ· mol-1、O—H:b kJ· mol-1、O=O:c kJ·mol-1、C=O:d kJ·mol-1。写出甲烷气体完全燃烧生成CO2气体和气体水的热化学方程式:_________________________________ (3)1L 1mol/L H 2SO 4溶液与 2L 1mol/L NaOH溶液完全反应,放出 114.6kJ的热量,该反应的中和热为 _________,表示其中和热的热化学方程式为 。 16.(20分)已知A、B、C、D、E为原子序数依次增大的5种短周期元素。A是最轻的金属,B的最低负化合价的绝对值比最高正化合价少2,C的简单阴离子C2-与氖原子有相同的电子层结构,D与A同主族,E的M层电子数比L层少2个。 (1)写出元素符号:A______、C_______, (2)C、D、E原子半径由大到小:_________________(写元素符号,后同),C、D、E简单离子的半径由大到小:__________________; (3)A常用作电池的电极材料,含A的电池通常采用非水电解质或固体电解质,原因是________________________ (用化学方程式解释); (4)B与氢元素可以形成10电子微粒X和18电子微粒Y,Y是一种良好的火箭燃料。X中含有的共价键类型是_______________,Y的电子式为_________; (5)C的两种单质在常温下都是气体,它们互为____________。比较C的氢化物和E的氢化物沸点:C___E(填“>”“<”或“=”),原因是__________________。 (6)用电子式表示D与E的二元化合物的形成过程:___________________________,碳原子与E能形成AB2 型化合物,请写出该物质的电子式:_________。 17.(8分)X、Y、Z均为短周期元素组成的物质,其转化关系如下: 请回答: (1)若X为淡黄色固体,Z是单质。 ①组成Z的元素在周期表中的位置是_________。 ②取少量X与水反应,下列叙述正确的是_____(填字母)。 a.该反应是氧化还原反应 b.向反应后的溶液中滴加酚酞试剂,溶液变红 c.当有1 molX参加反应时,共转移2mol电子 (2)若X由两种元素组成,其中一种元素的最外层电子数比电子层数多3,另一种是地壳中含量最多的元素。Y与X的组成元素相同。 ①X与水反应的化学方程式为________________________。 ②X与O2混合通入水中,恰好生成4molZ,则通入的X为____mol,O2为____mol。 18.(18分)实验室利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2)。所用的反应装置如下图所示(部分夹持装置省略)。 已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯:Cl2(g)+SO2(g)SO2Cl2(l),实验装置如图所示 (1)化合物SO2Cl2中S元素的化合价为__________。 (2)仪器c的名称是_________,c中通入冷水的作用是___________ (3)由仪器c的使用可知SO2与Cl2的反应ΔH____0(填“<”或“>”),仪器d 的作用是________________________。 (4)采用上述部分装置获得干燥的原料气Cl2与SO2。装置e中所盛放的溶液为_____________(填溶液的名称)。 (5)SO2Cl2遇水能发生剧烈的水解反应,会产生白雾,则SO2Cl2发生水解反应的化学方程式为_______________________。 (6)反应结束后,将仪器b里的混合物分离的方法是______, 若反应中消耗氯气的体积为1.12L(已转化为标准状况,SO2足量),最后通过蒸馏得到纯净的磺酰氯5.13g,则磺酰氯的产率为___(保留三位有效数字)。 (7)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_____(填序号)。[来源:学_科_网] ①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快 ③若三颈瓶发烫,可适当降温 ④加热三颈瓶查看更多