- 2021-05-11 发布 |
- 37.5 KB |
- 29页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
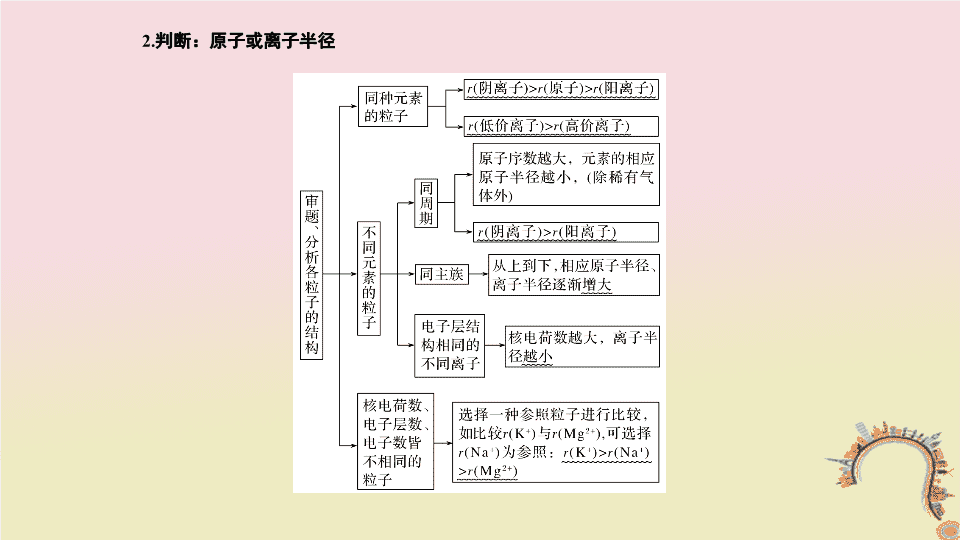
2018届高考二轮复习人教版高频考点精讲元素周期律元素周期表课件(29张)
高频考点 七 元素周期律 元素周期表 1 . 记忆:元素周期表的结构 2 . 判断:原子或离子半径 3 . 警惕:常见错误思维 (1) 误认为主族元素的最高正价一定等于族序数。忽视了 F 无正价。 (2) 误认为元素的非金属性越强,其氧化物对应水化物的酸性就越强。忽视了关键词 “ 最高价 ” ,如 HClO 、 H 2 SO 3 是弱酸。 (3) 误认为同周期相邻两主族元素原子序数之差等于 1 。忽视了 Ⅱ A 、 Ⅲ A 相差 11( 第四、五周期 ) 和 25( 第六、七周期 ) 。 (4) 误认为失电子难的原子得电子的能力一定强。忽视了碳原子、稀有气体元素的原子失电子难,得电子也难。 (5) 误认为得失电子多的原子,得失电子的能力一定强。其实不然,不能把得失电子数的多少与得失电子的能力混淆。 (6) 误认为最高正价和最低负价绝对值相等的元素只有第 Ⅳ A 族的某些元素。忽视了第 Ⅰ A 族的 H 的最高正价为+ 1 价,最低负价为- 1 价。 [ 考法指导 ] 【考法训练 1 】 若某第 Ⅱ B 族原子序数为 x ,那么原子序数为 x + 1 的元素位于 ( ) A. 第 Ⅲ B 族 B. 第 Ⅲ A 族 C. 第 Ⅰ B 族 D. 第 Ⅰ A 族 解析 根据元素周期表的结构可知,从左到右依次为第 Ⅰ A 族,第 Ⅱ A 族,第 Ⅲ B 族~ Ⅶ B 族,第 Ⅷ 族,第 Ⅰ B ,第 Ⅱ B 族,第 Ⅲ A ~ Ⅶ A 族, 0 族,故选 B 。 答案 B 元素周期表的构成 ( 难度系数 ☆☆ ) 【考法训练 2 】 下表为周期表中部分结构,下列判断正确的是 ( ) A.C 元素位于周期表中第四周期 Ⅷ B 族 B. 元素最高价氧化物对应的水化物的碱性: B > A C. 工业上制备 D 单质的氧化产物为 CO D.E 元素与氢元素形成 H 2 E 2 的电子式为 答案 C 【典例演示】 下列事实不能用元素周期律解释的是 ( ) A. 气态氢化物的稳定性: HBr > HI B.0.1 mol·L - 1 溶液的 pH : NaOH > LiOH C. 向 Na 2 SO 3 溶液中加盐酸,有气泡产生 D.Mg 、 Al 与同浓度盐酸反应, Mg 更剧烈 元素周期律及应用 ( 难度系数 ☆☆☆ ) 解析 A 项,同一主族元素从上到下,气态氢化物的稳定性依次减弱,则稳定性 HBr > HI ,能用元素周期律解释, A 项不选; B 项,同一主族元素从上到下,金属性逐渐增强,氢氧化物的碱性逐渐增强,碱性 NaOH > LiOH ,则同浓度的两种溶液, NaOH 溶液的 pH 较大,能用元素周期律解释, B 项不选; C 项, Na 2 SO 3 与盐酸反应生成 SO 2 ,能够证明酸性: HCl > H 2 SO 3 ,不能体现元素周期律, C 项选; D 项,同周期从左到右,金属性逐渐减弱,金属单质的还原性逐渐减弱,因此 Mg 比 Al 与等浓度的盐酸反应更剧烈,能用元素周期律解释, D 项不选;答案选 C 。 答案 C 【考法训练 3 】 Be 、 Mg 、 Ca 、 Sr 、 Ba 为元素周期表第 Ⅱ A 族元素,下列关于这些元素的叙述不正确的是 ( ) A. 原子的最外层电子数相同 B. 元素最高正化合价相同 C. 形成简单离子后电子层数相同 D. 原子半径和离子半径均随原子序数增大而增大 解析 第 Ⅱ A 族元素的原子最外层电子数相等,最高正化合价相等, A 、 B 项正确。同主族元素从上到下,原子半径、离子半径都逐渐增大,原子和离子的电子层数都逐渐增多, C 项错误、 D 项正确。 答案 C 【考法训练 4 】 同周期的 X 、 Y 、 Z 三种元素,它们最高价氧化物对应的水化物是 HXO 4 、 H 2 YO 4 、 H 3 ZO 4 ,则下列判断正确的是 ( ) A. 酸性: H 3 ZO 4 > H 2 YO 4 > HXO 4 B. 非金属性: X > Y > Z C. 元素的最低负化合价的绝对值按 X 、 Y 、 Z 变小 D. 简单气态氢化物的稳定性按 X 、 Y 、 Z 的顺序增强 解析 根据 X 、 Y 、 Z 的最高价氧化物对应的水化物是 HXO 4 、 H 2 YO 4 、 H 3 ZO 4 ,可知 X 为第 Ⅶ A 族元素, Y 为第 Ⅵ A 族元素, Z 为第 Ⅴ A 族元素。同周期的主族元素,从左到右最高价氧化物对应的水化物的酸性逐渐增强, A 项错误。 X 、 Y 、 Z 三种元素最高价氧化物对应的水化物的酸性强弱顺序是 HXO 4 > H 2 YO 4 > H 3 ZO 4 ,所以三种元素的非金属性: X > Y > Z , B 项正确。 X 、 Y 、 Z 元素的最低负化合价的绝对值分别是 1 、 2 、 3 ,逐渐变大, C 项错误。三种元素的非金属性: X > Y > Z ,非金属性越强,则对应的简单气态氢化物的稳定性越强, D 项错误。 答案 B 【考法训练 5 】 砷 (As) 和镓 (Ga) 都是第四周期元素,分别属于 Ⅴ A 和 Ⅲ A 族。下列说法中不正确的是 ( ) A. 原子半径: Ga > As > P B. 热稳定性: NH 3 > PH 3 > AsH 3 C. 酸性: H 3 AsO 4 > H 2 SO 4 > H 3 PO 4 D.Ga (OH) 3 可能是两性氢氧化物 解析 酸性 H 2 SO 4 > H 3 PO 4 > H 3 AsO 4 故 C 错误。 答案 C 金属性、非金属性判断方法 【当堂指导】 四种短周期主族元素 W 、 X 、 Y 、 Z 的原子序数依次增大, W 、 X 的简单离子具有相同电子层结构, X 的原子半径是短周期主族元素原子中最大的, W 与 Y 同族, Z 与 X 形成的离子化合物的水溶液呈中性。下列说法正确的是 ( ) A. 简单离子半径: W < X < Z B.W 与 X 形成的化合物溶于水后溶液呈碱性 C. 气态氢化物的热稳定性: W < Y D. 最高价氧化物的水化物的酸性: Y > Z [ 模型示例 ] [ 分析建模 ] [ 模型解题 ] 答案 B 【应用 1 】 短周期主族元素 X 、 Y 、 Z 、 W 、 R 的原子序数依次递增, X 、 W 同主族, Y 、 Z 相邻, X 的原子的最外层电子数是内层电子数的 2 倍, X 、 Y 、 W 的原子的最外层电子数之和为 10 , R 的原子最外层电子数是 Z 的原子最外层电子数的 2 倍。下列说法错误的是 ( ) A.Y 的单质能与 X 的最高价氧化物发生置换反应 B. 同周期元素形成的简单离子中, Z 的离子半径最小 C.W 的含氧酸钠盐溶液是制备木材防火剂的原料 D.R 的单质在纯氧中燃烧生成其最高价氧化物 [ 当堂应用 ] 解析 短周期主族元素 X 、 Y 、 Z 、 W 、 R 的原子序数依次递增, X 的原子的最外层电子数是内层电子数的 2 倍,故 X 为 C ; X 、 W 同主族,则 W 为 Si ; X 、 Y 、 W 的原子的最外层电子数之和为 10 , Y 的原子的最外层电子数为 10 - 4 - 4 = 2 , Y 的原子序数大于碳原子的,故 Y 为 Mg ; Y 、 Z 相邻,则 Z 为 Al ; R 的原子最外层电子数是 Z 的原子最外层电子数的 2 倍,则 R 的原子最外层电子数为 6 ,故 R 为 S 。 Mg 单质能与二氧化碳反应生成碳与 MgO ,属于置换反应, A 项说法正确;第三周期元素形成的简单离子中, Al 3 + 的半径最小, B 项说法正确; W 的含氧酸钠盐 ( 硅酸钠 ) 溶液是制备木材防火剂的原料, C 项说法正确; S 单质在纯氧中燃烧生成二氧化硫, D 项说法错误。 答案 D 反思 该题主要是应用相关元素的最外层电子数之间的关系来推断元素。根据微粒结构及元素位置推断元素的方法如表所示: 推断依据 推断方法 原子或离子的结构示意图 ① 由原子结构示意图确定元素在周期表中的位置和元素的种类:电子层数=周期数,最外层电子数=主族序数;如果已知离子的结构示意图,则将其转化为原子结构示意图来确定。 ② 电子层结构相同的微粒:阴离子对应的元素在具有相同电子层结构的稀有气体元素的前面,阳离子对应的元素在具有相同电子层结构的稀有气体元素的下一周期的左边位置,简称 “ 阴前阳下 ” 元素主要化合价的特征关系 ① 根据等式确定元素在周期表中的位置:最高正化合价数=最外层电子数=主族序数 (O 、 F 除外 ) 。 ② 如果已知负化合价 ( 或阴离子的符号 ) ,则用等式可先求出最高正化合价:最高正化合价= 8 - | 负化合价 | ,再确定元素在周期表中的位置 原子半径的递变规律 同周期中左边元素的原子半径比右边元素的原子半径大 ( 不考虑稀有气体元素 ) ,同主族中下边元素的原子半径比上边元素的原子半径大 【应用 2 】 (2017· 江苏化学, 5) 短周期主族元素 X 、 Y 、 Z 、 W 原子序数依次增大,其中只有 Y 、 Z 处于同一周期且相邻, Z 是地壳中含量最多的元素, W 是短周期中金属性最强的元素。下列说法正确的是 ( ) A. 原子半径: r (X) < r (Y) < r (Z) < r (W) B.W 的最高价氧化物的水化物是一种弱碱 C.Y 的单质的氧化性比 Z 的强 D.X 、 Y 、 Z 三种元素可以组成共价化合物和离子化合物 解析 Z 为氧元素, Y 与 Z 同一周期且相邻,原子序数比 Z 小,为氮元素。 X 原子序数小且与 Y 、 Z 不在同一周期, X 为氢元素, W 为钠元素。 A 项,原子半径: r (H)< r (O)< r (N)< r (Na) ,错误; B 项, NaOH 是强碱,错误; C 项,氧化性: O 2 >N 2 ,错误; H 、 N 、 O 可以形成共价化合物: HNO 3 、 HNO 2 、 NH 3 ·H 2 O ,离子化合物: NH 4 NO 3 ,正确。 答案 D 反思 由元素及其化合物的一些特征性质可以成为推断的突破口,需要归纳记忆,熟练掌握。 特征 元素 形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素 C 空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素 N 地壳中含量最多的元素、氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素 O 等物质的量的单质最轻的元素、最轻的金属单质 H 、 Li 单质在常温下呈液态的,非金属元素、金属元素 Br 、 Hg 最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素 Al 元素的气态氢化物和它的最高价氧化物对应的水化物能起化合反应的元素、能起氧化还原反应的元素 N 、 S 元素的单质在常温下能与水反应放出气体的短周期元素 Li 、 Na 、 F 单质是重要的半导体材料、氧化物可用作光导纤维 Si 短周期中金属性最强的元素、非金属性最强的元素 Na 、 F 【应用 3 】 R 、 X 、 Y 、 Z 、 A 是短周期主族元素,它们在周期表中的相对位置如图所示。 X 原子最外层电子数等于其电子层数的 3 倍。下列推断正确的是 ( ) A. 气态氢化物的热稳定性由强到弱的顺序为 Z > R > X > Y B. 原子半径由小到大的顺序为 Z < A < Y < X C. 最高价氧化物对应的水化物酸性由弱到强的顺序为 Z < R < A D.RY 3 、 A 2 X 、 ZA 5 分子中每个原子最外层都达到 8 电子结构 R X Y Z A 解析 由元素在周期表中的位置关系知, X 位于第二周期,只有氧原子的最外层电子数等于其电子层数的 3 倍,则 X 为氧元素,由此推知 R 为氮元素, Y 为氟元素, Z 为磷元素, A 为氯元素。 A 项,热稳定性: PH 3 < NH 3 < H 2 O < HF ,错误; B 项,原子半径: r (P) > r (Cl) > r (O) > r (F) ,错误; C 项,最高价氧化物对应的水化物酸性: H 3 PO 4 < HNO 3 < HClO 4 ,正确; D 项, PCl 5 分子中磷原子最外层有 10 个电子,错误。 答案 C 反思 本题借助 “ 残缺元素周期表 ” 进行解题,解题时应注意以下两点: 1. 元素周期表中短周期特殊结构的应用 (1) 元素周期表中第一周期只有两种元素 H 和 He , H 元素所在的第 Ⅰ A 族为元素周期表的左侧边界,第 Ⅰ A 族左侧无元素分布。 (2)He 为 0 族元素, 0 族元素为元素周期表的右侧边界, 0 族元素右侧没有元素分布。利用这个关系可以确定元素所在的周期和族。 2. 元素的位置关系和原子序数关系的应用 (1) 同一周期中元素的原子序数一般比左边元素原子序数大 1 ,比右边元素的原子序数小 1 。 (2) 同主族上下周期元素的原子序数关系的应用。查看更多