- 2021-05-11 发布 |
- 37.5 KB |
- 9页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学实验专题练习
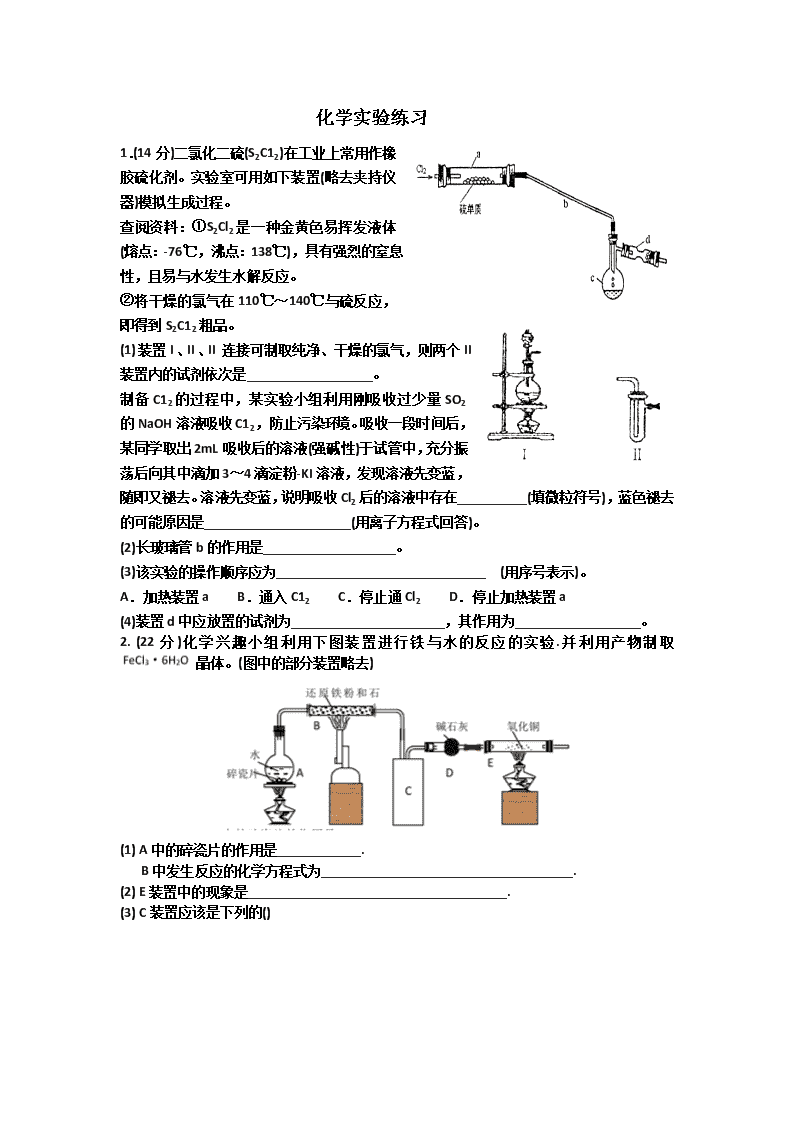
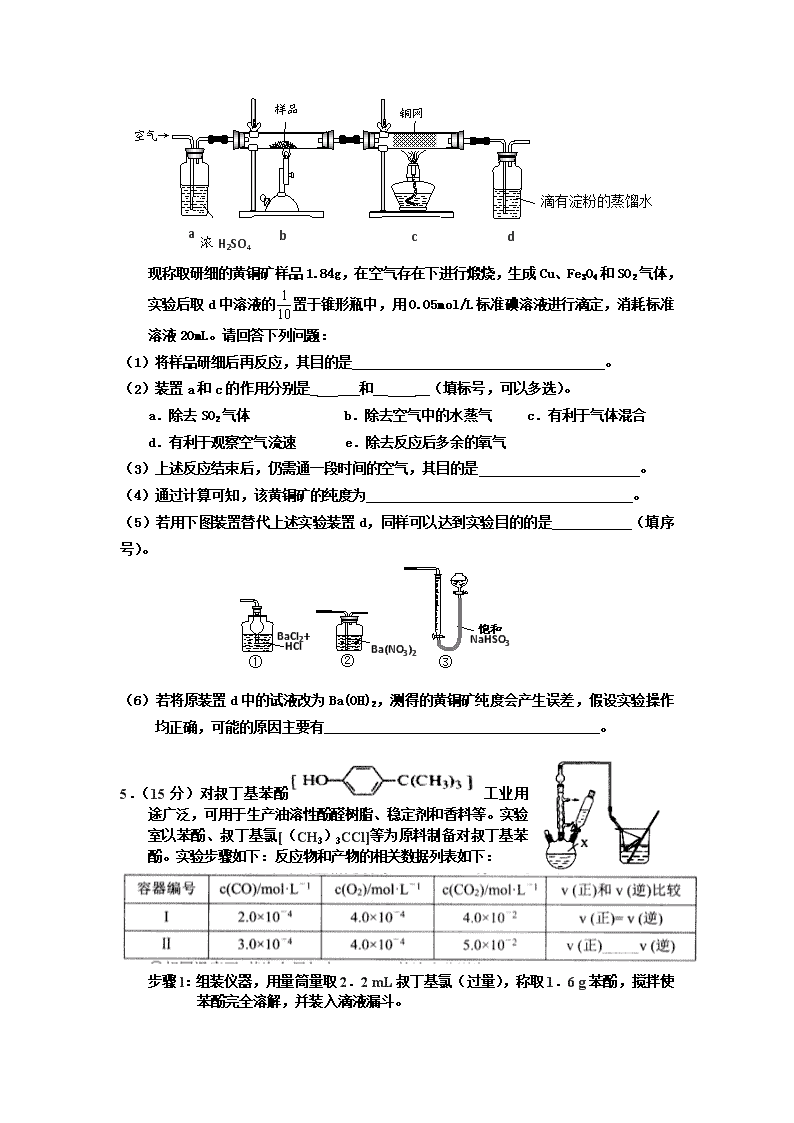
化学实验练习 1.(14分)二氯化二硫(S2C12)在工业上常用作橡胶硫化剂。实验室可用如下装置(略去夹持仪器)模拟生成过程。 查阅资料:①S2Cl2是一种金黄色易挥发液体(熔点:-76℃,沸点:138℃),具有强烈的窒息性,且易与水发生水解反应。 ②将干燥的氯气在110℃~140℃与硫反应,即得到S2C12粗品。 (1)装置I、II、II连接可制取纯净、干燥的氯气,则两个II装置内的试剂依次是__________________。 制备C12的过程中,某实验小组利用刚吸收过少量SO2的NaOH溶液吸收C12,防止污染环境。吸收一段时间后,某同学取出2mL吸收后的溶液(强碱性)于试管中,充分振荡后向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,随即又褪去。溶液先变蓝,说明吸收Cl2后的溶液中存在__________(填微粒符号),蓝色褪去的可能原因是_____________________(用离子方程式回答)。 (2)长玻璃管b的作用是___________________。 (3)该实验的操作顺序应为______________________________ (用序号表示)。 A.加热装置a B.通入C12 C.停止通Cl2 D.停止加热装置a (4)装置d中应放置的试剂为______________________,其作用为__________________。 2. (22分)化学兴趣小组利用下图装置进行铁与水的反应的实验.并利用产物制取晶体。(图中的部分装置略去) (1) A中的碎瓷片的作用是____________. B中发生反应的化学方程式为____________________________________. (2) E装置中的现象是_____________________________________. (3) C装置应该是下列的() (4)反应一段时间后,冷却并取出B的固体·与过量的稀盐酸充分反应(磁性氧化铁按可溶于稀盐酸处理)后 (a)一定存在Fe3+ (b)一定存在Fe2+ (c)可能存在Fe2+和Fe3+ (d)Fe2+或Fe3+只存在一种。 (5)验证(4)中实验后所得溶液中无Fe3+的方法是_________________. (6)将上述溶液过滤: 步骤(1)通入Cl2的作用是______________________(用离子方程式表示),步骤(II)从较稀的溶溶液中得到晶体的主要操作包括__________________,在此过程中保持盐酸稍过量的原因是________________________________________________。 3.(15分)如图是一个制取氯气并以氯气为原料进行特定反应的装置。 (l)A是氯气发生装置,写出其中的化学反应方程式 。 (2)a仪器的名称为 。 (3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式 ,装置C的作用是 。 (4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为 。 (5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为 (填序号)。 ①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。 (6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B 中的现象是 ;若发现装置B中该现象不明显,可能的原因是 ;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式 。 4.(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验: b 空气→ 浓H2SO4 样品 铜网 滴有淀粉的蒸馏水 a d c 现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20mL。请回答下列问题: (1)将样品研细后再反应,其目的是 。 (2)装置a和c的作用分别是_ ___和__ __(填标号,可以多选)。 a.除去SO2气体 b.除去空气中的水蒸气 c.有利于气体混合 d.有利于观察空气流速 e.除去反应后多余的氧气 (3)上述反应结束后,仍需通一段时间的空气,其目的是 。 (4)通过计算可知,该黄铜矿的纯度为 。 (5)若用下图装置替代上述实验装置d,同样可以达到实验目的的是 (填序号)。 Ba(NO3)2 ② BaCl2+ HCl ① ③ 饱和 NaHSO3 (6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度会产生误差,假设实验操作均正确,可能的原因主要有_______________________________________。 5.(15分)对叔丁基苯酚工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。实验步骤如下:反应物和产物的相关数据列表如下: 步骤l:组装仪器,用量筒量取2.2 mL叔丁基氯(过量),称取1.6 g苯酚,搅拌使苯酚完全溶解,并装入滴液漏斗。 步骤2:向X中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,迅速有气体放出。 步骤3:反应缓和后,向X中加入8 mL水和1 mL浓盐酸,即有白色固体析出。 步骤4:抽滤得到白色固体,洗涤,得到粗产物,用石油醚重结晶,得对叔丁基苯酚1.8 g。 (1)仪器X的名称为 。 (2)步骤2中发生主要反应的化学方程式为 。该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是 。 (3)图中倒扣漏斗的作用是 。苯酚有腐蚀性,能使蛋白质变性,若其溶液沾到皮肤上可用 洗涤。 (4)在取用苯酚时发现苯酚冻结在试剂瓶中,可采取的措施为____ 。 (5)下列仪器在使用前必须检查是否漏液的是 (填选项字母)。 A.量筒 B.容量瓶 C.滴定管 D.分液漏斗 E.长颈漏斗 (6)本实验中,对叔丁基苯酚的产率为 。(请保留三位有效数字) 6.(16分) Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示: (1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为_____________________________ ____。 (2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是_______________(填序号,下同)。 ①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应 (3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。 ①CO2 ②NO ③Cl2 ④H2 ⑤HCl 其中在D装置中连接小烧杯的目的是____________________。 Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。 (1)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________; (2)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。 氨的测定装置(已省略加热和夹持装置) ①装置中安全管的作用原理是__________________________________________。 ②样品中氨的质量分数表达式为________。 7.(13分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: (1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段 液注,若 ,则整个装置气密性良好。装置E 的作用是 。装置F中为 溶液。 (2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。 a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液 (3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。 (4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他 们取C中的溶液,分成三份,并设计了如下实验: 方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。 方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。 方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。 上述方案不合理的是____,原因是_______________________________________。 (5)能表明I-的还原性弱于SO2的现象是__________________________,写出有关离子方程式:_______________________________________。 8、(14分)根据Mg能在CO2中燃烧,某兴趣小组推测Na应该也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。该小组用如下图装置进行了实验探究。已知PdCl2能被CO还原得到黑色的Pd。 回答下列问题: (1)为了使反应随开随用,随关随停,上图虚线方框内应选用_________装置(填下图字母代号),如何检验所选装置的气密性_ ________。 (2)装置2中所盛试剂为_______________。 A.NaOH溶液 B.饱和NaHCO3溶液 C.饱和Na2CO3溶液 D.饱和NaCl溶液 (3)检测装置的气密性完好并装好药品后,在点燃酒精灯前应先进行装置1中的反应操作,待观察到_________现象时,再点燃酒精灯,这步操作的目的是___ ______。 (4)由实验现象和进一步的探究得出反应机理。 A.装置6中有黑色沉淀生成; B.取反应后直玻管中的固体物质23.0g溶于足量的水中,无气泡产生且得到澄清的溶液;将溶液加水稀释配成250rnL的溶液: C.取25.00ml步骤B的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,称量得固体质量为1.97g。 ①步骤C中不溶物干燥前必须经过洗涤,如何检验该沉淀是否洗涤干净______ 。 ②该探究得出钠与二氧化碳反应的化学方程式为___ _____。 9.碱式碳酸钴[Cox(OH)y(C03)z]常用作电子材料、磁性材料的添加剂,受热时可分解生喊三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置进行实验。 (1)请完成下列实验步骤: ①称取3.65 g样品置于硬质玻璃管内,称量乙、丙装置的质量; ②按如图所示装置组装好仪器,并 . ③加热甲中玻璃管,当乙装置中 (填实验现象),停止加热; ④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量; ⑤计算。 (2)步骤④中缓缓通入空气数分钟的目的是 o (3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的 (填字母)连接在 (填装置连接位置)。 (4)若按正确装置进行实验,测得如下数据。 则该碱式碳酸钴的化学式为 。 (5)含有Co(A102)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为 。 (6)CoCl2·6H2O常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下: 已知:25℃时,Ksp[Fe(OH)3]=2.79X10-39 ①净化除杂时,加入H2O2发生反应的离子方程式为 ②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为 。 ΔH=akJ/mol ΔH=b kJ/mol 请写出Fe3+发生水解反应的热化学方程式: . 水解平衡常数Kh= .④加盐酸调整pH为2~3的目的为 。 ⑤操作Ⅱ过程为蒸发浓缩、 (填操作名称)、过滤。 (7)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料C6中(如图所示)。电池反应为 ,写出该电池放电时的正极反应式: 。 9. (16分) 甲、乙、丙三同学欲分别完成“铁与水蒸气反应”的实验. I.甲同学的方案如图I:试管中依次放入湿棉花和还原铁粉,加热。把生成的气体通入蒸发皿中的肥皂液中。一段时间后,用坩埚钳夹取燃着的火柴在蒸发皿中点火,观察到的现象是 ;发生反应的化学方程式为 。 II.乙同学所采用的装置如图Ⅱ:分别用灯1和灯2加热反应器中的水和还原性铁粉,当水蒸气将空气排出后用排水法收集一试管气体。乙同学所采用的装置与甲同学的装置比较优点是 ;结束实验的操作是 。 图1 图2 Ⅲ.丙同学将甲、乙所装置进行改进,所有装置如图Ⅲ: 图3 在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO。干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物。 (1)丙同学所采用的装置与乙同学的装置比较优点是 ; (2)实验开始时应先点燃a处的酒精灯然后才点燃b处的酒精喷灯原因是 ; (3)能证明铁与水蒸气反应的现象是 ; Ⅳ.丁同学提出问题:如何通过实验证明铁与水蒸气反应得到的黑色固体中既含Fe2+又含Fe3+ 。查看更多