- 2021-05-11 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河北专版2020中考化学复习方案课时训练04溶液试题
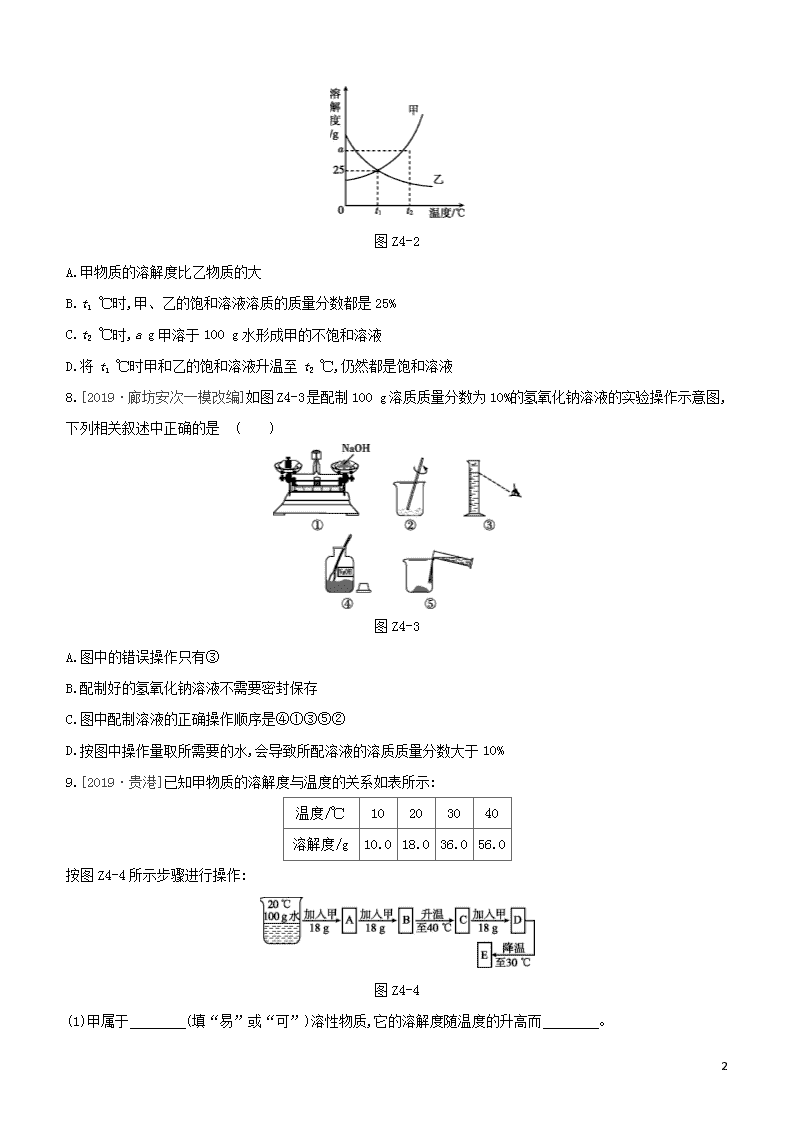
课时训练(四) 溶液 |夯实基础| 1.[2019·石家庄十八县二模]下列物质属于溶液的是 ( ) A.牛奶 B.豆浆 C.蒸馏水 D.碘酒 2.[2019·石家庄桥西一模]下列物质溶于水后,溶液温度明显降低的是 ( ) A.浓硫酸 B.氢氧化钠 C.氯化钠 D.硝酸铵 3.[2019·扬州]配制50 g溶质质量分数为15%的氯化钠溶液,不需要用到的仪器是 ( ) A.集气瓶 B.烧杯 C.玻璃棒 D.量筒 4.[2019·成都]下列说法正确的是 ( ) A.溶质都是固体 B.乳化能增强乳浊液的稳定性 C.20 ℃时,50 g水中溶解了15 g硝酸钾,则20 ℃时硝酸钾的溶解度是30 g D.搅拌可增大物质的溶解度 5.[2019·嘉兴]20 ℃时,把36 g氯化钠放入64 g水中,使其充分溶解(20 ℃时氯化钠的溶解度为36 g)。对所得溶液的有关说法错误的是 ( ) A.该溶液是饱和溶液 B.溶液中Na+和Cl-个数一定相等 C.溶液质量为100 g D.溶质与溶剂质量比为9∶25 6.[2019·杭州]如图Z4-1所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是 ( ) 图Z4-1 A.在①→②过程中,氯化钠的质量分数保持不变 B.在②→③过程中,氯化钠的溶解度不断增大 C.在③→④过程中,水的质量分数不断增大 D.在②→④过程中,氯化钠的质量分数先不变后增大 7.[2019·海南]如图Z4-2为甲、乙两种固体在水中的溶解度曲线。下列说法正确的是 ( ) 7 图Z4-2 A.甲物质的溶解度比乙物质的大 B.t1 ℃时,甲、乙的饱和溶液溶质的质量分数都是25% C.t2 ℃时,a g甲溶于100 g水形成甲的不饱和溶液 D.将t1 ℃时甲和乙的饱和溶液升温至t2 ℃,仍然都是饱和溶液 8.[2019·廊坊安次一模改编]如图Z4-3是配制100 g溶质质量分数为10%的氢氧化钠溶液的实验操作示意图,下列相关叙述中正确的是 ( ) 图Z4-3 A.图中的错误操作只有③ B.配制好的氢氧化钠溶液不需要密封保存 C.图中配制溶液的正确操作顺序是④①③⑤② D.按图中操作量取所需要的水,会导致所配溶液的溶质质量分数大于10% 9.[2019·贵港]已知甲物质的溶解度与温度的关系如表所示: 温度/℃ 10 20 30 40 溶解度/g 10.0 18.0 36.0 56.0 按图Z4-4所示步骤进行操作: 图Z4-4 (1)甲属于 (填“易”或“可”)溶性物质,它的溶解度随温度的升高而 。 7 (2)在A~E的溶液中,属于不饱和溶液的是 (填序号,下同),与B溶液的溶质质量分数相同的是 。 (3)要使E中未溶的甲物质全部溶解,至少需要加入30 ℃的水 g。 10.[2019·绥化]甲、乙、丙三种固体物质的溶解度曲线如图Z4-5所示。 图Z4-5 (1) ℃时,甲、乙两种物质的溶解度相等。 (2)甲中含有少量的乙,可采用 方法提纯甲。 (3)t1 ℃时,要配制100 g质量分数为10%的甲溶液,需要甲物质的质量为 g。 (4)t2 ℃时,甲、乙、丙三种物质的饱和溶液降温到t1 ℃,所得溶液中溶质的质量分数由大到小的顺序是 。 (5)t1 ℃时,将15 g甲物质加入到50 g水中充分溶解后,所得溶液中溶质的质量分数为 。 |拓展提升| 1.下列不能达到实验目的的是 ( ) 选项 实验目的 操作 A 鉴别固体硫酸铜和氯化钠 加水溶解观察颜色 B 区分硝酸铵和氢氧化钠 加适量水测量温度变化 C 区分20 ℃时氯化钠的饱和溶液与水 分别加入一定量的氯化钾 D 将某温度下的氢氧化钙的不饱和溶液变为饱和溶液 加入适量氧化钙 2.[2019·黄石]在蒸馏水中加入NaOH颗粒,不断搅拌,用温度传感器记录溶解过程的温度变化如图Z4-6。a、c两点观察到溶液中有固体存在,b点固体完全消失。下列说法不正确的是 ( ) 图Z4-6 A.NaOH固体溶于水是放热过程 B.a、c两点时,NaOH的溶解度相同 C.b点时,该溶液一定为饱和溶液 D.c点时的溶剂质量等于d点时的溶剂质量 7 3.[2018·保定莲池模拟]t1 ℃时,将a、b两种固体物质各18 g分别加入到盛有100 g水的烧杯中,充分搅拌后现象如图Z4-7甲所示,升温到t2 ℃时现象如图乙所示,a、b两种固体在水中的溶解度曲线如图丙所示。下列说法正确的是 ( ) 图Z4-7 A.图甲中a、b烧杯内溶液的溶质质量分数相等 B.物质b的溶解度曲线为图丙中的M C.乙图中a烧杯内为饱和溶液 D.将t2 ℃时a、b的饱和溶液降温至t1 ℃,a有晶体析出,b溶质质量分数增大 4.[2019·陕西]如图Z4-8是对某固体物质的溶液,在一定温度下,进行恒温蒸发操作的实验记录。请回答: 图Z4-8 (1)乙中的溶液为 (填“饱和”或“不饱和”)溶液。 (2)该固体物质在当时温度下的溶解度为 。 (3)甲、乙、丙、丁中溶液溶质质量分数的大小关系是 。 (4)给丁中的溶液升高温度时,固体逐渐消失,说明该物质的溶解度随温度升高而 (填“增大”或“减小”)。 7 【参考答案】 夯实基础 1.D [解析]牛奶和豆浆都不均一、不稳定,不是溶液;蒸馏水属于纯净物,不是溶液;碘酒是碘的酒精溶液。 2.D [解析]浓硫酸、氢氧化钠溶解时放热;氯化钠溶解时无明显吸放热现象;硝酸铵溶于水吸热。 3.A [解析]配制50 g溶质质量分数为15%的氯化钠溶液的实验步骤是计算、称量、量取、溶解、装瓶。需要用到的仪器有托盘天平、量筒、胶头滴管、烧杯和玻璃棒等,不需要用到集气瓶。 4.B [解析]溶质既可以是固体,也可以是气体或液体;乳化能增强乳浊液的稳定性;在一定温度下,某固态物质在100 g溶剂中达到饱和状态时所溶解的溶质的质量,叫作这种物质在这种溶剂中的溶解度,20 ℃时,50 g水中溶解了15 g硝酸钾,没有确定是否饱和,则无法确定20 ℃时硝酸钾的溶解度是30 g;搅拌能加快溶解速率,不能增大物质的溶解度。 5.C [解析]20 ℃时氯化钠的溶解度为36 g,即在20 ℃时,100 g水中溶解36 g氯化钠达到饱和状态,则该温度下36 g氯化钠不能完全溶解在64 g水中,因此所得溶液为饱和溶液,故A选项正确;氯化钠是由钠离子和氯离子构成的,且钠离子和氯离子的个数比为1∶1,所以在氯化钠溶液中,钠离子和氯离子的个数一定相等,故B选项正确;因为36 g的氯化钠固体不能完全溶解在64 g水中,因此所得溶液的质量小于100 g,故C选项错误;根据20 ℃时氯化钠的溶解度为36 g,则饱和溶液中溶质和溶剂的质量比为36 g∶100 g=9∶25,故D选项正确。 6.D [解析]①→②过程中恒温蒸发,水的质量不断减小,氯化钠的溶质质量分数不断增大;②→③过程中由于是恒温蒸发,故物质的溶解度保持不变;③→④为升温蒸发过程,溶解度变大,饱和溶液中溶质质量分数逐渐增大,故水的质量分数不断减小;②→③过程中②溶液恰好为饱和状态,③析出晶体为饱和溶液,故溶质质量分数不变,③→④为升温蒸发过程,溶解度变大,饱和溶液中溶质质量分数逐渐增大。 7.C [解析]溶解度的大小与温度有关,比较溶解度的大小时需要指明温度;t1 ℃时,甲和乙的溶解度均为25 g,所以t1 ℃时,甲、乙的饱和溶液溶质的质量分数为25 g100 g+25 g×100%=20%;t2 ℃时,甲物质的溶解度大于a g,所以t2 ℃时将a g甲溶于100 g水会形成甲的不饱和溶液;甲物质的溶解度随温度的升高而增大,将t1 ℃时甲的饱和溶液升温至t2 ℃,会形成甲的不饱和溶液。 8.C [解析]托盘天平的使用要遵循“左物右码”的原则,图①中所示操作砝码与药品位置放反了,且应在小烧杯中称量NaOH固体;量取液体时,视线与量筒中液体的凹液面最低处保持水平,图③中仰视读数。氢氧化钠能与空气中的二氧化碳反应,生成碳酸钠而变质,配制好的氢氧化钠溶液需要密封保存。配制100 g溶质质量分数为10%的氢氧化钠溶液,首先计算配制溶液所需氢氧化钠和水的质量,再称量所需的氢氧化钠和量取水,最后进行溶解,正确的实验操作顺序为④①③⑤②;量取水时,读数如图③,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小。 9.(1)易 增大 (2)CD A (3)50 7 [解析](1)从表中的数据可知,20 ℃时,该物质的溶解度为18 g,大于10 g,故为易溶性物质,该物质的溶解度随温度的升高而增大。(2)20 ℃时,该物质的溶解度为18 g,100 g的水中加入18 g该物质,溶液恰好饱和,再继续加入18 g溶质,溶质不再溶解,故A、B溶液为饱和溶液,且溶质质量分数相等;升温到40 ℃时,溶解度为56 g,则C溶液不饱和,再加入18 g溶质,此时溶质共有54 g<56 g,故D溶液不饱和,降温到30 ℃,溶解度为36 g,故E溶液饱和。(3)剩余18 g甲物质未溶解,要将其完全溶解,还需要30 ℃的水50 g。 10.(1)t2 (2)冷却结晶(或降温结晶或冷却热饱和溶液) (3)10 (4)乙>甲>丙(或乙、甲、丙) (5)20% [解析](1)甲、乙两种物质的溶解度曲线在温度为t2 ℃时相交,故t2 ℃时,甲、乙两种物质的溶解度相等。(2)甲的溶解度受温度变化影响较大,乙的溶解度受温度变化影响较小,故甲中含有少量的乙,可采用降温结晶的方法提纯甲。(3)t1 ℃时,要配制100 g质量分数为10%的甲溶液,需要甲物质的质量为100 g×10%=10 g。(4)t2 ℃时,甲、乙、丙三种物质的饱和溶液降温到t1 ℃,甲和乙析出晶体,均为饱和溶液,t1 ℃时,甲的溶解度小,故所得溶液中溶质的质量分数甲<乙,而丙的溶液由饱和变为不饱和,溶质质量分数和t2 ℃时丙的饱和溶液质量分数相等,故溶质的质量分数由大到小的顺序是乙>甲>丙。(5)t1 ℃时,甲的溶解度为25 g,将15 g甲物质加入到50 g 水中充分溶解后,只能溶解12.5 g甲物质,所得溶液中溶质的质量分数为12.5 g12.5 g+50 g×100%=20%。 拓展提升 1.C 2.C [解析]由图像知氢氧化钠溶于水溶液温度升高,是放热过程;从图知a、c两点对应温度相同,则此温度下氢氧化钠在水中的溶解度相同;由图只知b点所对应温度最高,b点固体完全消失,并不能说明此时溶液是饱和溶液;据题意,在蒸馏水中加入氢氧化钠颗粒,说明水质量不变,氢氧化钠溶于水,溶剂是水,则图中c、d两点溶剂质量相同。 3.A [解析]图甲中两种溶液都为饱和溶液,而且该温度下溶解度相同,所以溶液的溶质质量分数相同;b物质的溶液升温后析出更多的晶体,说明溶解度随温度升高而减小,其溶解度曲线应为N;乙图中a烧杯内为不饱和溶液;b的饱和溶液降温后变为不饱和,溶质和溶液的质量均不变,所以溶质质量分数也不变。 4.(1)不饱和 (2)15 g (3)甲<乙<丙=丁(或丁=丙>乙>甲) 7 (4)增大 [解析](1)乙蒸发10 g水析出固体1 g形成饱和溶液,丙继续再蒸发10 g水能析出1.5 g固体,说明乙中的溶液为不饱和溶液。(2)丙中的溶液为饱和溶液,继续蒸发10 g水,析出固体1.5 g,故该温度下溶解度为15 g。(3)恒温条件下,甲、乙溶液中溶质相等,但溶剂质量甲大于乙,因此溶质质量分数甲小于乙;乙为不饱和溶液,丙为饱和溶液,故溶质质量分数乙小于丙;丁为饱和溶液,故甲、乙、丙、丁中溶液溶质质量分数的大小关系是甲<乙<丙=丁。(4)物质的溶解度随温度的升高而增大,所以给丁中的溶液升高温度时,固体逐渐消失。 7查看更多