- 2021-05-10 发布 |
- 37.5 KB |
- 6页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习原电池 化学电源作业
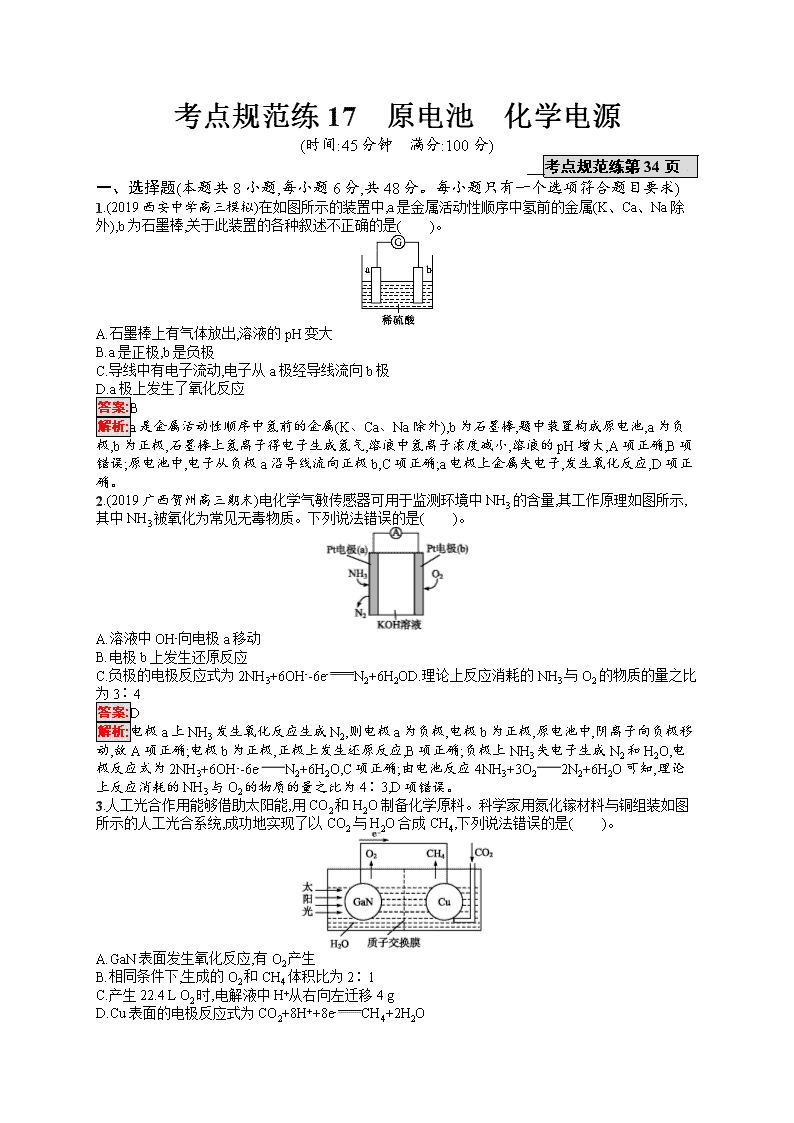
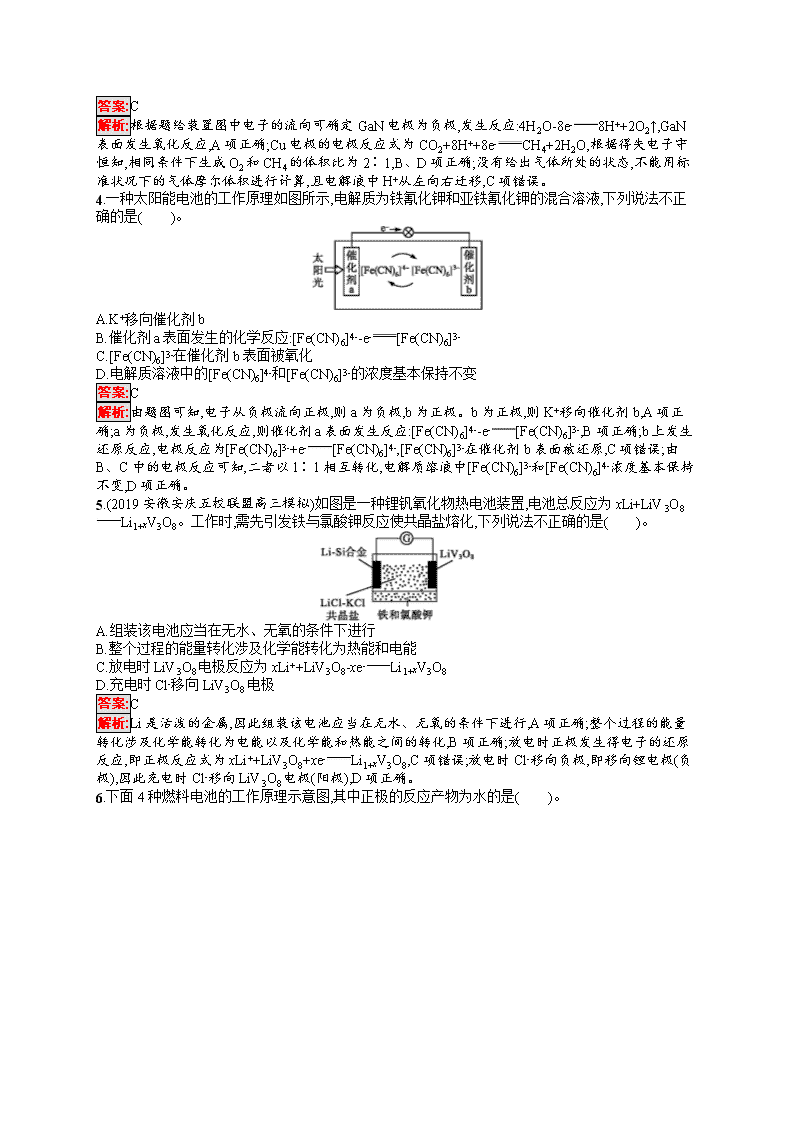
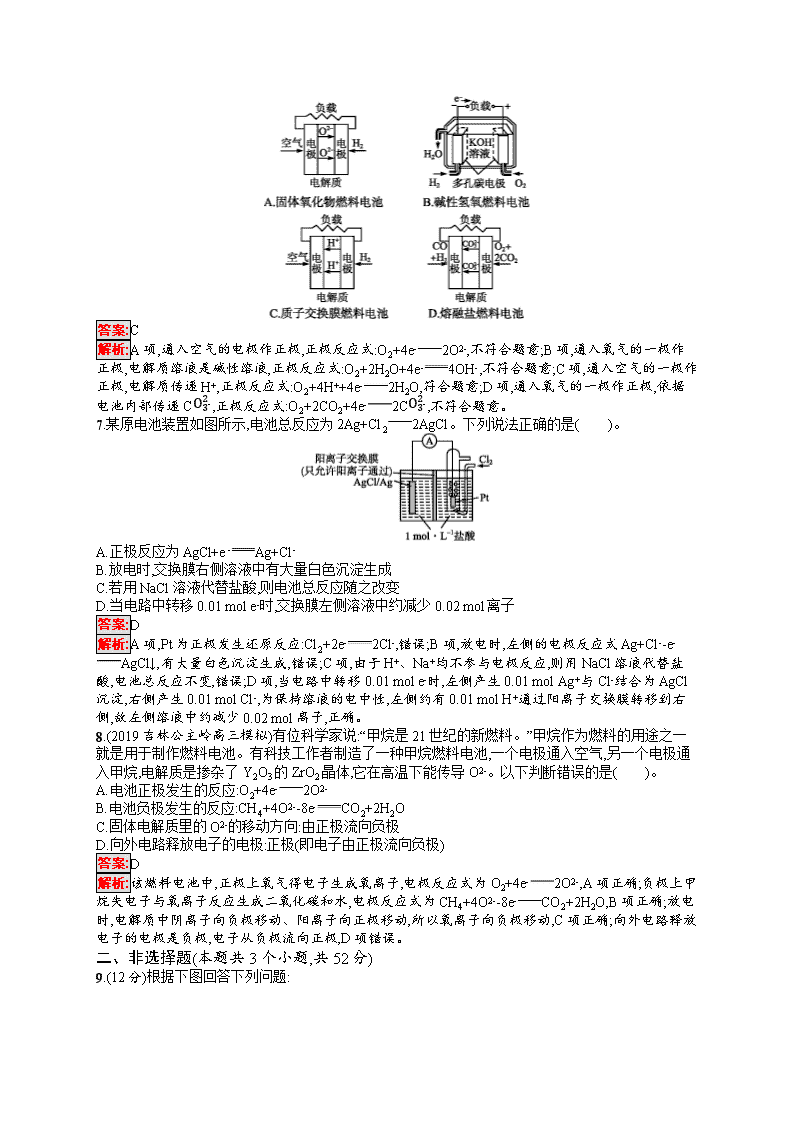
考点规范练17 原电池 化学电源 (时间:45分钟 满分:100分) 考点规范练第34页 一、选择题(本题共8小题,每小题6分,共48分。每小题只有一个选项符合题目要求) 1.(2019西安中学高三模拟)在如图所示的装置中,a是金属活动性顺序中氢前的金属(K、Ca、Na除外),b为石墨棒,关于此装置的各种叙述不正确的是( )。 A.石墨棒上有气体放出,溶液的pH变大 B.a是正极,b是负极 C.导线中有电子流动,电子从a极经导线流向b极 D.a极上发生了氧化反应 答案:B 解析:a是金属活动性顺序中氢前的金属(K、Ca、Na除外),b为石墨棒,题中装置构成原电池,a为负极,b为正极,石墨棒上氢离子得电子生成氢气,溶液中氢离子浓度减小,溶液的pH增大,A项正确,B项错误;原电池中,电子从负极a沿导线流向正极b,C项正确;a电极上金属失电子,发生氧化反应,D项正确。 2.(2019广西贺州高三期末)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见无毒物质。下列说法错误的是( )。 A.溶液中OH-向电极a移动 B.电极b上发生还原反应 C.负极的电极反应式为2NH3+6OH--6e-N2+6H2OD.理论上反应消耗的NH3与O2的物质的量之比为3∶4 答案:D 解析:电极a上NH3发生氧化反应生成N2,则电极a为负极,电极b为正极,原电池中,阴离子向负极移动,故A项正确;电极b为正极,正极上发生还原反应,B项正确;负极上NH3失电子生成N2和H2O,电极反应式为2NH3+6OH--6e-N2+6H2O,C项正确;由电池反应4NH3+3O22N2+6H2O可知,理论上反应消耗的NH3与O2的物质的量之比为4∶3,D项错误。 3.人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。科学家用氮化镓材料与铜组装如图所示的人工光合系统,成功地实现了以CO2与H2O合成CH4,下列说法错误的是( )。 A.GaN表面发生氧化反应,有O2产生 B.相同条件下,生成的O2和CH4体积比为2∶1 C.产生22.4 L O2时,电解液中H+从右向左迁移4 g D.Cu表面的电极反应式为CO2+8H++8e-CH4+2H2O 答案:C 解析:根据题给装置图中电子的流向可确定GaN电极为负极,发生反应:4H2O-8e-8H++2O2↑,GaN表面发生氧化反应,A项正确;Cu电极的电极反应式为CO2+8H++8e-CH4+2H2O,根据得失电子守恒知,相同条件下生成O2和CH4的体积比为2∶1,B、D项正确;没有给出气体所处的状态,不能用标准状况下的气体摩尔体积进行计算,且电解液中H+从左向右迁移,C项错误。 4.一种太阳能电池的工作原理如图所示,电解质为铁氰化钾和亚铁氰化钾的混合溶液,下列说法不正确的是( )。 A.K+移向催化剂b B.催化剂a表面发生的化学反应:[Fe(CN)6]4--e-[Fe(CN)6]3- C.[Fe(CN)6]3-在催化剂b表面被氧化 D.电解质溶液中的[Fe(CN)6]4-和[Fe(CN)6]3-的浓度基本保持不变 答案:C 解析:由题图可知,电子从负极流向正极,则a为负极,b为正极。b为正极,则K+移向催化剂b,A项正确;a为负极,发生氧化反应,则催化剂a表面发生反应:[Fe(CN)6]4--e-[Fe(CN)6]3-,B项正确;b上发生还原反应,电极反应为[Fe(CN)6]3-+e-[Fe(CN)6]4-,[Fe(CN)6]3-在催化剂b表面被还原,C项错误;由B、C中的电极反应可知,二者以1∶1相互转化,电解质溶液中[Fe(CN)6]3-和[Fe(CN)6]4-浓度基本保持不变,D项正确。 5.(2019安徽安庆五校联盟高三模拟)如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8Li1+xV3O8。工作时,需先引发铁与氯酸钾反应使共晶盐熔化,下列说法不正确的是( )。 A.组装该电池应当在无水、无氧的条件下进行 B.整个过程的能量转化涉及化学能转化为热能和电能 C.放电时LiV3O8电极反应为xLi++LiV3O8-xe-Li1+xV3O8 D.充电时Cl-移向LiV3O8电极 答案:C 解析:Li是活泼的金属,因此组装该电池应当在无水、无氧的条件下进行,A项正确;整个过程的能量转化涉及化学能转化为电能以及化学能和热能之间的转化,B项正确;放电时正极发生得电子的还原反应,即正极反应式为xLi++LiV3O8+xe-Li1+xV3O8,C项错误;放电时Cl-移向负极,即移向锂电极(负极),因此充电时Cl-移向LiV3O8电极(阳极),D项正确。 6.下面4种燃料电池的工作原理示意图,其中正极的反应产物为水的是( )。 答案:C 解析:A项,通入空气的电极作正极,正极反应式:O2+4e-2O2-,不符合题意;B项,通入氧气的一极作正极,电解质溶液是碱性溶液,正极反应式:O2+2H2O+4e-4OH-,不符合题意;C项,通入空气的一极作正极,电解质传递H+,正极反应式:O2+4H++4e-2H2O,符合题意;D项,通入氧气的一极作正极,依据电池内部传递CO32-,正极反应式:O2+2CO2+4e-2CO32-,不符合题意。 7.某原电池装置如图所示,电池总反应为2Ag+Cl22AgCl。下列说法正确的是( )。 A.正极反应为AgCl+e-Ag+Cl- B.放电时,交换膜右侧溶液中有大量白色沉淀生成 C.若用NaCl溶液代替盐酸,则电池总反应随之改变 D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 答案:D 解析:A项,Pt为正极发生还原反应:Cl2+2e-2Cl-,错误;B项,放电时,左侧的电极反应式Ag+Cl--e-AgCl↓,有大量白色沉淀生成,错误;C项,由于H+、Na+均不参与电极反应,则用NaCl溶液代替盐酸,电池总反应不变,错误;D项,当电路中转移0.01 mol e-时,左侧产生0.01 mol Ag+与Cl-结合为AgCl沉淀,右侧产生0.01 mol Cl-,为保持溶液的电中性,左侧约有0.01 mol H+通过阳离子交换膜转移到右侧,故左侧溶液中约减少0.02 mol离子,正确。 8.(2019吉林公主岭高三模拟)有位科学家说:“甲烷是21世纪的新燃料。”甲烷作为燃料的用途之一就是用于制作燃料电池。有科技工作者制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。以下判断错误的是( )。 A.电池正极发生的反应:O2+4e-2O2- B.电池负极发生的反应:CH4+4O2--8e-CO2+2H2O C.固体电解质里的O2-的移动方向:由正极流向负极 D.向外电路释放电子的电极:正极(即电子由正极流向负极) 答案:D 解析:该燃料电池中,正极上氧气得电子生成氧离子,电极反应式为O2+4e-2O2-,A项正确;负极上甲烷失电子与氧离子反应生成二氧化碳和水,电极反应式为CH4+4O2--8e-CO2+2H2O,B项正确;放电时,电解质中阴离子向负极移动、阳离子向正极移动,所以氧离子向负极移动,C项正确;向外电路释放电子的电极是负极,电子从负极流向正极,D项错误。 二、非选择题(本题共3个小题,共52分) 9.(12分)根据下图回答下列问题: Ⅰ.(1)若烧杯中溶液为稀硫酸,则观察到的现象是 ,负极的电极反应式为 。 (2)若烧杯中溶液为氢氧化钠溶液,则负极为 (填“Mg”或“Al”),总反应的化学方程式为 。 Ⅱ.中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。 (1)该电池工作时,b口通入的物质为 ,c口通入的物质为 。 (2)该电池负极的电极反应式为 。 (3)工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有 NA个电子转移。(设NA代表阿伏加德罗常数的值) 答案:Ⅰ.(1)Mg逐渐溶解,Al片上有气泡冒出,电流计指针偏转 Mg-2e-Mg2+ (2)Al 2Al+2NaOH+2H2O2NaAlO2+3H2↑ Ⅱ.(1)CH3OH O2或空气 (2)CH3OH+H2O-6e-CO2↑+6H+ (3)2.4 解析:Ⅰ.(1)若烧杯中溶液为稀硫酸,因Mg的活泼性比Al强,故Mg作负极,负极上发生反应Mg-2e-Mg2+,镁片溶解;Al作正极,正极上发生反应2H++2e-H2↑,故Al片上有气泡冒出;电路中产生电流,故电流计指针偏转。 (2)若烧杯中溶液为氢氧化钠溶液,因为Mg不与NaOH溶液反应,所以Al是负极,Mg是正极,总反应为2Al+2NaOH+2H2O2NaAlO2+3H2↑。 Ⅱ.由H+移动方向可知,左侧为负极,右侧为正极,故b口通入CH3OH,c口通入O2或空气。负极反应式为CH3OH+H2O-6e-CO2↑+6H+。当12.8 g甲醇(即0.4 mol)完全反应生成CO2时,转移2.4 mol电子,即转移2.4NA个电子。 10.(20分)酸性锌锰干电池和碱性锌锰干电池的构造简图如图所示,比较二者的异同,回答下列问题: 化合物 Zn(OH)2 Fe(OH)2 Fe(OH)3 Ksp近似值 10-17 10-17 10-39 (1)酸性锌锰干电池的负极反应为 。 (2)碱性锌锰干电池在放电过程中产生MnOOH,写出正极反应式: 。 (3)维持电流为0.6 A,电池工作10分钟。理论消耗Zn g。(结果保留到小数点后两位,已知1 mol e-的电量为96 500 C) (4)用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下(已知当离子浓度小于1×10-5 mol·L-1时,可认为该离子沉淀完全): ①加入足量稀硫酸和 溶液将锌皮溶解,此时锌离子浓度为0.1 mol·L-1; ②调节溶液的pH为 到 之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀。 答案:(1)Zn-2e-Zn2+ (2)MnO2+H2O+e-MnOOH+OH- (3)0.12 (4)①H2O2 ②2.7 6 解析:(1)酸性锌锰干电池的负极是锌,正极为石墨棒,电解质为二氧化锰和氯化铵,负极发生氧化反应,电极反应式为Zn-2e-Zn2+。 (2)在反应中锌元素化合价升高,被氧化,Zn为负极,电极反应式为Zn+2OH--2e-Zn(OH)2;锰元素化合价降低,被还原,MnO2为正极,电极反应式为MnO2+H2O+e-MnOOH+OH-。 (3)维持电流为0.6 A,电池工作10分钟,则通过的电量是0.6 A×600 s=360 C,因此通过电子的物质的量是36096 500 mol≈3.73×10-3 mol,锌在反应中失去2个电子,则理论上消耗Zn的质量是3.73×10-3mol2×65 g·mol-1≈0.12 g。 (4)H2O2具有强氧化性,能把Fe2+氧化为Fe3+,因此加入足量稀硫酸和过氧化氢溶液,铁转化为硫酸铁。根据Fe(OH)3的溶度积知,当铁离子完全沉淀时溶液中c(OH-)=310-3910-5 mol·L-1≈0.5×10-11 mol·L-1,因此加碱调节pH=2.7时Fe3+刚好完全沉淀。锌离子浓度为0.1 mol·L-1,根据氢氧化锌的溶度积,开始沉淀时的c(OH-)=10-8 mol·L-1,所以c(H+)=10-6 mol·L-1,此时pH=6。 11.(20分)(1)甲醇是重要的可再生燃料。已知在常温常压下: 2CH3OH(l)+3O2(g)2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1 2CO(g)+O2(g)2CO2(g) ΔH=-566.0 kJ·mol-1 H2O(g)H2O(l) ΔH=-44.0 kJ· mol-1 则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。 (2)氧化还原反应与生产、生活、科技密切相关。请回答下列问题: ①银制器皿日久表面变黑是因为表面生成了Ag2S的缘故,该现象属于 腐蚀。如果加入一定浓度硝酸将发生反应:3Ag2S+8HNO36AgNO3+3S↓+2NO↑+4H2O,同时Ag与硝酸反应生成AgNO3、NO、H2O,当生成标准状况下22.4 mL的气体时,参加反应的HNO3的物质的量为 。 ②电解NO制备NH4NO3原理如图所示,接电源正极的电极为 (填“X”或“Y”),X电极反应式为 , 为使电解产物完全转化为NH4NO3,需要补充的物质A的化学式为 。 答案:(1)CH3OH(l)+O2(g)CO(g)+2H2O(l) ΔH=-442.8 kJ·mol-1 (2)①化学 0.004 mol ②Y NO+6H++5e-NH4++H2O NH3 解析:(1)已知:①2CH3OH(l)+3O2(g)2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ· mol-1,②2CO(g)+O2(g)2CO2(g) ΔH=-566.0 kJ· mol-1,③H2O(g)H2O(l) ΔH=-44.0 kJ·mol-1,则根据盖斯定律,由(①-②+4×③)×12得CH3OH(l)+O2(g)CO(g)+2H2O(l) ΔH=-442.8 kJ· mol-1。 (2)①银制器皿日久变黑,表面生成了Ag2S,属于化学腐蚀;Ag、Ag2S分别与硝酸反应的化学方程式为6Ag+8HNO36AgNO3+2NO↑+4H2O、3Ag2S+8HNO36AgNO3+3S↓+2NO↑+4H2O,两个方程式中消耗HNO3和生成NO的化学计量数之比相等,n(NO)=0.022 4 L22.4 L· mol-1=0.001 mol,根据方程式知,n(HNO3)=4n(NO)=4×0.001 mol=0.004 mol。②根据图示知,左侧NO得电子生成NH4+,右侧NO失电子生成NO3-,最终得到NH4NO3,该电解池中失电子的电极为阳极、得电子的电极为阴极,所以X 为阴极、Y为阳极,阳极接电源正极,所以Y接电源正极,X电极反应式为NO+6H++5e-NH4++H2O;生成一个NH4+得到5个电子、生成一个NO3-失去3个电子,根据转移电子相等知,生成NH4+的浓度小于生成NO3-的浓度,要使NO3-完全转化为NH4NO3,应该加入NH3,所以加入的物质A为NH3。查看更多