- 2021-05-10 发布 |
- 37.5 KB |
- 4页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学复习热点题型图表题
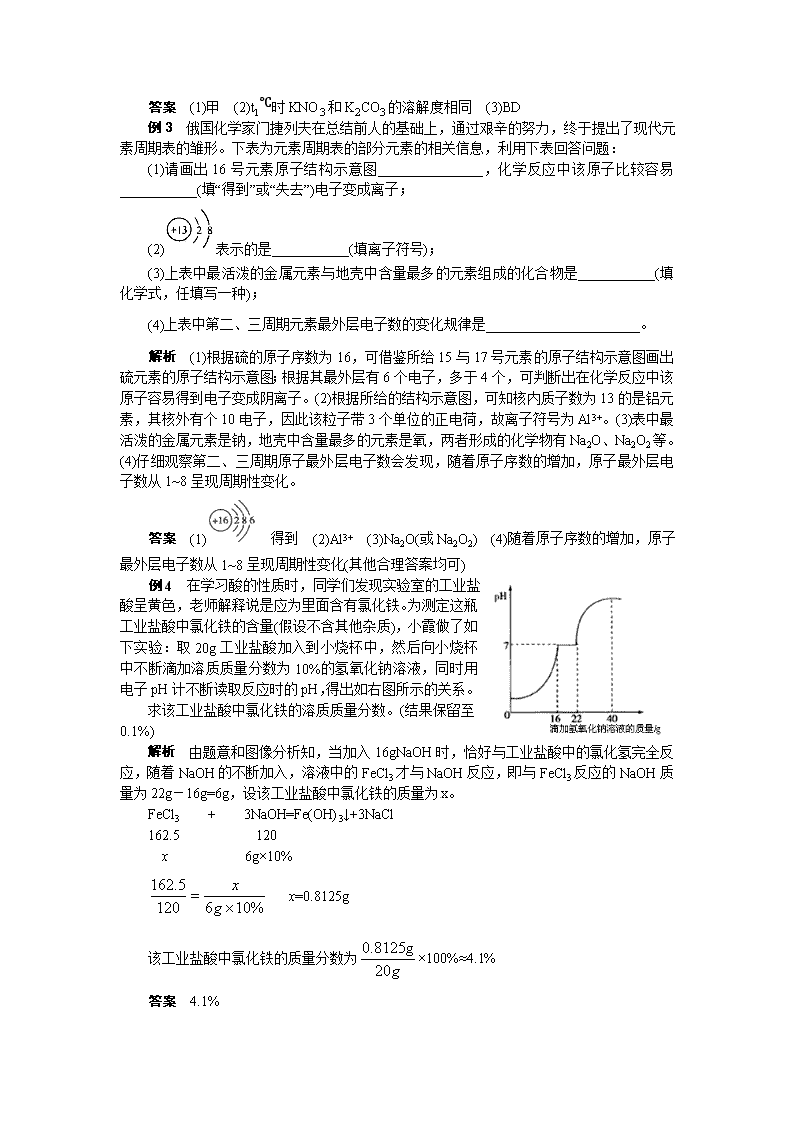
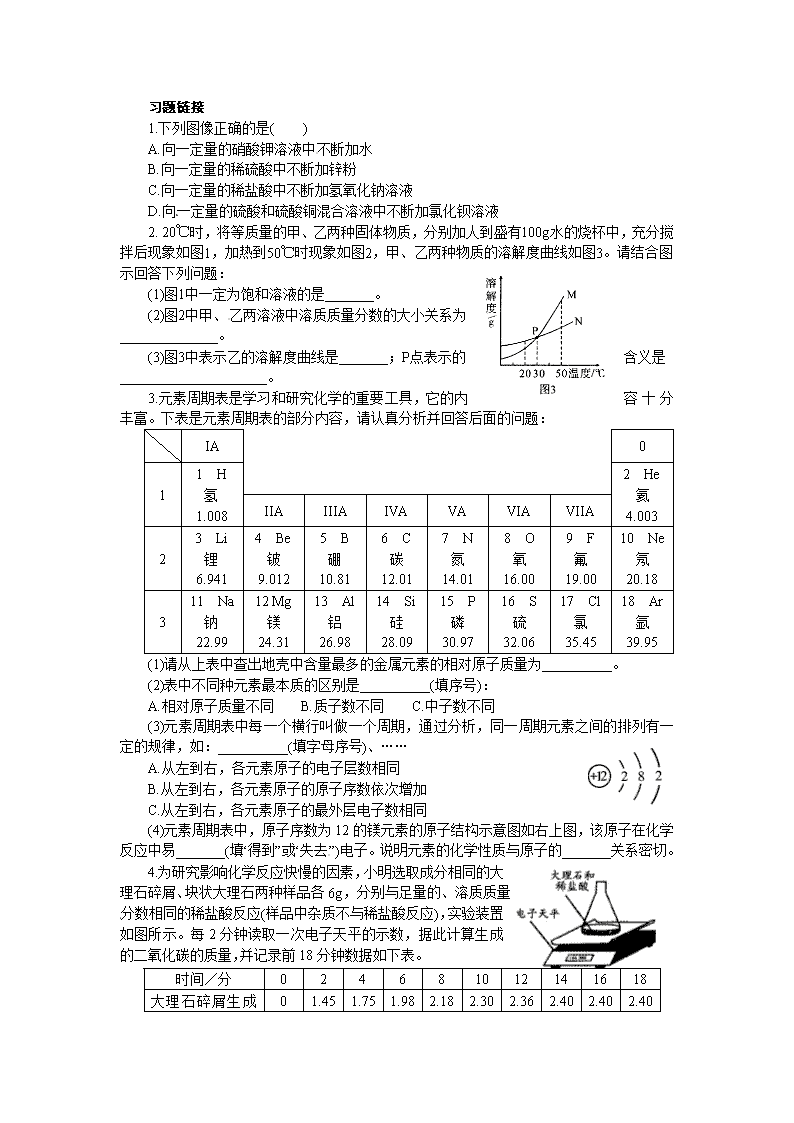
图表题 例1 下列图像能正确反映对应变化关系的是( ) A.向一定量的二氧化锰中加入过氧化氢溶液 B.加热一定量的高锰酸钾固体 C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉 D.将水通电电解一段时间 解析 本题主要根据图像来考查化学反应中各种量的变化。二氧化锰是过氧化氢分解的催化剂,其质量和化学性质在反应前后没有改变,A错误;加热过程中,高锰酸钾分解生成锰酸钾、二氧化锰和氧气,锰元素留在了剩余固体中,而由于氧气的逸出,固体总质量不断减少,因此固体中锰元素的质量分数应不断增大,B错误;由于镁的金属活动性比锌强,所以与盐酸反应时,镁的反应速率快,即相同时间内,镁与盐酸反应产生的氢气质量比锌多,根据化学方程式计算可知,相同质量的盐酸与足量的镁和锌反应产生氢气的总质量应相同,C错误;将水通电电解一段时间,产生氢气的体积是氧气体积的2倍,D正确。 答案 C 例2 溶液的应用非常广泛。K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下: 温度/℃ 20 30 50 60 80 溶解度/g K2CO3] 110 114] 121 126 139 KNO3 31.6 45.8 85.5 110 169 (1)图1中能表示KNO3溶解度曲线的是__________(填“甲”或“乙”)。 (2)曲线上M点的含义是________。 (3)40℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图2所示。 下列有关说法中,正确的是________(填字母)。 A.烧杯②中溶液是不饱和溶液 B.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解 C.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小 D.将得到的烧杯②中溶液降温至20℃时,溶液中溶质质量分数可能不变 解析 本题主要考查饱和溶液与不饱和溶液的转化、溶解度曲线的应用及溶质质量分数等知识,综合性较强。分析表中数据可知,KNO3的溶解度受温度影响变化较大,故图中表示KNO3溶解度曲线的是甲;M点是两曲线的交点,表示t1℃时KNO3和K2CO3的溶解度相同;烧杯②中溶液溶质全部溶解,溶液可能刚好饱和也可能是不饱和,A错误;要使烧杯烧杯①中固体全部溶解,一是增加溶剂,二是升高温度,原因是物质的溶解度随温度的升高而增大,B正确;烧杯①中的溶液升高温度可变为不饱和溶液,此时溶液中溶质的质量分数变大,C错误;烧杯②中溶液降温到20℃时,如果没有晶体析出,溶液中溶质质量分数不变,D正确。 答案 (1)甲 (2)t1℃时KNO3和K2CO3的溶解度相同 (3)BD 例3 俄国化学家门捷列夫在总结前人的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形。下表为元素周期表的部分元素的相关信息,利用下表回答问题: (1)请画出16号元素原子结构示意图_______________,化学反应中该原子比较容易___________(填“得到”或“失去”)电子变成离子; (2)表示的是___________(填离子符号);[来源:] (3)上表中最活泼的金属元素与地壳中含量最多的元素组成的化合物是___________(填化学式,任填写一种); (4)上表中第二、三周期元素最外层电子数的变化规律是______________________。 解析 (1)根据硫的原子序数为16,可借鉴所给15与17号元素的原子结构示意图画出硫元素的原子结构示意图;根据其最外层有6个电子,多于4个,可判断出在化学反应中该原子容易得到电子变成阴离子。(2)根据所给的结构示意图,可知核内质子数为13的是铝元素,其核外有个10电子,因此该粒子带3个单位的正电荷,故离子符号为Al3+。(3)表中最活泼的金属元素是钠,地壳中含量最多的元素是氧,两者形成的化学物有Na2O、Na2O2等。(4)仔细观察第二、三周期原子最外层电子数会发现,随着原子序数的增加,原子最外层电子数从1~8呈现周期性变化。 答案 (1) 得到 (2)Al3+ (3)Na2O(或Na2O2) (4)随着原子序数的增加,原子最外层电子数从1~8呈现周期性变化(其他合理答案均可) 例4 在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是应为里面含有氯化铁。为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),小霞做了如下实验:取20g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如右图所示的关系。 求该工业盐酸中氯化铁的溶质质量分数。(结果保留至0.1%) 解析 由题意和图像分析知,当加入16gNaOH时,恰好与工业盐酸中的氯化氢完全反应,随着NaOH的不断加入,溶液中的FeCl3才与NaOH反应,即与FeCl3反应的NaOH质量为22g-16g=6g,设该工业盐酸中氯化铁的质量为x。 FeCl3 + 3NaOH=Fe(OH)3↓+3NaCl 162.5 120 x 6g×10% x=0.8125g 该工业盐酸中氯化铁的质量分数为×100%≈4.1% 答案 4.1% 习题链接 1.下列图像正确的是( ) A.向一定量的硝酸钾溶液中不断加水 B.向一定量的稀硫酸中不断加锌粉 C.向一定量的稀盐酸中不断加氢氧化钠溶液 D.向一定量的硫酸和硫酸铜混合溶液中不断加氯化钡溶液 2. 20℃时,将等质量的甲、乙两种固体物质,分别加人到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题: (1)图1中一定为饱和溶液的是_______。 (2)图2中甲、乙两溶液中溶质质量分数的大小关系为______________。 (3)图3中表示乙的溶解度曲线是_______;P点表示的含义是_____________________。 3.元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是元素周期表的部分内容,请认真分析并回答后面的问题: IA 0 1 1 H 氢 1.008 2 He 氦 4.003 IIA IIIA IVA VA VIA VIIA 2 3 Li 锂 6.941 4 Be 铍 9.012 5 B 硼 10.81 6 C 碳 12.01 7 N 氮 14.01 8 O 氧 16.00 9 F 氟 19.00 10 Ne 氖 20.18 3 11 Na 钠 22.99 12 Mg 镁 24.31 13 Al 铝 26.98 14 Si 硅 28.09 15 P 磷 30.97 16 S 硫 32.06 17 Cl 氯 35.45 18 Ar 氩 39.95 (1)请从上表中查出地壳中含量最多的金属元素的相对原子质量为__________。 (2)表中不同种元素最本质的区别是__________(填序号): A.相对原子质量不同 B.质子数不同 C.中子数不同 (3)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如:__________(填字母序号)、…… A.从左到右,各元素原子的电子层数相同 B.从左到右,各元素原子的原子序数依次增加 C.从左到右,各元素原子的最外层电子数相同 (4)元素周期表中,原子序数为12的镁元素的原子结构示意图如右上图,该原子在化学反应中易_______(填“得到”或“失去”)电子。说明元素的化学性质与原子的_______关系密切。 4.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6g,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图所示。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下表。 时间/分 0 2 4 6 8 10 12 14 16 18 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40 大理石碎屑生成的CO2质量/g 块状大理石生成的CO2质量/g 0 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20 (1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束?______________。 (2)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由:_____________________。 (3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应? 答案 1.D 2.(1)甲 (2)相等(或甲=乙) (3)N 30℃ 时,甲、乙两种固体物质的溶解度相等 3.(1)26.98 (2)B (3)AB (4)失去 最外层电子数 4.(1)容器内不再产生气泡(或电子天平的示数不再变化) (2)2.40g 查表可知,大理石碎屑完全反应生成的二氧化碳质量是2.40g,而块状大理石与其质量、成分都相同,所以完全反应生成的二氧化碳质量也是2.40g (3)5g查看更多