高考化学考点24 原子结构
1
一、微粒的组成与结构一、微粒的组成与结构
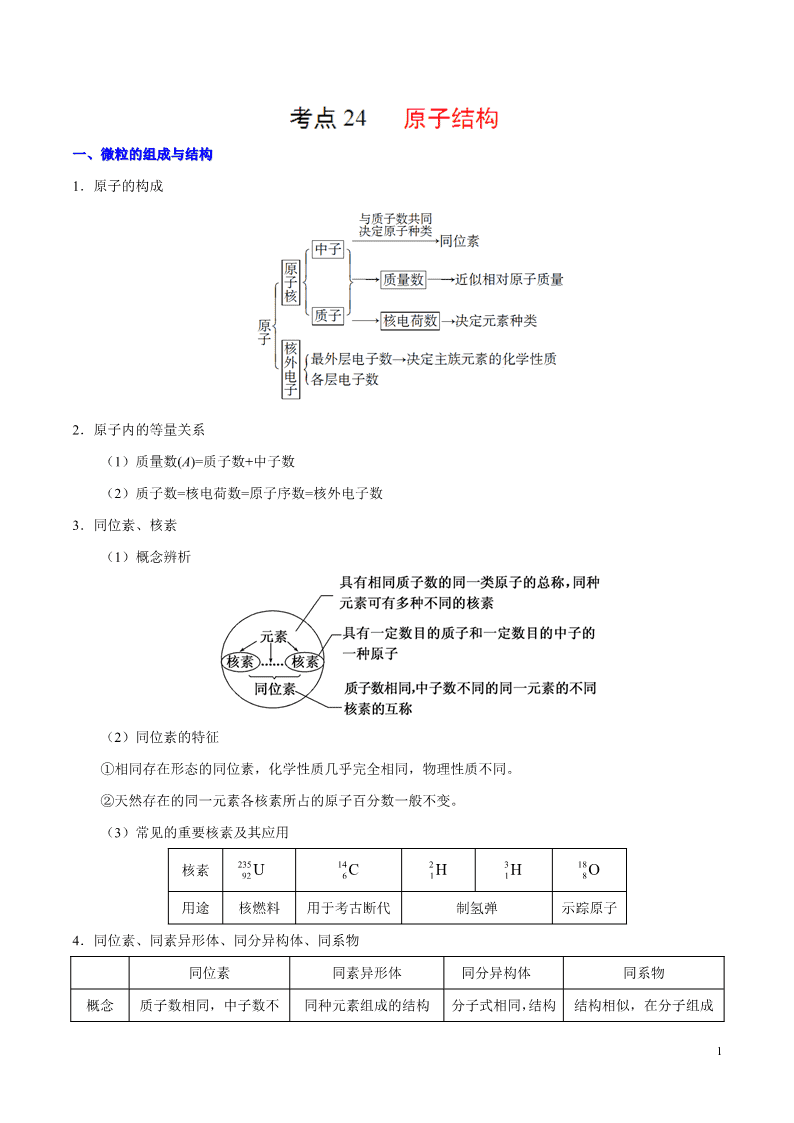
1.原子的构成
2.原子内的等量关系
(1)质量数(A)=质子数+中子数
(2)质子数=核电荷数=原子序数=核外电子数
3.同位素、核素
(1)概念辨析
(2)同位素的特征
①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用
核素 [来源:]
用途 核燃料 用于考古断代 制氢弹 示踪原子
4.同位素、同素异形体、同分异构体、同系物
同位素 同素异形体 同分异构体[来源:ZXXK] 同系物
概念 质子数相同,中子数不 同种元素组成的结构 分子式相同,结构 结构相似,在分子组成
235
92 U 14
6 C 2
1 H 3
1 H 18
8O
2
同的同一种元素的不同
原子之间互为同位素
不同的单质之间互为
同素异形体
不同的化合物互
为同分异构体
上相差一个或若干个
CH2 原子团的物质互称
同系物
对象 原子之间 单质之间
一般为有机
化合物之间
有机化合物之间
化学
性质
几乎完全相同
相似,一定条件下可以
相互转变
可能相似也可能
不同
相似
实例
金刚石与石墨、C60;
红磷与白磷
CH3COOH
与
HCOOCH3
甲烷、乙烷、丙烷;乙
烯、丙烯;甲酸、乙酸
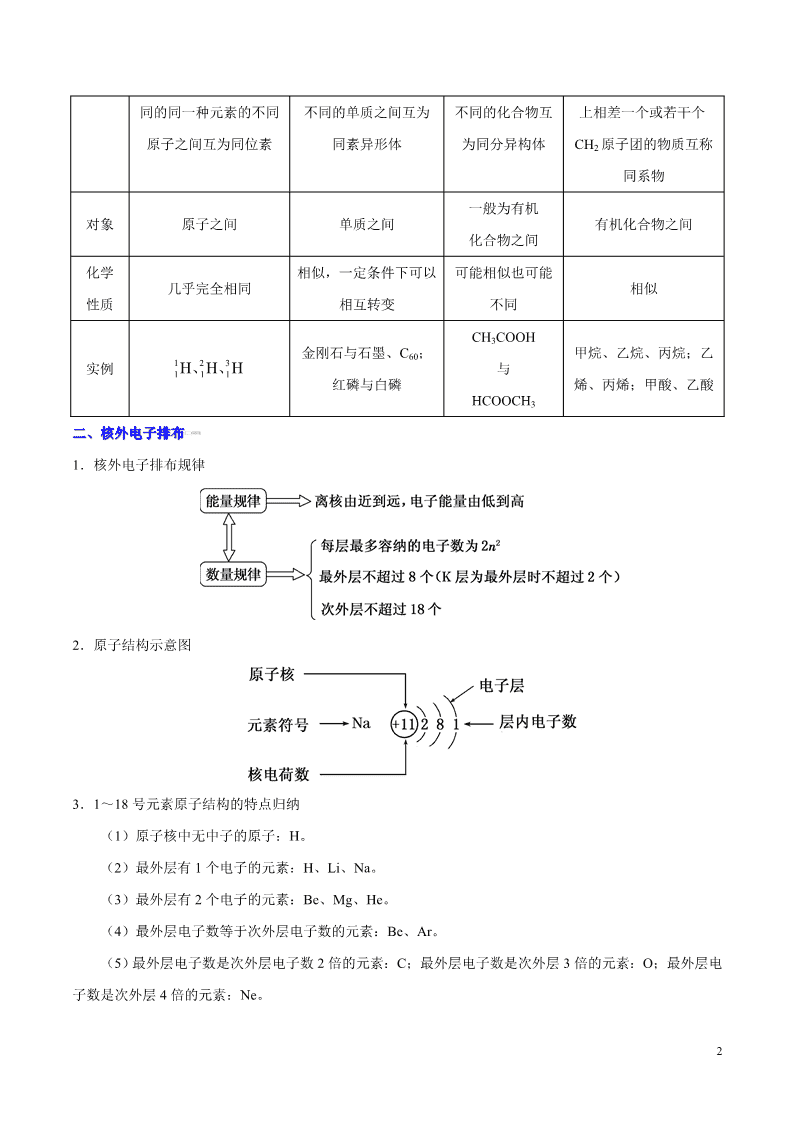
二、核外电子排布二、核外电子排布[[来源来源:ZXXK]:ZXXK]
1.核外电子排布规律
2.原子结构示意图
3.1~18 号元素原子结构的特点归纳
(1)原子核中无中子的原子:H。
(2)最外层有 1 个电子的元素:H、Li、Na。
(3)最外层有 2 个电子的元素:Be、Mg、He。
(4)最外层电子数等于次外层电子数的元素:Be、Ar。
(5)最外层电子数是次外层电子数 2 倍的元素:C;最外层电子数是次外层 3 倍的元素:O;最外层电
子数是次外层 4 倍的元素:Ne。
1 2 3
1 1 1H H H、 、
3
(6)电子层数与最外层电子数相等的元素:H、Be、Al。
(7)电子总数为最外层电子数 2 倍的元素:Be。
(8)次外层电子数是最外层电子数 2 倍的元素:Li、Si。
(9)内层电子总数是最外层电子数 2 倍的元素:Li、P。
(10)电子层数是最外层电子数 2 倍的元素:Li。
(11)最外层电子数是电子层数 2 倍的元素:He、C、S。
(12)最外层电子数是电子层数 3 倍的元素:O。
考向一 原子中各种微粒数目之间的关系及计算
典例 1 YBa2Cu8Ox(Y 为元素钇)是磁悬浮列车中的重要超导材料,关于 的说法正确的是
A. 的质子数与中子数之差为 50
B. 和 为同位素[来源:学_科_网]
C. 和 的核外电子数不相等
D. 和 是钇元素的两种不同的核素,具有不同的化学性质
【答案】B
1.下列说法正确的是
①1H、2H、3H 为三种不同的核素 ②1H、2H、3H 互为同位素 ③1H、2H、3H 互为同素异形体 ④114
号元素位于周期表第七周期ⅤA 族 ⑤氢元素质量数为 1 ⑥同位素的“同位”指核素的质子数相同,在
元素周期表中占相同的位置 ⑦互为同位素的原子性质相同
A.①②④⑥⑦ B.①②③⑤⑥
C.①②⑥ D.①②③⑥⑦
89
39Y
89
39Y
89
39Y 90
39Y
89
39Y 90
39Y
89
39Y 90
39Y
4
考向二 核外电子排布规律
典例 1 某元素 X,其原子的电子层数为(n-1),最外层电子数为(2n-1)。下列有关元素 X 的说法中正确的
是
A.X 可能是金属元素
B.由 X 形成的含氧酸均为强酸
C.X 不能形成化学式为 KXO4 的含氧酸盐
D.元素 X 的气态氢化物一定极易溶于水
【答案】D
2.短周期主族元素 W、X、Y、Z 原子序数依次增大,W 原子的最外层电子数是 X 原子最外层电子数的两
倍,质子数比 X 原子少 5 个,Y 原子的最外层电子数是次外层电子数的一半,Z 和 W 在同一主族。下列
说法正确的是
A.原子半径:W
r(X)>r(Z),原子序数之和为 16。X、Y、Z 三
种元素的常见单质在适当条件下发生如图所示变化,其中乙和丙均为 10 电子分子。下列说法不正确的是
A.元素 X 位于第ⅥA 族
B.甲不能溶解于乙中
C.甲和丙在一定条件下能发生氧化还原反应
D.乙的沸点低于丙的沸点
推断 10e−和 18e−微粒的思维模型
1.10 电子微粒
S最外层电子数是电子层数的2倍
最外层电子数是次外层电子数的2倍
2NO
3CH
4NH
6
2.18 电子微粒
(1)
(2)“双九”微粒:—F、—OH、—NH2、—CH3 的相互组合,如:F2、H2O2、N2H4、C2H6、CH3F、
CH3OH、CH3NH2。
1.下列说法不正确的是
①质子数相同的粒子一定是同一元素 ②质子数相同且电子数也相同的两种粒子不可能一种是分子,另
一种是离子 ③电子数相同的粒子不一定是同种元素 ④一种元素不能形成不同单质 ⑤某元素的相对
原子质量取整数值就是质量数
A.②④⑤ B.①④⑤
C.②③④ D.②③
2.地表水和地下水都来源于大气降水,但重水和轻水中同位素含量是不同的,有时差别还相当大,氢包括
两种稳定核素:H 和 D,氧常见的核素 16O、17O 和 18O,下列有关说法正确的是
A.H2 和 D2 互为同分异构体,其化学性质完全相同
B. 、 、 互为同位素,都能与金属钠发生反应
C.18O2 和 18O3 互为同素异形体,其密度之比为 2∶3
D.电解一定量的 时,阴、阳两极所得气体的质量之比约为 2∶9
3.1934 年居里夫妇用 α 粒子( 4He)轰击 27Al 得到一种自然界不存在的磷元素的一种同位素( ):
,开创了人造核素的先河。下列有关说法不正确的是
A.该变化说明原子核在一般的化学反应中也能发生变化
B.该变化同样遵循质量守恒定律
16
2H O 17
2H O 18
2H O
18
2D O
30
15 P
7
C. 是一种电中性粒子
D.对于 有:原子序数=质子数=中子数=核外电子数
4.具有广泛用途的 放射源首次实现了国内批量生产。另外,钴还有多种原子,如 、 、
、 。下列关于钴原子的说法正确的是
A. 、 、 、 和 是摩尔质量不同的五种同素异形体
B. 放射源可以用来治疗癌症,其中子数与电子数之差等于 6
C. 、 、 、 和 互为同位素,物理性质几乎相同,化学性质不同
D. 、 、 、 和 互为同分异构体
5.设 X、Y、Z 代表元素周期表中前 4 周期的三种元素,已知 X+和 Y-具有相同的电子层结构;Z 元素的原
子核内质子数比 Y 元素的原子核内质子数少 9;Y 和 Z 两种元素可形成含 4 个原子核、42 个电子的负一
价阴离子。下列说法不正确的是
A.元素 Z 的气态氢化物分子中含有 10 个电子
B.元素 Y 的气态氢化物分子中含有 18 个电子
C.元素 Z 与元素 X 形成的化合物 X2Z 中离子都达到稳定结构
D.元素 Y、Z 组成的化合物属于离子化合物
6.已知阴离子 R2−的原子核内有 n 个中子,R 原子的质量数为 m,则 ω g R 原子完全转化为 R2−时,含有电
子的物质的量是
A. mol B. mol
C. mol D. mol
7.在电解冶炼铝的电解槽中存在电解质 W2[X2Y2Z4]。已知其涉及的四种元素的简单离子的电子层结构均相
同,Y 原子最外层电子数为次外层的 3 倍,X 原子最外层电子数为 Y 原子最外层电子数的一半。下列说
法正确的是[来源:Zxxk.Com]
A.原子序数:W>X>Y>Z
B.原子半径:W>X>Y>Z
C.最高价氧化物对应的碱的碱性:WZ
1
0 n
30
15 P
60
27 Co 56
27 Co 57
27 Co
58
27 Co 59
27 Co
56
27 Co 57
27 Co 58
27 Co 59
27 Co 60
27 Co
60
27 Co
56
27 Co 57
27 Co 58
27 Co 59
27 Co 60
27 Co
56
27 Co 57
27 Co 58
27 Co 59
27 Co 60
27 Co
2m n
m
m n
n
( )
2m n
m ( ) +2m nm
( )
8
8.元素 X、Y、Z、M、N 均为短周期主族元素,且原子序数依次增大。已知 Y 元素原子最外层电子数与核
外电子总数之比为 3∶4,M 元素原子的最外层电子数与次外层电子数之比为 3∶4,且 M 原子的质子数
是 Y 原子的 2 倍;N-、Z+、X+的半径逐渐减小;化合物 XN 在常温下为气体。
据此回答下列问题。
(1)写出 Z 与 N 形成的化合物的电子式________________。
(2)X 与 Y 可分别形成 10 电子和 18 电子的分子,写出该 18 电子分子转化成 10 电子分子的化学方程
式________________(分解反应)。
(3)如图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请
写出该转化过程的化学方程式:________________。
(4)A、B 均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为 1∶1∶1。
若在各自的水溶液中,A 能抑制水的电离,B 能促进水的电离,则 A 的化学式为________________,B
的化学式为________________。
1.[2018 新课标Ⅲ]下列叙述正确的是
A.24 g 镁与 27 g 铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1 mol 重水与 1 mol 水中,中子数比为 2∶1
D.1 mol 乙烷和 1 mol 乙烯中,化学键数相同
2.[2017 北京]2016 年 IUPAC 命名 117 号元素为 Ts(中文名“ ”,tián),Ts 的原子核外最外层电子数是
7。下列说法不正确的是
A.Ts 是第七周期第ⅦA 族元素 B.Ts 的同位素原子具有相同的电子数
C.Ts 在同族元素中非金属性最弱 D.中子数为 176 的 Ts 核素符号是
3.[2016·江苏]下列有关化学用语表示正确的是
A.中子数为 10 的氧原子:
176
117 Ts
10
8 O
9
B.Mg2+的结构示意图:
C.硫化钠的电子式:
D.甲酸甲酯的结构简式:C2H4O2
4.[2015·上海]中国科学技术名词审定委员会已确定第 116 号元素 Lv 的名称为 。关于 的叙述错误
的是
A.原子序数 116 B.中子数 177
C.核外电子数 116 D.相对原子质量 293
1.【答案】C
2.【答案】C 学&
【解析】W 原子的最外层电子数是 X 原子最外层电子数的两倍,质子数比 X 少 5,则应为第二周期元素,
X 为第三周期元素,设 W 的最外层电子数为 2x,则 X 的最外层电子数为 x,则有(2+8+x)−5=2+2x,x=3,
则 W 的原子序数为 8,为 O 元素,X 的原子序数为 13,为 Al 元素,Z 和 W 在同一主族,则 Z 为 S 元
素;Y 原子的最外层电子数是 次外层电子数的一半,则为 C 或 Si 元素,由于 Y 的原子序数大于 O,所
以 Y 为 Si;电子层数越多,原子半径越大,电子层数相同时,原子序数越大半径越小,则原子半径:
WW>Z>Y,故 A 错误;原子
电子层数越多其原子半径越大,同一周期元素, 原子半径随着原子序数增大而减小,所以原子半径:
W(Na)>X(Al)>Y(O)>Z(F),故 B 正确;金属性 W>X,所以最高价氧化物对应的碱的碱性:W>X,故 C
错误;非金属性 Z>Y,所以最简单氢化物的稳定性:Y
查看更多