- 2021-05-10 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新课程下高考试题中平衡常数的考查方式
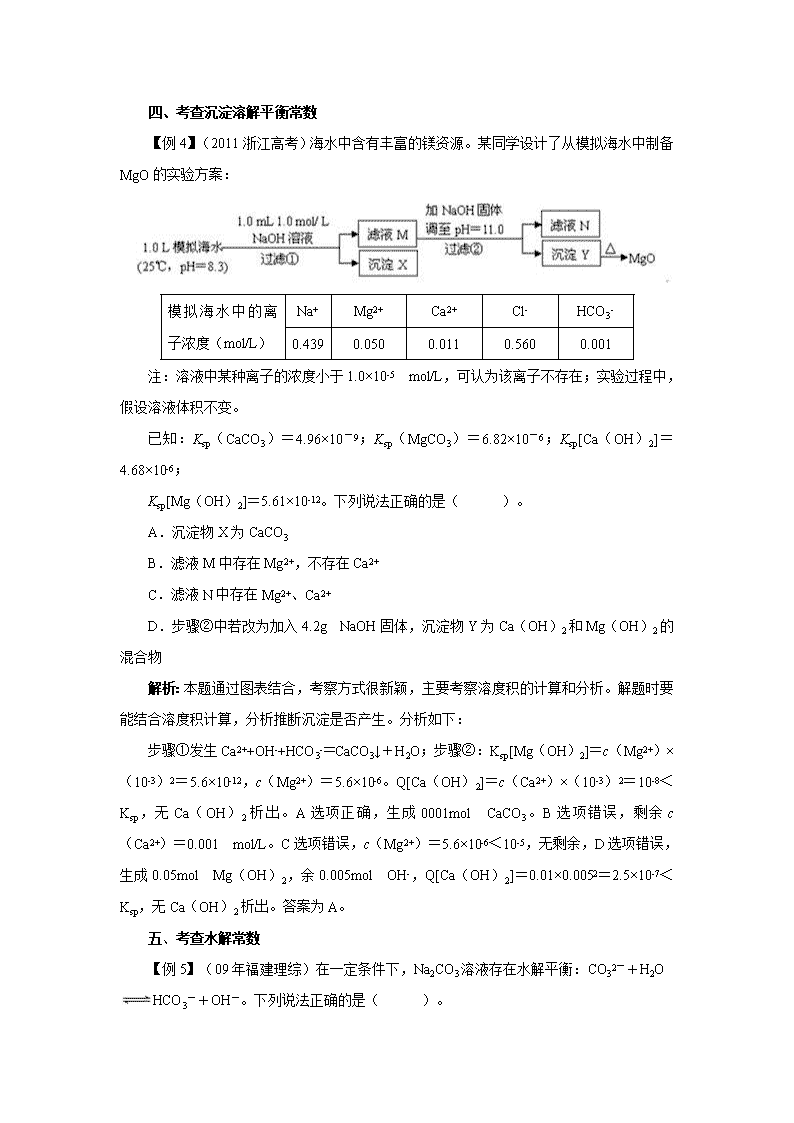
新课程下高考试题中平衡常数的考查方式 人教版化学新课标的新增内容:化学平衡常数、水的离子积常数、电离平衡常数、沉淀溶解平衡常数及水解平衡常数从定量的角度进一步加深了学生对勒夏特列原理(即化学平衡移动原理)的认识和理解,为学生灵活解决化学平衡问题提供了理论依据,有利于学生思维能力的发展和创新能力的培养。因而这部分内容倍受高考命题专家青睐,已成为高考的重点及热点内容。现将最近几年新课程下高考试题中平衡常数的考查方式归纳总结如下: 一、考查化学平衡常数 【例1】(2011海南高考题)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题: (1)该反应的离子方程式为__________; (2)估算该反应的平衡常数__________(列式计算) (3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动; (4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。 解析:本题为化学平衡相关内容的综合考查,平衡题在近年的高考题中比较平和,但新课标高考题今年引入了对过程呈现的考查,这是以后高考中应注意的。分析如下: 氯气与水反应是解题关键。题干中用“溶于水的Cl2约有三分之一与水反应”给出可逆反应(该反应在教材中通常没提及可逆);平衡常数的计算根据题中要求列三行式求算;平衡移动是因为H+的减少向正反应方向移动;增大压强将增大氯气的浓度,平衡向正反应方向移动。 答案为:(1); (3)正反应方向;(4)增大,正反应方向。 二、考查水的离子积常数 【例2】在T℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如下表所示: 序号 NaOH溶液的体积/mL HCl溶液的体积/mL 溶液的pH ① 20.00 0.00 8 ② 20.00 20.00 6 假设溶液混合前后的体积变化忽略不计,则c为( )。 A.3 B.4 C.5 D.6 解析:解答本题的关键是:一审温度:有关溶液pH的计算与KW关系极为密切,只有在给定的温度下的KW才能用c(H+)和c(OH-)来和换算。二审数据:如本题中首先要审题干,分析在NaOH溶液中c(H+)、c(OH-)数据的作用(用T℃时KW的计算),结合表格数据根据KW来判断溶液的pH,据此来计算出c(NaOH)、c(HCl),从而得出c的值。 根据题意可知在该温度下,水的离子积常数是1×10-12,而不是1×10-14,通过①可知,此NaOH溶液中c(OH-)=1×10-4mol/L,由②可知,加入20.00 mL盐酸后溶液的pH=6,此时恰好完全中和。则盐酸中c(H+)=0.020L×10-4mol/L÷0.020L=1×10-4mol/L,则c=4。答案为B。 三、考查电离平衡常数 【例3】(2009年海南化学 6)已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )。 A.该溶液的pH=4 B.升高温度,溶液的pH增大 C.此酸的电离平衡常数约为1×10-7 D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍 解析:根据HA在水中的电离度可算出c(H+)=0.1×0.1%mol·L-1=10-4 mol·L-1,所以pH=4;因HA在水中有电离平衡,升高温度促进平衡向电离的方向移动,所以c(H+)将增大,pH值会减小;C选项可由平衡常数表达式算出K==1×10-7,所以C无错误。c(H+)=10-4 mol·L-1,所以c(H+,水电离)=10-10 mol·L-1,前者是后才的106倍。答案B。 四、考查沉淀溶解平衡常数 【例4】(2011浙江高考)海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案: 模拟海水中的离子浓度(mol/L) Na+ Mg2+ Ca2+ Cl- HCO3- 0.439 0.050 0.011 0.560 0.001 注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。 已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp[Ca(OH)2]=4.68×10-6; Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )。 A.沉淀物X为CaCO3 B.滤液M中存在Mg2+,不存在Ca2+ C.滤液N中存在Mg2+、Ca2+ D.步骤②中若改为加入4.2g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物 解析:本题通过图表结合,考察方式很新颖,主要考察溶度积的计算和分析。解题时要能结合溶度积计算,分析推断沉淀是否产生。分析如下: 步骤①发生Ca2++OH-+HCO3-=CaCO3↓+H2O;步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出。A选项正确,生成0001mol CaCO3。B选项错误,剩余c(Ca2+)=0.001 mol/L。C选项错误,c(Mg2+)=5.6×10-6<10-5,无剩余,D选项错误,生成0.05mol Mg(OH)2,余0.005mol OH-,Q[Ca(OH)2]=0.01×0.0052=2.5×10-7<Ksp,无Ca(OH)2析出。答案为A。 五、考查水解常数 【例5】(09年福建理综)在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2OHCO3-+OH-。下列说法正确的是( )。 A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡朝正反应方向移动 C.升高温度,减小 D.加入NaOH固体,溶液pH减小 解析:因平衡常数仅与温度有关,故稀释时是不变的,A项错误;CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确;因水解过程是吸热过程,升温,促进水解,平衡正向移动,故表达式的结果是增大的,C项错误;D项,加入NaOH,碱性肯定增强,pH增大,故D项错误。答案为B。 六、已知某反应的平衡常数求另一反应的平衡常数 【例6】(2011福建高考题节选)四氯化钛(TiCl4)是制取航天航空工业材料──钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下: 回答下列问题: (3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++H2O的平衡常数K=_____________。 解析:本题是典型的化工流程题,问题设置不难。但第(3)问设计精妙!利用数学关系巧妙代换求出反应的平衡常数,机智灵活地考查了沉淀溶解平衡常数与水的离子积常数之间的关系,命题者可谓独具匠心。分析如下: (3)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH—)=2.79×10—39,25℃时,c(H+)×c(OH—)=Kw=1×10—14;反应Fe(OH)3+3H+Fe3++H2O的平衡常数K====2.79×103。 七、利用平衡常数确定粒子浓度比值的变化 【例7】(2011山东高考)室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )。 A.溶液中导电粒子的数目减少 B.溶液中不变 C.醋酸的电离程度增大,c(H+)亦增大 D.再加入10ml pH=11的NaOH溶液,混合液pH=7 解析:醋酸属于弱酸,加水稀释有利于醋酸的电离,所以醋酸的电离程度增大,同时溶液中导电粒子的数目会增大,由于溶液体积变化更大,所以溶液的酸性会降低,即c(H+)、c(CH3COO-)、c(CH3COOH)均会降低,因此选项A、C均不正确;由水的离子积常数知,所以=其中表示醋酸的电离平衡常数,由于水的离子积常数和醋酸的电离平衡常数均只与温度有关,所以选项B正确;pH=3的醋酸说明醋酸的浓度大于0.001mol/L,pH=11的NaOH溶液说明氢氧化钠的浓度等于0.001mol/L,因为在稀释过程中醋酸的物质的量是不变的,因此加入等体积的pH=11的NaOH溶液时,醋酸会过量,因此溶液显酸性,D不正确。答案为B。 八、利用平衡常数确定溶液中的离子浓度 【例8】(原创题)已知:25℃时醋酸的电离平衡数:Ka(CH3COOH)=1.8×10-5,水的离子积常数:Kw=c(H+)·c(OH—)=1×10-14。则25℃时,0.1mol·L-1CH3COONa水溶液中,c(OH-)约为( )。(已知:√1.8“=1.34) A.1×10-7mol/L B.1.8×10-6mol/L C.7.5×10-6mol/L D.7.5×10-5mol/L 解析:本题设计的意图是利用数学关系巧妙代换求出水解平衡常数,灵活地考查了水解平衡常数与电离平衡数、水的离子积常数之间的关系。分析如下: 故本题答案选C。 九、利用平衡常数确定溶液的pH或酸碱性 【例9】(2013年高考新课标Ⅱ卷)室温时,M(OH)2(s)M2+(aq)+2OH-(aq),Ksp=a;c(M2+)=b mol·L-1时,溶液的pH等于( )。 A. B. C.14+ D.14+ 答案选C。 【例10】若250C时某一元酸HA的电离平衡常数Ka=1×10-8,将0.1mol.L-1的HA溶液和0.1mol.L-1的NaA溶液等体积混合后,则混合溶液( )。 A.呈中性 B.呈碱性 C.呈酸性 D.不能确定溶液的酸碱性 解析:溶液中存在:HAH++A- Ka=1×10-8 A-+H2OOH-+HA Kh=c(HA)×c(OH-)/c(A-)=c(HA)×Kw/c(H+)×c(A-)=Kw/Ka =1×10-14/1×10-8=1×10-6 因Kh﹥Ka,即水解大于电离,故c(OH-)﹥c(H+),溶液显碱性。答案选B。 十、利用图像确定平衡常数 【例11】(2013年高考浙江化学试题)25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )。 A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX B.根据滴定曲线,可得Ka(HY)≈10—5 C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时: c(X—)>c(Y—)>c(OH—)>c(H+) D.HY与HZ混合,达到平衡时: 解析:弱酸HY的电离平衡式HY(aq)H+(aq)+Y-(aq)知,当0.1000 mol/L的NaOH溶液滴加到10.00 mL时,c(HY)=c(Y-),pH=5,c(H+)=10-5mol/L, Ka(HY)=c(H+)×c(Y-)/c(HY)≈10-5 答案选B。 十一、利用平衡常数判断化学反应的正误 【例12】(2013年高考上海化学试卷)部分弱酸的电离平衡常数如下表: 弱酸 HCOOH HCN H2CO3 电离平衡常数 (25℃) Ki=1.77×10-4 Ki=4.9×10-10 Ki1=4.3×10-7 Ki2=5.6×10-11 下列选项错误的是( )。 A.2CN-+H2O+CO2→2HCN+CO32- B.2HCOOH+CO3 2-→2HCOO-+H2O+CO2↑ C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 解析:由表中数据可知,酸性HCOOH>H2CO3>HCN>HCO3-。 根据强制弱的规律,A项中的产物错误,因为HCN+CO32—=HCO3—+CN-, 因HCOOH的酸性比HCN的酸性强,所以HCOONa的水解程度比NaCN要小,NaCN溶液中c(H+)1小于HCOONa溶液中c(H+)2。 根据电荷守恒:NaCN溶液中:c(Na+)+c(H+)1=c(CN-)+c(OH-) NaCN溶液中离子总物质的量为:,n1=2[c(Na+)+c(H+)1]v HCOONa溶液中:c(Na+)+c(H+)2=c(HCOO-)+c(OH-) HCOONa溶液中离子总物质的量为:,n2=2[c(Na+)+c(H+)2]v 显然,n1<n2,D项错误。答案选AD。 十二、利用化学反应判断平衡常数 【例13】(1)三种弱酸HA、H2B、HC,电离常数的数值为:1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应: ①HA+HB-(少量)===A-+H2B ②H2B(少量)+C-===HB-+HC ③HA(少量)+C-===A-+HC 则三种酸对应的电离常数分别为(请填空): HA H2B HC Ka Ka1 Ka2 Ka 1.8×10-5 4.3×10-7 (2)25℃时0.1 mol·L-1的H2D水溶液中,用氢氧化钠来调节溶液的pH,得到含有H2D、HD-、D2-三种微粒的溶液。 ①当溶液的pH=7时,c(Na+)=________(填微粒间量的关系)。 ②当c(Na+)=c(D2-)+c(HD-)+c(H2D)时溶液为________溶液(填物质的化学式)。 解析:(1)由反应式①知,酸性HA>H2B;由反应式②知,酸性H2B>HC>HB-;由反应式③知,酸性HA>HC。则有Ka(HA)>Ka(H2B)>Ka(HC)>Ka(HB-)。 (2)①根据溶液中电荷守恒,得c(Na+)+c(H+)=c(HD-)+2c(D2-)+c(OH-),当pH=7时,即c(H+)=c(OH-),则c(Na+)=c(HD-)+2c(D2-)。 ②根据物料守恒,只有当溶质为NaHD时,才能使溶液中: c(Na+)=c(D2-)+c(HD-)+c(H2D)。 答案:(1) HA H2B HC Ka Ka1 Ka2 Ka 1.8×10-5 4.3×10-7 5.6×10-11 4.9×10-10 (2)①c(HD-)+2c(D2-) ②NaHD查看更多