- 2021-05-10 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河南省豫西名校2020-2021高二化学10月联考试题(Word版附答案)
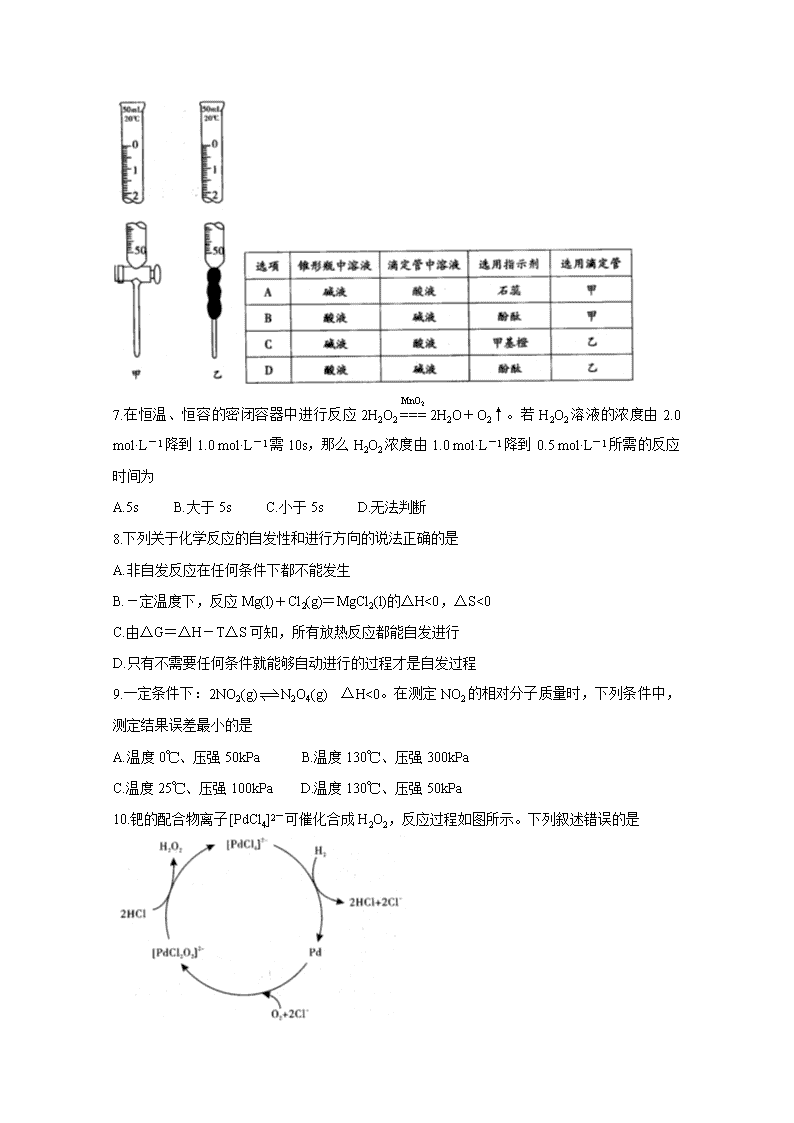
www.ks5u.com 豫西名校2020-2021学年上期第一次联考 高二化学试题 (考试时间:90分钟 试卷满分:100分) 可能用到的相对原子质量:H1 C12 O16 N14 Na23 Mg24 S32 K39 Cr52 Ag108 一、选择题(本大题共17小题,每小题3分,共51分。每个小题只有一个选项符合题意) 1.据报道,加拿大科学家发明了一种特殊的“电催化剂”,该新型“电催化剂”是一种用于电解器中催化水分解为氢气与氧气的多孔金属氧化物固体。下列有关该催化剂的说法正确的是 A.使用该催化剂,能减小水分解反应的焓变 B.该催化剂的使用可提高水的分解率 C.金属氧化物固体的多孔结构,可提高催化剂的催化效率 D.该催化剂还可以作其他所有液态化合物分解反应的催化剂 2.下列物质属于强电解质的是 A.KAl(SO4)2·12H2O B.HF C.漂白粉 D.液氨 3.关于pH的测定,下列说法正确的是 A.pH试纸在使用前应用蒸馏水润湿 B.用广泛pH试纸测得某盐酸的pH=2.3 C.利用酸碱指示剂可以测溶液的pH D.pH计是一种精确测量溶液pH的仪器 4.下列实验事实或数据可以说明次氯酸为弱电解质的是 A.次氯酸具有漂白性 B.0.001 mol·L-1的HClO溶液的pH=5.6 C.用HClO溶液做导电实验时,灯泡很暗 D.温度为25℃时,次氯酸的水溶液的pH<7 5.对于可逆反应:2SO2(g)+O2(g)2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是 A.增大压强 B.升高温度 C.使用催化剂 D.多充入O2 6.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考图甲、乙所示仪器,判断下表中正确的选项是 7.在恒温、恒容的密闭容器中进行反应2H2O22H2O+O2↑。若H2O2溶液的浓度由2.0 mol·L-1降到1.0 mol·L-1需10s,那么H2O2浓度由1.0 mol·L-1降到0.5 mol·L-1所需的反应时间为 A.5s B.大于5s C.小于5s D.无法判断 8.下列关于化学反应的自发性和进行方向的说法正确的是 A.非自发反应在任何条件下都不能发生 B.-定温度下,反应Mg(l)+Cl2(g)=MgCl2(l)的△H<0,△S<0 C.由△G=△H-T△S可知,所有放热反应都能自发进行 D.只有不需要任何条件就能够自动进行的过程才是自发过程 9.一定条件下:2NO2(g)N2O4(g) △H<0。在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是 A.温度0℃、压强50kPa B.温度130℃、压强300kPa C.温度25℃、压强100kPa D.温度130℃、压强50kPa 10.钯的配合物离子[PdCl4]2-可催化合成H2O2,反应过程如图所示。下列叙述错误的是 A.[PdCl2O2]2-是反应中间体 B.催化合成H2O2总反应为H2+O2H2O2 C.反应过程中Pd的成键数目保持不变 D.存在反应Pd+O2+2Cl-=[PdCl2O2]2- 11.反应H2(g)+I2(g)2HI(g)的平衡常数K1,反应HI(g)H2(g)+I2(g)的平衡常数K2,则K1,K2的关系为(平衡常数为同温度下的测定值) A.K1=2K2 B.K1=K2 C.K1= D.K1=K2 12.在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),2min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是 A.x=2 B.2min内A的反应速率为0.6 mol·L-1·min-1 C.B的转化率为40% D.若混合气体的密度不变,则表明该反应达到平衡状态 13.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是 A.II为盐酸稀释时的pH变化曲线 B.a点的KW比c点的KW大 C.b点酸的浓度大于a点酸的浓度 D.b点溶液的导电性比c点溶液的导电性强 14.25℃时,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,二者恰好完全反应,则该温度下醋酸的电离平衡常数约为 A.1014-a-2b B.10a+b-14 C.10a-2b D.10a-2b+14 15.将固体NH4Br置于2L的密闭容器中,在恒温的条件下发生如下反应:NH4Br(s)NH3(g)+HBr(g),2HBr(g)H2(g)+Br2(g)。2min时测得H2的浓度为1 mol·L-1,HBr的浓度为8 mol·L-1,则上述反应中0~2 min内生成NH3的速率为 A.0.5 mol·L-1·min-1 B.2 mol·L-1·min-1 C.2.5 mol·L-1·min-1 D.5 mol·L-1·min-1 16.现有四种溶液:①pH=2的CH3COOH溶液;②pH=2的盐酸;③pH=12的氨水;④pH= 12的NaOH溶液。常温下,下列有关上述溶液的判断不正确的是 A.由水电离出的c(H+):①=②=③=④ B.若将②、③等体积混合,则所得溶液的pH>7 C.等体积的①、②、④分别与足量铝粉反应,生成H2的量:②最多 D.将溶液稀释100倍后,溶液的pH:③>④>②>① 17.已知反应:A(g)+B(g)C(g)+D(g),在一定压强下,按X=(A的物质的量始终为l mol)向密闭容器中充入A气体与B气体。图甲表示平衡时,A气体的体积分数(V%)与温度(T)、X的关系。图乙表示X=2时,正逆反应的平衡常数与温度的关系。则下列说法正确的是 A.图甲中,X2<1 B.图乙中,A线表示正反应的平衡常数 C.由图乙可知,T1时,K=1,B的转化率约为33.3% D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将减小 二、非选择题(本题包含5个小题,共49分) 18.(9分)磷的含氧酸及其盐是一类重要的化工产品,广泛用于食品、肥料、去油去污、防腐蚀、防锈、锅炉水处理等。请回答下列问题: (1)次磷酸(H3PO2)是一种精细化工产品。向10 mL 0.02 mol·L-1 H3PO2溶液中加入20 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-两种阴离子,则H3PO2是 (填“一元酸”、“二元酸”或“三元酸”)。 (2)已知25℃时K(H3PO2)=1×10-2,该H3PO2溶液的pH为 。 (3)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数K1=5.0×10-2、K2=2.6×10-3。 ①电离常数K只与温度有关,当温度升高时,K值 (填“增大”或“减小”)。 ②试从电离平衡移动的角度解释K1、K2数据的差异: 。 (4)25℃时,已知HF的电离常数K=3.6×10-4;H3PO4的电离常数K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。则足量NaF溶液和H3PO4溶液反应的离子方程式为 。 19.(11分)某小组利用H2C2O4溶液和酸性KMnO4 溶液反应来探究“条件对化学反应速率的影响”。 (1)该实验过程中发生反应的离子方程式为 。 (2)向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,溶液紫色将褪去。为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) 。 (3)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案: 表中x= mL,理由是 。 (4)已知50℃时,浓度c(H2C2O4)随反应时间t的变化曲线如下图示,若保持其他条件不变,请在坐标图中画出25℃时c(H2C2O4)随t的变化曲线示意图。 20.(10分)已知某烧碱样品中含有NaCl杂质,为测定该样品中NaOH的质量分数,进行如下实验: ①称量1.00 g样品溶于水,配成250 mL溶液; ②用碱式滴定管准确量取25.00 mL所配溶液于锥形瓶中,滴加2~3滴 作为指示剂; ③用0.1000 mol·L-1的标准盐酸滴定并重复三次,每次实验数据记录如下: 请回答下列问题: (1)配制该溶液所需要的主要玻璃仪器为烧杯、玻璃棒 。 (2)实验步骤②中,横线上填的指示剂是 。 (3)判断达到滴定终点时的现象为 。 (4)若出现下列情况,导致测定结果偏高的是 (填序号)。 a.滴定前用蒸馏水冲洗锥形瓶 b.滴定过程中振荡锥形瓶时不慎使瓶内溶液溅出 c.滴定过程中不慎将数滴酸液滴在锥形瓶外 d.酸式滴定管中在滴定前有气泡,滴定后气泡消失 e.滴定前仰视读数,滴定后俯视读数 f.酸式滴定管在使用前没有用标准液润洗 (5)通过计算可知该烧碱样品的纯度为 。 21.(11分)研究硫元素及其化合物的性质具有重要意义。 I.已知I-可以催化二氧化硫在水溶液中发生歧化反应: 3SO2(g)+2H2O(l)=2H2SO4(aq)+S(s) △H<0。催化原理分为两步,第一步反应为吸热的慢反应:SO2+4I-+4H+=2H2O+S↓+2I2,第二步反应为放热的快反应:2H2O+I2+ = + +2I-。 (1)请补充第二步反应。 (2)能正确表示I-催化SO2歧化反应原理的能量变化示意图为 。 II.工业制硫酸,在接触室发生反应2SO2(g)+O2(g)2SO3(g)。在1 L的恒容密闭容器中充入2 mol SO2和1 mol O2,在不同温度下测得c(SO3)与时间的关系如下图所示: (3)能证明反应已经达到平衡状态的是 。 ①c(SO2):c(O2):c(SO3)=2:1:2 ②单位时间内生成n mol SO3的同时消耗n mol SO2 ③反应速率2v(SO3)正=v(O2)逆 ④温度和体积一定时,容器内压强不再变化 ⑤温度和压强一定时,混合气体的密度不再变化 (4)反应开始到10 min时SO2的平均反应速率v(SO2)= mol/(L·min)。T2时反应SO3(g)SO2(g)+O2(g)的平衡常数K= 。 22.(8分)乙烯(C2H4)是重要的化工原料,乙炔(C2H2)选择性加氢合成乙烯是科学家当前关注的热点。 (1)70℃时,反应C2H2(g)+H2(g)C2H4(g) △H=-174 kJ·mol-1在刚性容器中达到平衡。 ①下列说法正确的是 (填标号)。 A.选用合适的催化剂,可以增大平衡气体中C2H4的百分含量 B.投料时增大的值,该反应的平衡常数K不变 C.通入一定量He,可以缩短反应达到平衡的时间 D.升高温度,正反应速率和逆反应速率都增大,K减小 ②测得在某催化剂上生成乙烯的速率方程为v=0.585[p(C2H2)]-0.36·[p(H2)]0.85。p(H2)一定时,若p1(C2H2)>p2(C2H2),则v1 v2(填“>”、“<”或“=”)。 (2)在催化剂作用下,110℃时按体积比V(C2H2):V(H2)=1:4充入刚性容器中,发生反应C2H2+H2=C2H4、C2H2+2H2=C2H6。若乙炔完全反应时,乙烯的体积分数为20%,则H2的转化率为 ,C2H4的选择性为 (C2H4的选择性=×100%)。查看更多