- 2021-05-10 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学鲁科版一轮复习突破精练:第3章 第8讲 钠及其重要化合物
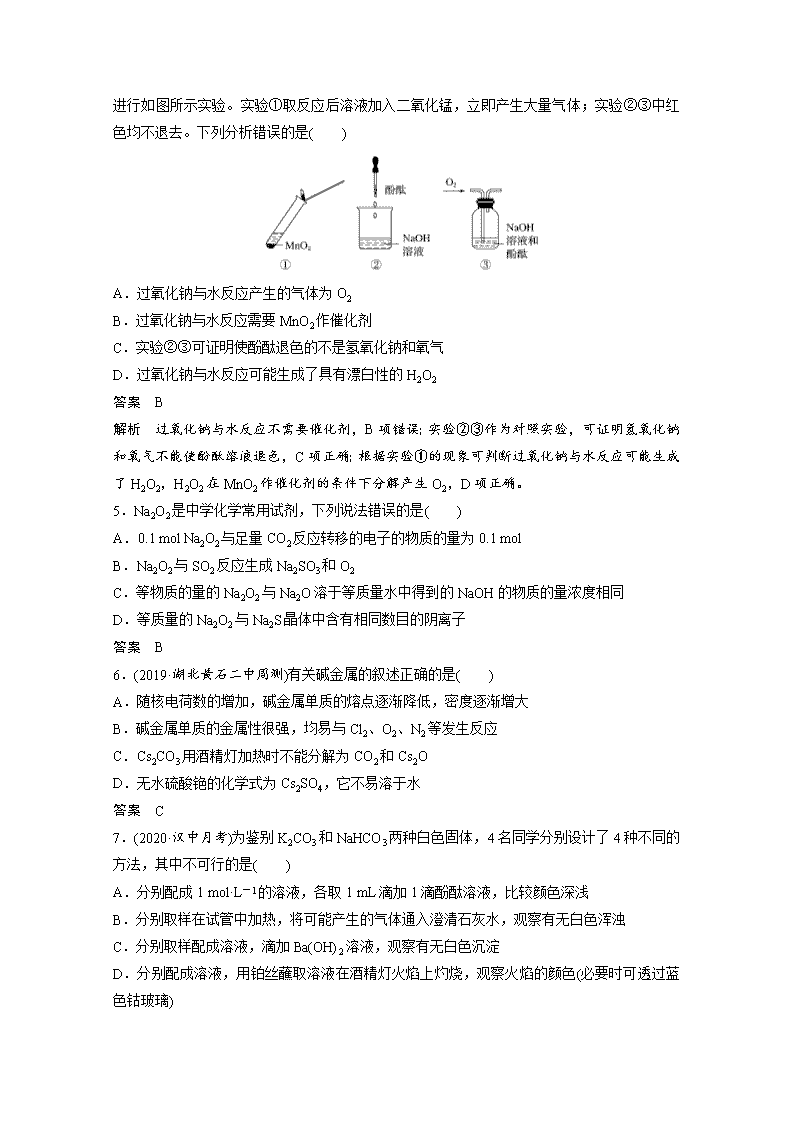
www.ks5u.com 一、选择题:每小题只有一个选项符合题意。 1.(2020·榆林月考)下列关于钠的说法正确的是( ) A.实验后剩余的钠粒不能放回原试剂瓶中 B.钠着火后,可用泡沫灭火器灭火 C.钠的化学性质比较活泼,少量的钠可以保存在煤油中 D.钠与硫酸铜溶液反应时,有大量红色固体铜出现 答案 C 解析 实验剩余的钠应放回原试剂瓶,A项错误;钠燃烧后的产物过氧化钠能与二氧化碳反应产生氧气,使燃烧加剧,B项错误;钠的密度比煤油的大,且与煤油不反应,故保存在煤油中可以隔绝空气和水,C项正确;钠和CuSO4溶液反应时,先和水反应生成NaOH,生成的氢氧化钠再和CuSO4反应生成Cu(OH)2,即不能置换出金属铜,D项错误。 2.观察是研究物质性质的一种基本方法。某同学将一小块金属钠露置于空气中,观察到下列现象:银白色变灰暗变白色出现液滴白色固体,则下列说法正确的是( ) A.①发生氧化还原反应生成了过氧化钠 B.④只发生物理变化 C.③是碳酸钠吸收空气中的水蒸气形成了溶液 D.②④主要是非氧化还原反应 答案 D 解析 ①钠被氧化为Na2O,②Na2O+H2O===2NaOH,③是NaOH的潮解,④2NaOH+CO2===Na2CO3+H2O。 3.(2019·贵阳质检)下列关于金属钠单质及其化合物的说法中,不正确的是( ) A.NaCl可用作食品调味剂 B.相同温度下NaHCO3的溶解度大于Na2CO3 C.Na2CO3的焰色反应呈黄色 D.工业上Na可用于制备钛、锆等金属 答案 B 解析 A项,氯化钠有咸味,可用作食品调味剂;B项,碳酸氢钠的溶解度小于碳酸钠的溶解度;C项,钠元素的焰色反应为黄色;D项,钠的活动性比较强,可以从熔融盐中置换出钛、锆等金属。 4.(2020·淮北调研)过氧化钠与水反应后滴加酚酞,酚酞先变红后退色。某小组欲探究其原因, 进行如图所示实验。实验①取反应后溶液加入二氧化锰,立即产生大量气体;实验②③中红色均不退去。下列分析错误的是( ) A.过氧化钠与水反应产生的气体为O2 B.过氧化钠与水反应需要MnO2作催化剂 C.实验②③可证明使酚酞退色的不是氢氧化钠和氧气 D.过氧化钠与水反应可能生成了具有漂白性的H2O2 答案 B 解析 过氧化钠与水反应不需要催化剂,B项错误;实验②③作为对照实验,可证明氢氧化钠和氧气不能使酚酞溶液退色,C项正确;根据实验①的现象可判断过氧化钠与水反应可能生成了H2O2,H2O2在MnO2作催化剂的条件下分解产生O2,D项正确。 5.Na2O2是中学化学常用试剂,下列说法错误的是( ) A.0.1 mol Na2O2与足量CO2反应转移的电子的物质的量为0.1 mol B.Na2O2与SO2反应生成Na2SO3和O2 C.等物质的量的Na2O2与Na2O溶于等质量水中得到的NaOH的物质的量浓度相同 D.等质量的Na2O2与Na2S晶体中含有相同数目的阴离子 答案 B 6.(2019·湖北黄石二中周测)有关碱金属的叙述正确的是( ) A.随核电荷数的增加,碱金属单质的熔点逐渐降低,密度逐渐增大 B.碱金属单质的金属性很强,均易与Cl2、O2、N2等发生反应 C.Cs2CO3用酒精灯加热时不能分解为CO2和Cs2O D.无水硫酸铯的化学式为Cs2SO4,它不易溶于水 答案 C 7.(2020·汉中月考)为鉴别K2CO3和NaHCO3两种白色固体,4名同学分别设计了4种不同的方法,其中不可行的是( ) A.分别配成1 mol·L-1的溶液,各取1 mL滴加1滴酚酞溶液,比较颜色深浅 B.分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 C.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 D.分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃) 答案 C 解析 K2CO3的水解程度比NaHCO3的大,溶液碱性较强,滴加酚酞检验,碳酸钾溶液的颜色更深,A项正确;NaHCO3不稳定,受热易分解,生成二氧化碳气体,可通入澄清石灰水,观察有无白色浑浊,B项正确;K2CO3和NaHCO3均与氢氧化钡反应生成碳酸钡白色沉淀,C项错误;二者分别含有K元素、Na元素,焰色反应现象不同,D项正确。 8.(2020·开封模拟)下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( ) 选项 陈述Ⅰ 陈述Ⅱ 判断 A 碳酸钠溶液可用于治疗胃病 Na2CO3可与盐酸反应 Ⅰ对,Ⅱ对,有 B 向Na2O2与H2O反应后的溶液中滴入酚酞,溶液变红色 Na2O2与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无 C 金属钠应保存在煤油中隔绝空气 常温下,金属钠在空气中会生成过氧化钠 Ⅰ对,Ⅱ对,有 D 过氧化钠可用作航天员的供氧剂 Na2O2能和CO2、H2O反应生成O2 Ⅰ对,Ⅱ对,有 答案 D 解析 治疗胃酸过多要用NaHCO3而不用Na2CO3,碳酸钠的碱性较强,不能用来中和胃酸,A项错误;Na2O2与水反应生成氢氧化钠,滴入酚酞,溶液先变红后退色,陈述Ⅰ错误,且陈述Ⅰ、Ⅱ存在因果关系,B项错误;常温下,金属钠在空气中生成的是氧化钠,陈述Ⅱ错误,C项错误;Na2O2和CO2、H2O反应均生成O2,可用作航天员的供氧剂,陈述Ⅰ、Ⅱ均正确,且存在因果关系,D项正确。 二、选择题:每小题有一个或两个选项符合题意。 9.下列有关Na2CO3和NaHCO3的叙述中正确的是( ) A.向Na2CO3溶液中通入等物质的量的HCl,生成的CO2与原Na2CO3的物质的量之比为1∶2 B.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,消耗同浓度盐酸的体积,后者大于前者 C.物质的量浓度相同时,Na2CO3溶液的pH小于NaHCO3溶液 D.向Na2CO3饱和溶液中通入CO2,有NaHCO3晶体析出 答案 BD 解析 根据化学方程式Na2CO3+HCl===NaCl+NaHCO3,当碳酸钠和HCl物质的量相等时,不会产生二氧化碳,A项错误;在Na2CO3溶液、NaHCO3溶液中,碳酸根离子和碳酸氢根离子均能水解,导致溶液呈碱性,但是碳酸根离子水解程度大,所以碳酸钠的碱性强于碳酸氢 钠,即Na2CO3溶液的pH大于NaHCO3溶液,C项错误;向Na2CO3饱和溶液中通入CO2,会发生反应Na2CO3+CO2+H2O===2NaHCO3↓,常温下在相同的溶剂中,Na2CO3比NaHCO3易溶,所以会析出碳酸氢钠晶体,D项正确。 10.(2019·安徽淮南十校联考)工业上以粗盐(含Ca2+、Mg2+、SO等杂质)为主要原料,采用“侯氏制碱法”生产纯碱和化肥NH4Cl,实验室模拟工艺流程如图甲所示。下列说法正确的是( ) A.饱和食盐水中先通入的气体为CO2 B.流程图中的“系列操作”中一定需要使用玻璃棒 C.如图乙所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性 D.对粗盐溶液除杂可依次加入过量NaOH、Na2CO3、BaCl2溶液,过滤后再加入盐酸调节溶液的pH 答案 B 解析 A项,二氧化碳在水中溶解度较小,氨气溶解度较大,故应先通入氨气,使溶液为碱性溶液,再通入二氧化碳,可以达到实验目的,错误;B项,从溶液中得到固体,需要加热浓缩、冷却结晶、过滤等操作,因此流程图中的“系列操作”中一定需要玻璃棒搅拌、引流等,正确;C项,Na2CO3加热不易分解,NaHCO3晶体加热容易分解,故小试管中盛放NaHCO3,大试管中盛放Na2CO3,错误;D项,除去粗盐中的Ca2+、Mg2+、SO及泥沙,可以依次加过量BaCl2除去SO,然后加NaOH除去Mg2+,用Na2CO3除去Ca2+和过量的Ba2+,盐酸要在最后加入,除去过量的NaOH和Na2CO3,错误。 11.向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体,再在所得溶液中逐滴加稀盐酸至过量,并将溶液加热,产生的CO2气体与加入HCl的物质的量的关系如图所示(忽略CO2的溶解和HCl的挥发): 则下列分析正确的是( ) A.Ⅰ图对应溶液中的溶质为NaHCO3 B.Ⅱ图对应溶液中的溶质为Na2CO3和NaHCO3,且两者的物质的量之比为1∶1 C.Ⅲ图对应溶液中的溶质为NaOH和Na2CO3,且两者的物质的量之比为1∶1 D.Ⅳ图对应溶液中的溶质为Na2CO3 答案 AB 解析 图像Ⅰ中从O点即开始产生CO2气体,对应溶液中的溶质为NaHCO3,A正确;图像Ⅱ中Oa段消耗HCl的量小于ab段消耗HCl的量,对应的溶液中的溶质为Na2CO3和NaHCO3,且两者的物质的量之比为=,B正确;图像Ⅲ中,Oa段消耗HCl的量等于ab段消耗HCl的量,对应溶液中的溶质为Na2CO3,C错误;图像Ⅳ中,Oa段消耗HCl的量大于ab段消耗HCl的量,对应溶液中的溶质为Na2CO3和NaOH,D错误。 12.过碳酸钠(2Na2CO3·3H2O2),有Na2CO3和H2O2的双重性质,可用作漂白剂和氧化剂,能有效杀灭禽流感病毒。合理组合下列装置能用于测定过碳酸钠中碳酸钠的含量,下列说法不正确的是( ) A.连接顺序为装置Ⅲ→Ⅰ→Ⅱ B.装置b和e中盛放的试剂相同 C.装置d的作用是防止空气中的H2O和CO2进入c中 D.若b中盛放的是澄清石灰水,只用装置Ⅰ即可验证过碳酸钠与硫酸反应是否生成CO2(不考虑空气中CO2的影响) 答案 B 解析 稀硫酸与过碳酸钠反应生成CO2,由于空气中含有CO2,所以需要除去空气中的CO2,又因为还需要防止空气中的水蒸气进入c,所以连接顺序是装置Ⅲ→Ⅰ→Ⅱ,A项正确;装置b和e中盛放的试剂分别是浓硫酸和氢氧化钠溶液,B项错误;装置d的作用是防止空气中的H2O和CO2进入c中,C项正确;氢氧化钙与CO2反应生成碳酸钙沉淀,因此若b中盛放的是澄清石灰水,只用装置Ⅰ即可验证过碳酸钠与硫酸反应是否生成CO2,D项正确。 三、非选择题 13.(2020·商丘联考)某班级化学兴趣小组做如下实验,请回答相关问题: (1)甲组做金属钠在空气中燃烧的实验。实验室取用金属钠的方法是_______________ ________________________________________________________________________。 (2)金属钠燃烧时会生成黑色固体,黑色固体的可能来源是________________、________________。 (3)某同学想用金属钠和空气制备纯度较高的Na2O2(不考虑空气中的N2),可利用的装置如下。 回答下列问题: ①装置Ⅳ中盛放的药品是________,若没有该装置可能导致生成的Na2O2中含有________,其反应的化学方程式为_________________________________________________________。 ②若规定气流的方向为从左到右,各仪器连接的顺序是:空气进入________,________接________,________接________,________接________(填字母)。 ③装置Ⅱ的作用是__________________________________________________________。 答案 (1)打开盛放金属钠的试剂瓶,用镊子取出,放在滤纸上吸干表面的煤油,再用小刀切下所需大小的钠块,余下的放回原试剂瓶,盖好即可 (2)来自表面的煤油 来自空气中的二氧化碳 来自酒精灯挥发的酒精 金属钠存在杂质铁元素,燃烧时生成铁的氧化物(答任意两点即可) (3)①氢氧化钠溶液 Na2CO3 2Na2O2+2CO2===2Na2CO3+O2 ②h g f e a b c ③防止空气中的水和二氧化碳进入装置Ⅰ 解析 (3)要制备高纯度的Na2O2,需要除去空气中的CO2和水蒸气。装置Ⅲ的作用是除去水蒸气,装置Ⅳ的作用是用NaOH溶液除去CO2,如果不除去CO2,则CO2会与Na2O2反应生成Na2CO3;装置Ⅱ连接在硬质玻璃管末端,作用是防止空气中的水蒸气和CO2进入装置Ⅰ,所以连接顺序为空气→h→g→f→e→a→b→c。 14.(2018·河南周口模拟)四个化学小组的同学测定某Na2CO3固体样品(仅含NaCl杂质)的纯度,他们提出了各自的气体分析法。 (1)第一小组用图1所示装置,仪器A的名称为________________,将m1 g混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时需检查该装置气密性,具体的操作方法是________________________________________________________________________ _____________________________________________________________________________。 (2)第二小组用图2所示装置测定CO2的质量。该装置存在的明显缺陷是______________________________________________________________________________ _______________________________________________________________________(填一处)。 (3)第三小组在第二小组装置的基础上,解决了第二小组装置的问题。所用到的装置如图3所示,则装置的连接顺序为a→_________________________________________________ (填接口字母,图中仪器可重复使用)。实验中取样品m1 g,称得干燥管的质量为m2 g,样品与足量稀硫酸反应后称得干燥管的质量为m3 g,则Na2CO3的纯度表达式为________________________________________________________________________。 (4)第四小组设计用沉淀法来测定。方法是滴加沉淀剂使碳酸钠转化为沉淀,然后过滤、洗涤、干燥后称量沉淀质量。经讨论认为应用Ba(OH)2溶液代替澄清石灰水作沉淀剂,其原因是________(填字母)。 a.Ba(OH)2比Ca(OH)2便宜 b.Ba(OH)2的溶解度大于Ca(OH)2的,可以增大Ba(OH)2的浓度,无须加入过大体积的沉淀剂 c.相同条件下,CaCO3的溶解度明显小于BaCO3 d.吸收等量的CO2生成BaCO3的质量大于CaCO3,测量误差小 答案 (1)分液漏斗 关闭仪器A的活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明该装置的气密性良好 (2)CO2气体中混有水蒸气(或空气中的CO2和水蒸气会进入干燥管中或装置中的CO2没有全部被碱石灰吸收) (3)fgcbdecb(或fgcbdede) ×100% (4)bd 解析 (3)样品m1 g,称得干燥管质量为m2 g,与足量稀硫酸反应后称得干燥管质量为m3 g,干燥管增加的质量等于生成的CO2的质量=(m3-m2) g,依据碳元素守恒计算,碳酸钠的纯度为×100%=×100%。 (4)Ca(OH)2比Ba(OH)2便宜,a项错误;相同条件下,CaCO3、BaCO3的溶解度相差不大,c项错误。查看更多