2019届一轮复习苏教版专题5第3单元微粒之间的相互作用与物质的多样性学案
第三单元 微粒之间的相互作用与物质的多样性
考纲定位
全国卷5年考情
1.了解化学键的定义。
2.了解离子键、共价键的形成和存在的物质。
3.掌握分子式、电子式、结构式及结构简式等表示方法。
2017年:Ⅰ卷T27(4);Ⅲ卷T10(D)、T26(1)
2016年:Ⅰ卷T13;卷ⅡT9;Ⅲ卷T12
2015年:Ⅰ卷T12、T27(5);Ⅱ卷T10(A)、T9
考点1| 微粒之间的相互作用力
(对应学生用书第98页)
[考纲知识整合]
1.化学键——离子键和共价键
(1)概念与分类
(2)化学反应的本质:反应物的旧化学键断裂与生成物的新化学键形成。
(3)离子键与共价键比较
项目
离子键
共价键
成键粒子
阴、阳离子
原子
成键方式
得失电子形成阴、阳离子
形成共用电子对
成键条件
活泼金属元素与活泼非金属元素
一般在非金属原子之间
作用力实质
静电作用
提醒:(1)离子键中的“静电作用”
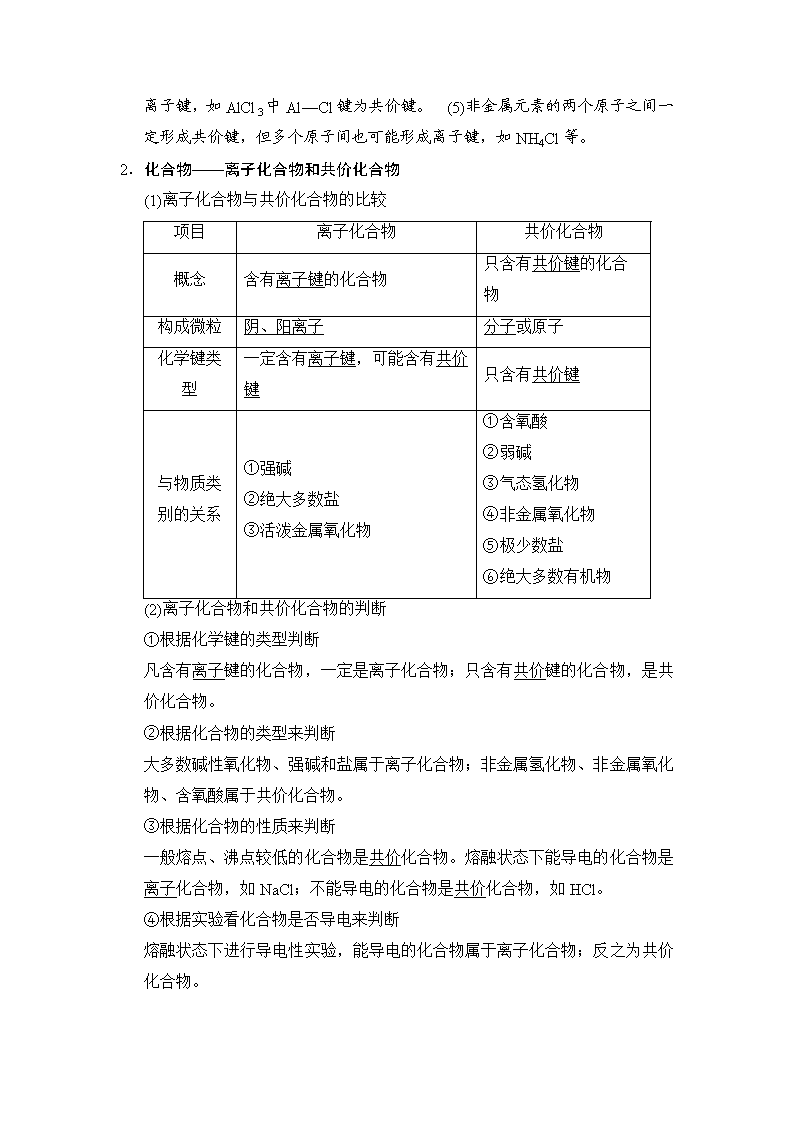
既包括静电吸引力又包括静电排斥力。 (2)分子间作用力、氢键不属于化学键。 (3)物质中并不一定都存在化学键,如He等稀有气体分子。 (4)由活泼金属与活泼非金属形成的化学键不一定都是离子键,如AlCl3中Al—Cl键为共价键。 (5)非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键,如NH4Cl等。
2.化合物——离子化合物和共价化合物
(1)离子化合物与共价化合物的比较
项目
离子化合物
共价化合物
概念
含有离子键的化合物
只含有共价键的化合物
构成微粒
阴、阳离子
分子或原子
化学键类型
一定含有离子键,可能含有共价键
只含有共价键
与物质类
别的关系
①强碱
②绝大多数盐
③活泼金属氧化物
①含氧酸
②弱碱
③气态氢化物
④非金属氧化物
⑤极少数盐
⑥绝大多数有机物
(2)离子化合物和共价化合物的判断
①根据化学键的类型判断
凡含有离子键的化合物,一定是离子化合物;只含有共价键的化合物,是共价化合物。
②根据化合物的类型来判断
大多数碱性氧化物、强碱和盐属于离子化合物;非金属氢化物、非金属氧化物、含氧酸属于共价化合物。
③根据化合物的性质来判断
一般熔点、沸点较低的化合物是共价化合物。熔融状态下能导电的化合物是离子化合物,如NaCl;不能导电的化合物是共价化合物,如HCl。
④根据实验看化合物是否导电来判断
熔融状态下进行导电性实验,能导电的化合物属于离子化合物;反之为共价化合物。
3.化学键与化合物的关系
提醒:(1)离子化合物中一定含离子键,可能含非极性键和极性键; (2)共价化合物一定含极性键,可能含非极性键,一定不含离子键; (3)除稀有气体中没有化学键外,其他物质都存在化学键。
4.化学键对物质性质的影响
(1)对物理性质的影响
①金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是因为其中的共价键很强,破坏时需消耗很多的能量。
②NaCl等部分离子化合物,也有很强的离子键,故熔点也较高。
(2)对化学性质的影响
①N2分子中有很强的共价键,故在通常状况下,N2性质很稳定。
②H2S、HI等分子中的共价键较弱,故它们受热时易分解。
5.物质熔化、溶解时化学键的变化
(1)离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,离子键被破坏。
(2)共价化合物的溶解过程
①有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏,如CO2和SO2等。
②有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴、阳离子,其分子内的共价键被破坏,如HCl、H2SO4等。
③某些共价化合物溶于水后,其分子内的共价键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH)等。
(3)单质的溶解过程
某些活泼的非金属单质溶于水后,能与水反应,其分子内的共价键被破坏,如Cl2、F2等。
6.分子间作用力
(1)定义:把分子聚集在一起的作用力,又称范德华力。
(2)特点
①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力存在于由共价键形成的多数共价化合物和绝大多数气态、液态、固态非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质、微粒之间不存在分子间作用力。
(3)变化规律
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。例如,熔、沸点:I2>Br2>Cl2>F2。
(4)特例:分子间存在氢键的物质(如H2O、HF、NH3)在同族氢化物中熔、沸点反常的高,如H2O>H2S,HF>HCl。
[高考命题点突破]
命题点1 化学键与化合物类型的判断
1.(2018·滨州模拟)X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形成的常见化合物或者离子不可能是( )
A.只含极性键的共价化合物
B.含非极性键的共价化合物
C.阴阳离子个数之比为1∶1的离子化合物
D.含非极性键的离子化合物
C [由题意可知,X可能为H、Li、Na,Y可能为O、S,故X、Y形成的化合物有H2O、H2O2、H2S、Na2O2、Na2O、Na2S等。]
2.(2018·连云港模拟)已知X、Y、Z三种元素的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
A.Y和Z可以组成一种Y和Z的质量比为7∶8的共价化合物
B.X、Y、Z能组成既含离子键又含共价键的离子化合物
C.X和Z可以组成原子个数比分别为1∶1和2∶1,常温下为液态的两种
化合物
D.由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒仅有2种
D [由X原子的电子层数与它的核外电子总数相等知,X为氢元素;Z原子的最外层电子数是次外层的3倍,故Z为氧元素;与氧元素形成两种以上气态化合物的Y为氮元素。]
3.现有以下物质: 【导学号:91720194】
①NaCl ②Na2O ③Na2O2 ④NaOH ⑤H2SO4
⑥H2O ⑦N2 ⑧(NH4)2CO3 ⑨CO2 ⑩H2O2
⑪Ne ⑫C2H4
(1)只含离子键的物质有________,只含共价键的物质有________,不含化学键的有________。
(2)属于离子化合物的有________;其中含有非极性键的是________,其中含有极性键的是________。
(3)属于共价化合物的有________;其中含有非极性键的是________。
【答案】 (1)①② ⑤⑥⑦⑨⑩⑫ ⑪
(2)①②③④⑧ ③ ④⑧
(3)⑤⑥⑨⑩⑫ ⑩⑫
(1)只含有极性共价键的物质一般是不同种非金属元素形成的共价化合物,如SiO2、HCl、CH4等。
(2)只含有非极性共价键的物质是同种非金属元素形成的单质,如Cl2、P4、金刚石等。
(3)既有极性键又有非极性键的共价化合物一般由多个原子组成,如H2O2、C2H4等。
(4)只含离子键的物质主要是由活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CaCl2、NaCl等。
(5)既有离子键又有极性共价键的物质,如NaOH、K2SO4等;既有离子键又有非极性共价键的物质,如Na2O2等。
(6)仅由非金属元素形成的离子化合物,如NH4Cl、NH4NO3等。
(7)金属元素和非金属元素间可能存在共价键,如AlCl3等。
命题点2 物质变化与化学键变化的关系
4.下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.2Na2O2+2H2O===4NaOH+O2↑
B.Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
C.Cl2+H2O===HClO+HCl
D.NH4Cl+NaOH===NaCl+NH3↑+H2O
A [A项,反应中有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成,正确;B项,该反应中没有非极性键的断裂和形成,错误;C项,该反应中没有离子键的断裂和形成,也没有非极性键的形成,错误;D项,该反应中没有非极性键的断裂和形成,错误。]
5.在下列变化过程中,属于“破坏极性键和非极性键,形成极性键和非极性键”过程的是( )
A.冰→水→水蒸气→H2和O2
B.2Na+Cl2===2NaCl
C.2H2+O22H2O
D.2H2O2===2H2O+O2↑
D [A项,冰转化为水,水转化为水蒸气是物理变化,水蒸气分解形成H2和O2,破坏极性键,形成非极性键,错误;B项,钠是金属,与氯气反应生成氯化钠形成离子键,错误;C项,氢气与氧气反应生成水,破坏非极性键,形成极性键,错误;D项,双氧水分解形成水和氧气,破坏极性键和非极性键,形成极性键和非极性键,正确。]
6.下列熔、沸点大小比较正确的是________(填序号)。
①Cl2>H2 ②N2>O2 ③金刚石>钠 ④二氧化硅>二氧化碳 ⑤金刚石
H2Se ⑦I2>Br2
⑧HCl>HBr ⑨NH3>PH3 ⑩HF<HCl ⑪H2O<SO2 ⑫正丁烷>异丁烷
【答案】 ①③④⑥⑦⑨⑫
考点2| 电子式与结构式
(对应学生用书第100页)
[考纲知识整合]
1.电子式的书写方法
在元素符号周围用“·”或“×”来代表原子的最外层电子的式子。具体方法为:
2.用电子式表示化合物的形成过程
(1)离子化合物:左边是原子的电子式,右边是离子化合物的电子式,中间用“―→”连接,相同的原子或离子不合并。
如NaCl:。
(2)共价化合物:左边是原子的电子式,右边是共价化合物的电子式,中间用“―→”连接。
如HCl:
3.结构式:对于共价分子,将共用电子对改为短线,未成键电子省略。如∶N⋮⋮N∶―→N≡N。
[高考命题点突破]
命题点1 电子式
1.书写下列粒子或物质的电子式:
(1)Mg________,S________。
(2)Na+________,Cl-________,NH________,H3O+________,OH-________,—OH________,—CHO________,—NH2________。
(3)Cl2________,H2________,N2________,O2________。
(4)MgF2________,Na2S________,Na2O2________,NaOH________,NH4Cl________,NaH________。
(5)H2O________,NH3________,CO2________,CCl4________,H2O2________,C2H4________,HClO______,C2H5OH________。
(6)(2015·全国Ⅰ卷)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为________。
(7)(2016·全国Ⅱ卷)联氨分子(N2H4)的电子式为________,其中氮的化合价为________。
【答案】 (1)
2.用电子式表示下列物质的形成过程:
(1)MgBr2:______________________________________________________。
(2)H2O:________________________________________________________。
(3)H2:_________________________________________________________。
(4)Na3N:______________________________________________________。
(1)同一原子的电子式最好不要既用“·”又用“”表示;在化合物中“·”或“”最好也不要混用(若特殊需要可标记),可将电子全部标成“·”或“”。
(2)单一原子形成的简单阳离子,其离子符号就是该阳离子的电子式,如Al3+就可以表示铝离子的电子式。“[ ]”在所有的阴离子、复杂的阳离子中出现。
(3)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是相隔的,即不能将两个阴离子或两个阳离子写在一起。如:CaF2要写成[]-Ca2+[]-,不能写成Ca2+[],也不能写成Ca2+[]-[]-。
(4)不要漏写未成键的电子,如N2:N⋮⋮N是错误的。
(5)不要弄错原子间的连接,如HClO分子中H与O相连。
(6)在用电子式表示物质形成的过程时,由于不是化学方程式,所以不能出现“===”。“―→”前是原子的电子式,“―→”后是物质的电子式。
命题点2 共价分子的结构式及简式和空间构型
3.(1)H2O、CH4、NH3、H2O2、N2H4的结构式分别为
________________、________________、________________、________________、________________。
(2)乙酸的结构式为__________________,结构简式为_______________。
(3)乙烯、乙醇的结构简式分别为__________________、______________。
(4)苯、硝基苯的结构简式分别为________________ 、________________。
(5)葡萄糖的分子式为____________,结构简式为____________。
(6)CO2、H2O、CH4、NH3的空间构型分别为__________、______________、______________、______________。
【答案】 (1)H—O—H H—O—O—H
(2) CH3COOH (3)CH2===CH2 C2H5OH (4) (5)C6H12O6 CH2OH(CHOH)4CHO (6)直线形 V形 正四面体型 三角锥型
命题点3 “8e-”结构的判断
4.下列粒子中所有原子的最外层都达到8电子稳定结构的是________(填序号)。
①BF3 ②NCl3 ③H3O+ ④SiCl4 ⑤PCl3 ⑥PCl5 ⑦NO2 ⑧XeF4 ⑨SO2 ⑩HClO ⑪N2 ⑫N2H4 ⑬CO2
【答案】 ②④⑤⑪⑬
(1)最外层电子数+|化合价|=8的原子均达到8e-稳定结构。
(2)含氢化合物中的氢原子一定不是8e-稳定结构。
考点3| 物质的多样性——同素异形体与晶体类型
(对应学生用书第101页)
[考纲知识整合]
1.同素异形现象
(1)同素异形现象指同一种元素能够形成几种不同单质的现象,这些单质互称为该元素的同素异形体。
(2)碳元素的同素异形体
①金刚石:晶体中每个碳原子与相邻的4个碳原子以共价键结合,形成空间网状结构。
②石墨:晶体为层状结构,层内碳原子间以共价键结合,层内形成平面六边形排列的平面网状结构,层间碳原子间存在分子间作用力。
③C60:分子是由60个碳原子形成的封闭笼状结构分子,人们称为“足球烯”。
(3)氧元素的两种同素异形体
①O2转化为O3的方程式为3O22O3。
②O3在通常状况下是淡蓝色气体,有鱼腥味,氧化性极强,可用于杀菌和漂白。
③臭氧层破坏原因一般认为是氟氯烃的大量使用。
2.不同类型的晶体
(1)晶体:具有规则的几何外形,是其内部构成微粒有规则排列的结果。
(2)构成晶体的微粒可以是分子、离子、原子。
(3)分类:晶体分为分子晶体、原子晶体、离子晶体和金属晶体。
(4)四种晶体类型的比较
晶体
类型
离子晶体
原子晶体
分子晶体
金属晶体
晶体构
成微粒
阴、阳离子
原子
分子
金属阳离子、自由电子
熔沸点
较高
很高
很低
一般较高,少部分低
硬度
较硬
很硬
一般很软
一般较硬,少部分软
溶解性
易溶于极
性溶剂
难溶解
相似相溶
难溶(Na等与水反应)
导电
情况
晶体不导电;能溶于水的其水溶液导电;熔化导电
有的
能导
电
晶体不导电,溶于水后能电离的,其水溶液可导电;熔化不导电
晶体导电;熔化导电
[高考命题点突破]
命题点1 同素异形体的判断
1.据有关媒体报道,最近意大利一所大学的科学家使用普通的氧分子和带正电的氧离子制造出了一种新型氧分子,并用质谱仪探测到了它的存在,这种新型氧分子是由4个氧原子构成的。下列有关这种新型氧分子的叙述正确的是
( )
A.在相同条件下,该气体的密度与O3相同
B.等质量时所含的氧原子数比O3的多
C.是除O2、O3外的又一种氧的同素异形体
D.该分子转化为O3或O2的变化为物理变化
【答案】 C
2.(2018·贵阳模拟)随着科学技术的发展,科学家在宇宙深处发现了H3分子,同时在其他领域合成了如N5、O4、C60等新物质。关于上述物质的有关说法中,正确的是( )
A.O2与O4属于同位素
B.C60的摩尔质量为720
C.H2与H3属于同素异形体
D.多数时候N5带有正电荷,以N的形式存在,N离子中含有36个电子
C [A项,O2、O4属同素异形体,错误;B项,摩尔质量有单位,错误;D项,该微粒为N5失去电子形成的阳离子,所以含电子数为34,错误。]
在区别同位素、同素异形体的概念时,可从概念的字面加深理解。同位素的研究对象是原子,“同位”是指同一种元素的几种核素在元素周期表中的位置相同,即质子数相同,中子数不同;同素异形体的研究对象为单质,“同素”是指元素种类相同。
命题点2 不同晶体的判断与性质比较
3.共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体:①Na2O2 ②SiO2 ③NH4Cl ④金刚石 ⑤NaCl ⑥白磷中,含有两种作用力的是
( )
A.①②③ B.①③⑥
C.②④⑥ D.①②③⑥
B [过氧化钠中含Na+和过氧根之间形成的离子键,而过氧根内部是共价键;SiO2中只含有极性共价键;NH4Cl中铵根和Cl-间形成的是离子键,NH内部是共价键;金刚石中只含有非极性共价键;NaCl中只含有离子键;白磷为P4分子,P原子间存在非极性共价键,分子间存在范德华力。含有两种作用力的有三种:Na2O2、NH4Cl和白磷。]
4.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是 ( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
C [离子晶体中含有离子键,离子键在熔融状态下能够被破坏,电离出自由移动的阴、阳离子,所以离子晶体在熔融状态下能够导电,这是判断某晶体是否为离子晶体的实验依据。]
5.下列各组晶体类型相同的是( )
A.NaCl和NaOH
B.金刚石与干冰(CO2)
C.金属钠与晶体I2
D.SiO2与干冰(CO2)
[答案] A
[[审题指导]后归纳] 晶体类型的判断方法
(1)依据物质的分类判断
①金属氧化物(如K2O等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)都是分子晶体。
③常见的原子晶体单质有金刚石、晶体硅、晶体硼等;化合物有碳化硅、二氧化硅等。
④金属单质(除汞外)与合金是金属晶体。
(2)依据晶体的物理性质不同进行判断
①离子晶体一般熔沸点较高,硬度较大,其水溶液或熔化时能导电。
②原子晶体一般熔沸点较高,硬度更大,一般不导电,但也有例外,如晶体硅。
③分子晶体一般熔沸点低,硬度小,一般不导电,但也有部分(如酸和部分气态氢化物)溶于水导电。
④金属晶体一般熔沸点较高(Hg除外),硬度较大,能导电。