- 2021-05-09 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖北省宜昌市长阳县第一高级中学2019-2020学年高一上学期10月月考化学试卷
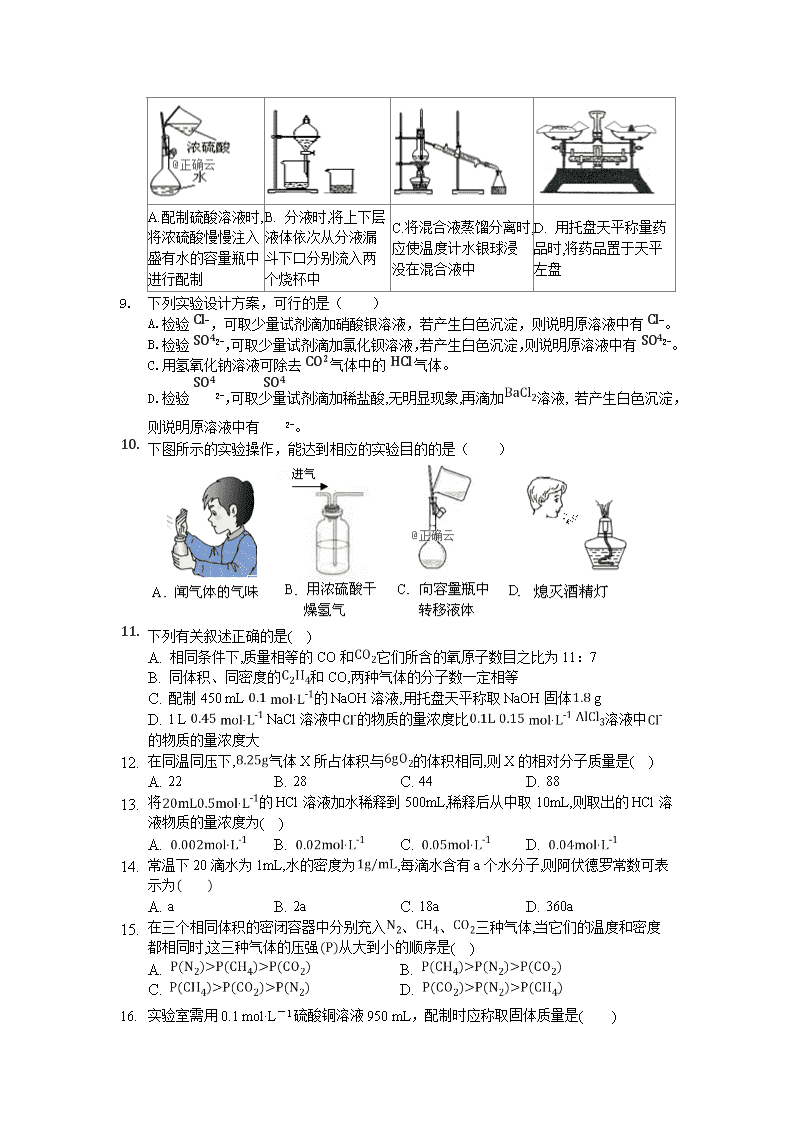
高一化学试卷 分数 100分 时间 90分钟 说明:本卷可能用到的相对原子质量:H-1 O-16 C-12 N-14 Cl-35.5 Na-23 S-32 Al-27 Cu-64 Ca-40 一、单选题(本大题共18小题,共54分) 1. 本草衍义中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之”文中涉及的操作方法是 A. 蒸馏 B. 升华 C. 过滤 D. 萃取 2. 根据所给信息或标志,判断下列说法错误的是( ) A B C D 在实验室和生产生活中,安全都是避免伤害和事故的保障 用肥皂液涂在天然气管道接口处检验是否漏气 在运送硫酸的油罐车上贴有该标志 看到有该标志的丢弃物,应远离并报警 贴有该标志的物品是可回收物 3. 阿伏加德罗常数的值为,下列叙述中错误的是( ) 标准状况下,水中含有个水分子 常温常压下,32g 含有的分子数约为 NaOH的摩尔质量为 的气体摩尔体积约为 标况下,由和组成的混合气体中,所含有的氮原子的物质的量为2mol 的溶液中的数目为 常温常压下,1mol氦气含有的原子数为 氯气中含有 个氯原子. A. B. C. D. 4. 在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.20mol/L,则c(SO42-)为( ) A、0.15mol/L B、0.20 mol/L C、0.35 mol/L D、0.40 mol/L 5. 下列常用化学仪器中,不能直接用于混合物的分离或提纯的是( ) A.普通漏斗 B.容量瓶 C.分液漏斗 D.蒸馏烧瓶 6. 实验室进行过滤和蒸发操作时,都要用到的仪器是( ) A.烧杯 B.玻璃棒 C.蒸发皿 D.酒精灯 7. 下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是( ) A.气体实验装置在实验前进行气密性检查 B.实验剩余的药品不能放回原试剂瓶 C.可燃性气体点燃前需要验纯 D.滴管不能交叉使用 8. 下述实验操作中,正确的是( ) A.配制硫酸溶液时,将浓硫酸慢慢注入盛有水的容量瓶中进行配制 B. 分液时,将上下层液体依次从分液漏斗下口分别流入两个烧杯中 C.将混合液蒸馏分离时,应使温度计水银球浸没在混合液中 D. 用托盘天平称量药品时,将药品置于天平左盘 1. 下列实验设计方案,可行的是( ) A.检验Cl-,可取少量试剂滴加硝酸银溶液,若产生白色沉淀,则说明原溶液中有Cl-。 B.检验SO42-,可取少量试剂滴加氯化钡溶液,若产生白色沉淀,则说明原溶液中有SO42-。 C.用氢氧化钠溶液可除去CO2气体中的HCl气体。 D.检验SO42-,可取少量试剂滴加稀盐酸,无明显现象,再滴加溶液, 若产生白色沉淀,则说明原溶液中有SO42-。 2. 下图所示的实验操作,能达到相应的实验目的的是( ) 3. 下列有关叙述正确的是( ) A. 相同条件下,质量相等的CO和它们所含的氧原子数目之比为11:7 B. 同体积、同密度的和CO,两种气体的分子数一定相等 C. 配制450 mL 的NaOH溶液,用托盘天平称取NaOH固体 g D. 1 L NaCl溶液中的物质的量浓度比 溶液中的物质的量浓度大 4. 在同温同压下,气体X所占体积与的体积相同,则X的相对分子质量是( ) A. 22 B. 28 C. 44 D. 88 5. 将的HCl溶液加水稀释到500mL,稀释后从中取10mL,则取出的HCl溶液物质的量浓度为( ) A. B. C. D. 6. 常温下20滴水为1mL,水的密度为,每滴水含有a个水分子,则阿伏德罗常数可表示为 A. a B. 2a C. 18a D. 360a 7. 在三个相同体积的密闭容器中分别充入、、三种气体,当它们的温度和密度都相同时,这三种气体的压强从大到小的顺序是( ) A. B. C. D. 8. 实验室需用0.1 mol·L-1硫酸铜溶液950 mL,配制时应称取固体质量是( ) A.15.2 g CuSO4 B.15.2 g CuSO4·5H2O C.23.8g CuSO4·5H2O D.25.0 g CuSO4·5H2O 1. 浓度均为的KCl、、三种溶液,分别与溶液反应,当生成的AgCl沉淀的质量之比为3:2:1时,所用KCl、、三种溶液的体积比为 A. 9:6:2 B. 9:3:1 C. 6:3:2 D. 6:3:1 2. 标准状况下VL的HCl气体溶解在1L水中水的密度近似为,所得溶液的密度为 ,质量分数为,物质的量浓度为c ,则下列关系中不正确的是( ) A. B. C. D. 二、填空题(本大题共小题,共46分) 3. 选择下列实验方法分离物质,将分离方法的序号填在横线上(每空1.5分,共9分) A 萃取分液法 B 结晶法 C 分液法 D 蒸馏法 E 过滤法 F高温分解法 ______除去CaO固体中少量的固体. ______分离水和汽油的混合物. ______分离互溶的四氯化碳沸点为和甲苯沸点为的混合物. ______从碘的水溶液里提取碘. ______从硝酸钾和氯化钠的混合液中获得硝酸钾. ⑥______除去石灰水中的. 4. (8分)通过海水晾晒可得粗盐,粗盐除NaCl外,还含有、、以及泥沙等杂质以下是制备精盐的实验方案,各步操作流程如图: 在第步粗盐溶解操作中要用玻璃棒搅拌,作用是__________________. 第步操作的目的是除去粗盐中的____________填化学式,下同,第步操作的目的是除去滤液中____________. 第步“过滤”操作中得到沉淀的成分有:泥沙、、、__________填化学式. 在第步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是___________. 实验所得精盐的质量大于粗盐中NaCl的质量,原因是_______________________. 5. (13分)如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: 该浓盐酸的物质的量浓度为______. 某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为稀盐酸,可供选用的仪器有:胶头滴管 烧瓶 烧杯 药匙 量筒托盘天平 玻璃棒 ,请回答下列问题: (1) 配制稀盐酸时,上述仪器中不需要使用的有______选填序号,还缺少的仪器有______写仪器名称. (2) 下列对容量瓶及其使用方法的描述中正确的是______. A.容量瓶上标有容积、温度和浓度 B.容量瓶用蒸馏水洗净后,必须烘干 C.容量瓶可用来长期储存溶液 D.使用前要检查容量瓶是否漏水 (3) 该学生需要量取______mL上述浓盐酸来配制。 (4) 配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________________________; A.用30mL水洗涤烧杯2--3次,洗涤液均注入容量瓶,振荡 B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水约的烧杯中,用玻璃棒慢慢搅动,使其混合均匀 C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中 D.将容量瓶盖紧,颠倒摇匀 E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切 F.继续往容量瓶内小心加水,直到液面接近刻度线处 (5)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?填“偏高”或“偏低”或“无影响”. I、用量筒量取浓盐酸时俯视观察凹液面______ II、用量筒量取浓盐酸后,洗涤量筒2--3次,洗涤液也转移到容量瓶______ III、溶液注入容量瓶前没有恢复到室温就进行定容______ 1. (2分)标准状况下,现有;个HCl分子;; ,对这四种气体的关系有以下四种表述:其中正确的是 ____________ . 体积: 物质的量: 质量: 氢原子个数: 2. 利用相关知识填空.(每空2分,共14分) . 中所含氢原子数与______ g 水所含氢原子数相等. 含 ,则 的摩尔质量为___________.R的相对原子质量是___________. 标况下, 16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体的密度相对氢气为________,一氧化碳和二氧化碳的物质的量之比为___________,若将此混合气体通入足量的澄清石灰水中,生成的沉淀的质量是___________。查看更多