- 2021-05-09 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
课标版2021高考化学一轮复习专题八卤族元素及其重要化合物海水资源的开发和利用课件
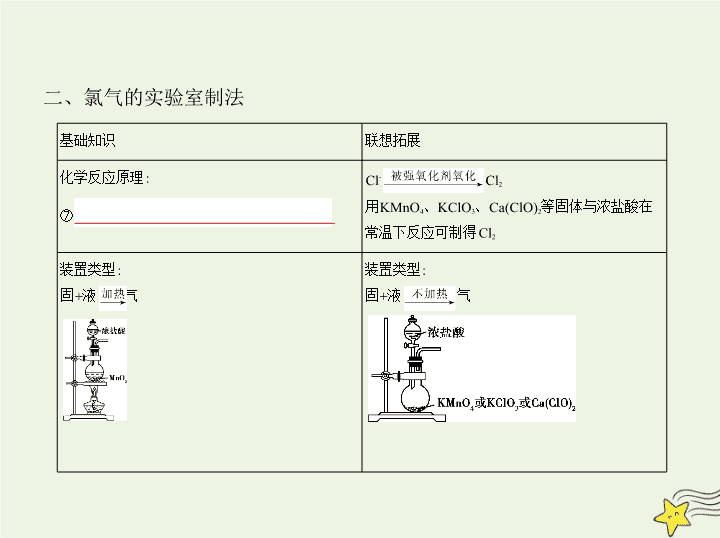
考点一 氯及其化合物的性质 考点清单 考点基础 一、氯元素的位、构、性关系 1.氯元素位于元素周期表中① 第三 周期② 第ⅦA 族,其原子结构 示意图为 。氯原子易得到一个电子形成氯离子( ), 因此,氯元素具有较强的非金属性,在自然界中以化合态形式存在。氯气具 有③ 强氧化 性,化学性质活泼,以得电子发生还原反应为主。 2.氯气的性质 二、氯气的实验室制法 基础知识 联想拓展 化学反应原理: ⑦ MnO 2 +4HCl(浓) MnCl 2 +Cl 2 ↑+2H 2 O Cl - Cl 2 用KMnO 4 、KClO 3 、Ca(ClO) 2 等固体与浓盐酸在 常温下反应可制得Cl 2 装置类型: 固+液 气 装置类型: 固+液 气 收集方法: 向上排空气法或排饱和食盐水法 收集方法的选择与气体的密度、溶解性及其在 空气中的稳定性等有关 尾气吸收:Cl 2 有毒,常用⑧ NaOH溶液 吸收尾 气,防止污染环境 根据有害气体的性质,常设置点燃转化、试剂吸 收等处理装置 说明 Cl 2 中的HCl(g)可用饱和食盐水吸收 ,H 2 O(g)可用浓硫酸吸收。 重点突破 一、氯水成分的复杂性和性质的多样性 1.反应原理及成分 Cl 2 +H 2 O H + +Cl - +HClO HClO H + +ClO - 2HClO 2HCl+O 2 ↑ 新制氯水中,存在的分子有Cl 2 、H 2 O、HClO,离子有H + 、Cl - 、ClO - 、OH - 。 长时间放置的氯水变质转化为稀盐酸。 2.氯水的性质 氯水在与不同物质发生反应时,表现出成分的复杂性和性质的多样性。 说明 (1)氯水通常密封保存于棕色试剂瓶中(见光易分解的物质均保存在 棕色试剂瓶中); (2)Cl 2 能使湿润的蓝色石蕊试纸先变红,后褪色。 二、次氯酸、氯气、活性炭、SO 2 和Na 2 O 2 漂白性的区别 次氯酸漂白是利用次氯酸的强氧化性,把有机色素氧化成无色物质,属于化 学变化,具有不可逆性、彻底性。次氯酸漂白的对象是有机色素,不能漂白 无机离子如Fe 3+ 、Cu 2+ 等。 氯气漂白的实质是次氯酸的漂白,干燥的氯气不具有漂白性。如Cl 2 只能使 湿润的有色布条褪色,因为氯气和水反应生成次氯酸,次氯酸具有漂白性。 这个性质常用于检验氯气。 活性炭漂白是利用活性炭的吸附作用,是一种物理漂白。 SO 2 漂白是由于它能跟某些有色物质反应生成不稳定的无色物质。 注意 SO 2 只能使紫色石蕊试液变红,而不能使其褪色。 Na 2 O 2 具有漂白性是因为过氧化钠有极强的氧化性,能把有机色素氧化成 无色物质。 考点二 卤素性质的相似性和递变性 海水资源的开发利用 考点基础 一、卤素性质的相似性和递变性 1.相似性 (1)都能与大多数金属反应,如2Fe+3Br 2 2FeBr 3 (I 2 与Fe反应生成① FeI 2 ) ; (2)都能与H 2 反应:H 2 +X 2 2HX; (3)都能与H 2 O反应:X 2 +H 2 O HX+HXO(F 2 与H 2 O的反应为 2F 2 +2H 2 O 4HF+O 2 ) ; (4)都能与碱液反应(F 2 除外),如Cl 2 +2NaOH NaCl+NaClO+H 2 O。 2.递变性 F 2 Cl 2 Br 2 I 2 颜色: 颜色加深 熔、沸点: 逐渐升高 密度: 逐渐增大 水溶性: 逐渐减小 氧化性: 逐渐减弱 还原性(X - ): 逐渐增强 注意 根据相似相溶原理,Br 2 、I 2 在水中溶解度小,而易溶于酒精、苯、四 氯化碳等有机溶剂。 对于在溶液中生成Br 2 、I 2 的反应,常加入苯或四氯化 碳,通过有机层的颜色来加以确认 。 3.特殊性 氟元素无正价 ,F 2 与H 2 O发生置换反应生成O 2 ,F 2 可与Xe、Kr等稀有气体反 应生成氟化物。 ② Br 2 是 常温下唯一呈液态的非金属单质 ;液溴易挥发且有毒,通常用 ③ 水 液封来保存。 I 2 易升华,淀粉溶液遇I 2 变蓝 。 Br 2 和I 2 都可被某些有机溶剂(如四氯化碳、汽油)萃取。 I 2 易与Na 2 S 2 O 3 溶液反应:I 2 +2S 2 2I - +S 4 ,用于通过滴定(以④ 淀粉 溶液 为指示剂)来定量测定碘的含量。 二、海水资源的开发利用 重点突破 1.海水中提溴(Br 2 ) (1)先用蒸馏法将海水浓缩,再用硫酸将浓缩的海水酸化。 (2)向酸化的海水中通入适量的氯气,使溴离子转化为溴单质。 2NaBr+Cl 2 Br 2 +2NaCl (3)向含溴单质的水溶液中通入热空气或水蒸气吹出溴蒸气,使溴蒸气与二 氧化硫在吸收塔内作用以达到富集的目的。 Br 2 +SO 2 +2H 2 O 2HBr+H 2 SO 4 (4)向吸收塔内的溶液中通入适量的氯气。 2HBr+Cl 2 2HCl+Br 2 (5)用四氯化碳(或苯)萃取吸收塔内溶液中的溴单质。 2.海水中提碘(I 2 ) 虽然海水中碘的总蕴藏量很大,但由于其浓度很低,故目前工业生产中碘的 获得并不是直接从海水中提取。因为海洋中的某些植物具有富集碘的能 力,如海带等,所以从海带等海产品中提取碘是工业上获取碘的重要途径。 从海带中提取碘的流程图如下: 灼烧 水 氧化剂 干海带→海带灰→浸泡液 滤液 碘的四氯化碳溶液 碘单 质 常用的氧化剂有Cl 2 、H 2 O 2 、MnO 2 等。 方法 卤素离子的检验方法 1.AgNO 3 溶液—沉淀法 未知液 2.置换—萃取法 未知液 有机层呈 方法技巧 3.氧化—淀粉法检验I - 未知液 蓝色溶液,表明有I - 例 (2019湖北石首一中一调,16)用下面的方案进行某些离子的检验,其中 方案设计严密的是 ( ) A.检验试液中的S :试液 无沉淀 白色沉淀 B.检验试液中的S :试液 气体 褪色 C.检验试液中的I - :试液 棕黄色溶液 蓝色溶液 D.检验试液中的C :试液 白色沉淀 沉淀 溶解 考虑所加试剂的性质;考虑离子的干扰。 解题导引 解析 A项,Ag + 、S 均干扰S 的检验;B项,HS 、ClO - 均干扰S 的 检验;D项,S 干扰C 的检验;C项,H 2 O 2 将I - 氧化为I 2 ,碘水呈棕黄色,淀粉 遇I 2 会变蓝;A、B、D均不严密,C严密。 答案 C查看更多