- 2021-05-09 发布 |
- 37.5 KB |
- 11页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习科学探究作业(全国通用)
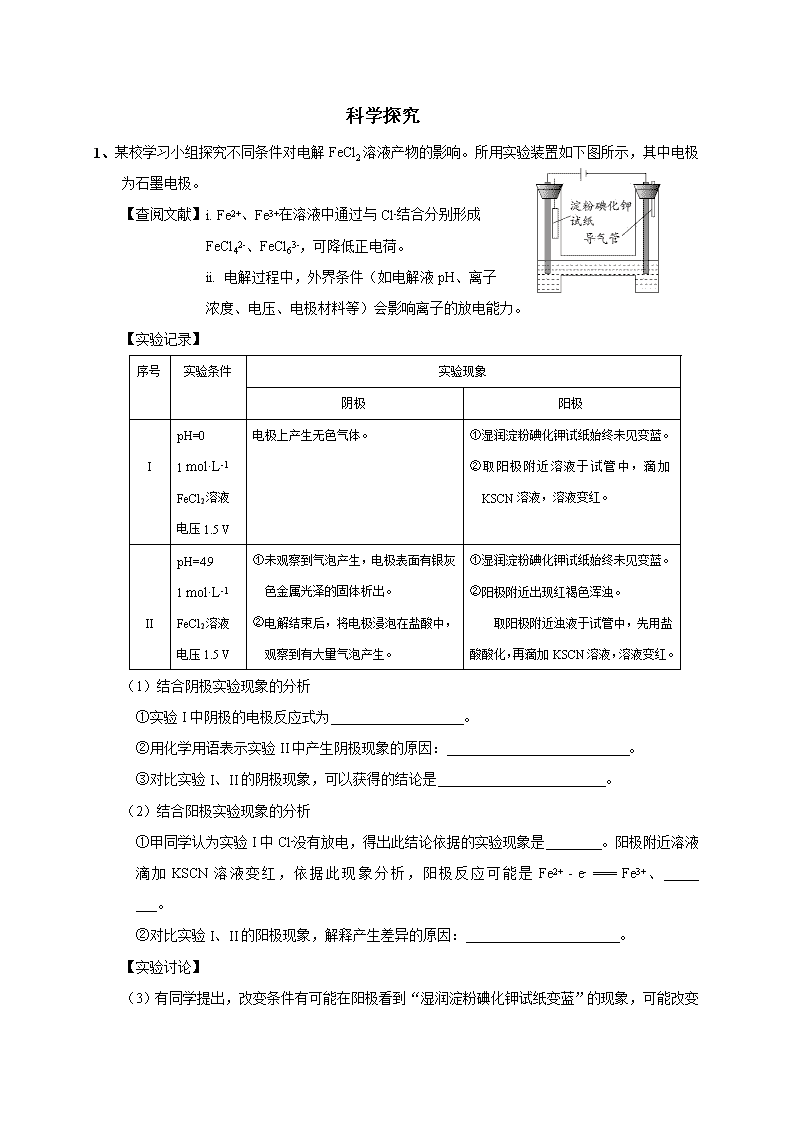
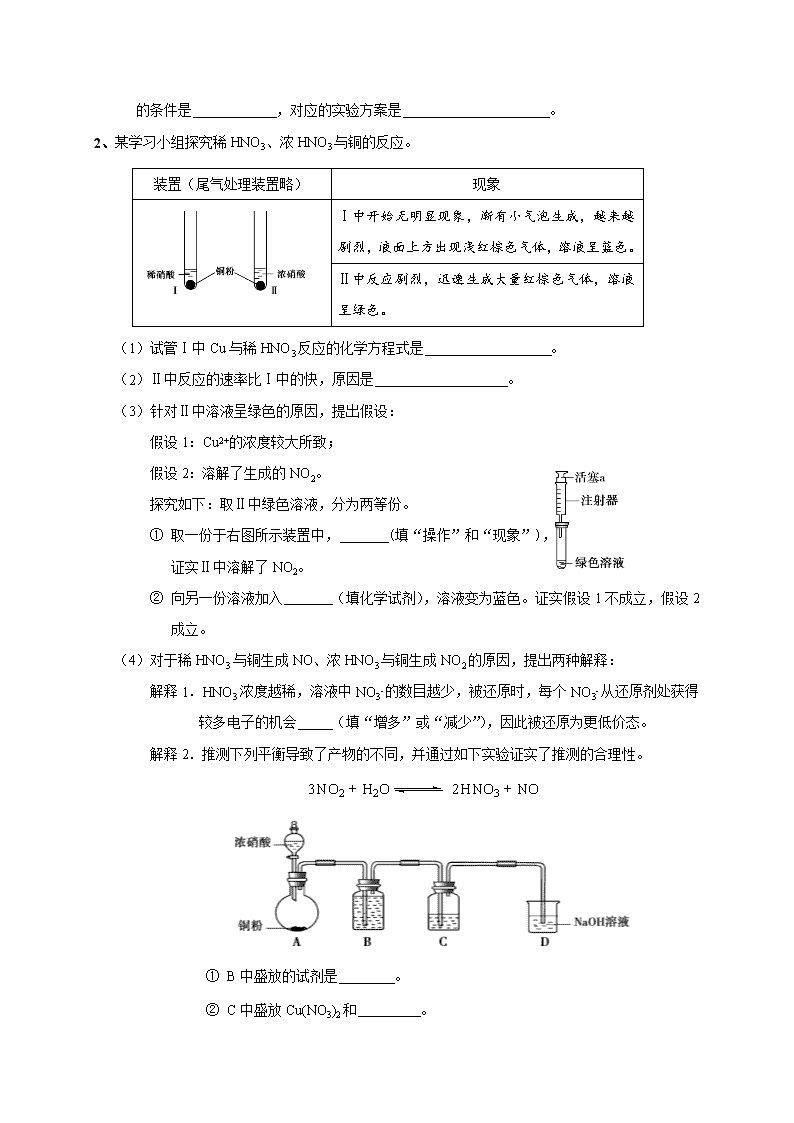
科学探究 1、某校学习小组探究不同条件对电解FeCl2溶液产物的影响。所用实验装置如下图所示,其中电极为石墨电极。 【查阅文献】i. Fe2+、Fe3+在溶液中通过与Cl-结合分别形成 FeCl42-、FeCl63-,可降低正电荷。 ii. 电解过程中,外界条件(如电解液pH、离子 浓度、电压、电极材料等)会影响离子的放电能力。 【实验记录】 序号 实验条件 实验现象 阴极 阳极 I pH=0 1 mol·L-1 FeCl2溶液 电压1.5 V 电极上产生无色气体。 ①湿润淀粉碘化钾试纸始终未见变蓝。 ②取阳极附近溶液于试管中,滴加KSCN溶液,溶液变红。 II pH=4.9 1 mol·L-1 FeCl2溶液 电压1.5 V ①未观察到气泡产生,电极表面有银灰色金属光泽的固体析出。 ②电解结束后,将电极浸泡在盐酸中,观察到有大量气泡产生。 ①湿润淀粉碘化钾试纸始终未见变蓝。 ②阳极附近出现红褐色浑浊。 取阳极附近浊液于试管中,先用盐酸酸化,再滴加KSCN溶液,溶液变红。 (1)结合阴极实验现象的分析 ①实验I中阴极的电极反应式为 。 ②用化学用语表示实验II中产生阴极现象的原因: 。 ③对比实验I、II的阴极现象,可以获得的结论是 。 (2)结合阳极实验现象的分析 ①甲同学认为实验I中Cl-没有放电,得出此结论依据的实验现象是________。阳极附近溶液滴加KSCN溶液变红,依据此现象分析,阳极反应可能是Fe2+ - e- === Fe3+、_____ ___。 ②对比实验I、II的阳极现象,解释产生差异的原因: 。 【实验讨论】 (3)有同学提出,改变条件有可能在阳极看到“湿润淀粉碘化钾试纸变蓝” 的现象,可能改变的条件是 ,对应的实验方案是 。 2、某学习小组探究稀HNO3、浓HNO3与铜的反应。 装置(尾气处理装置略) 现象 Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 (1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是 。 (2)Ⅱ中反应的速率比Ⅰ中的快,原因是 。 (3)针对Ⅱ中溶液呈绿色的原因,提出假设: 假设1:Cu2+的浓度较大所致; 假设2:溶解了生成的NO2。 探究如下:取Ⅱ中绿色溶液,分为两等份。 ① 取一份于右图所示装置中, (填“操作”和“现象”), 证实Ⅱ中溶解了NO2。 ② 向另一份溶液加入 (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。 (4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释: 解释1.HNO3浓度越稀,溶液中NO3- 的数目越少,被还原时,每个NO3- 从还原剂处获得较多电子的机会 (填“增多”或“减少”),因此被还原为更低价态。 解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。 ① B中盛放的试剂是 。 ② C中盛放Cu(NO3)2和 。 ③ 该小组证实推测的合理性所依据的实验现象是 。 3、探究0.5 mol/L FeCl3溶液(pH = 1)与不同金属反应时的多样性的原因。 (各组实验中:所用FeCl3溶液体积相同;金属过量;静置、不振荡) 编号 金属 现象及产物检验 Ⅰ 镁条 立即产生大量气体,金属表面变黑,该黑色固体能被磁铁吸引,液体颜色由棕黄色逐渐变为红褐色; 片刻后气泡减少,金属表面覆盖有红褐色沉淀,此时取反应后的液体,滴加K3[Fe(CN)6]溶液,生成蓝色沉淀。 Ⅱ 铜粉 无气体产生,溶液逐渐变为蓝绿色; 取反应后的溶液,滴加K3[Fe(CN)6]溶液,生成蓝色沉淀。 (1)根据实验Ⅰ中的现象,推测红褐色液体为胶体,并用光束照射该液体,在与光束垂直的方向观察到 得以证实。 (2)已知:Fe和Fe3O4均能被磁铁吸引。 ① 为了确定黑色固体的成分是否含有Fe与Fe3O4,重复实验Ⅰ,及时取少量镁条表面生成的黑色粉末,洗净后进行实验如下: 该实验说明黑色固体中一定含有 ,结合现象写出判断的理由: 。 ② 除上述结论外,分析实验Ⅰ的现象,可知被还原得到的产物一定还有 。 (3)实验Ⅰ、Ⅱ中现象的差异,与Fe3+、Mg2+、Fe2+、H+、Cu2+的氧化性强弱有关,其顺序是Mg2+ < Fe2+ < 。 (4)继续探究0.5 mol/L FeCl3溶液(pH = 1)与Fe的反应。 编号 金属 现象及产物检验 Ⅲ 铁粉 持续产生少量气体;一段时间后,溶液颜色变浅,底部有红褐色沉淀,经检验,溶液pH = 4,含有Fe2+,无Fe3+。 Ⅳ 铁丝 无明显的气泡产生;一段时间后,溶液变为浅绿色,经检验,溶液pH = 2,含有Fe2+和Fe3+;Fe3+被还原的量多于实验Ⅲ。 ② 实验Ⅲ中发生反应的离子方程式有 。 ② 已知:相同条件下,H+在溶液中的移动速率远大于Fe3+。结合实验Ⅰ、Ⅱ,由反应中金属表面离子浓度的变化,推测实验Ⅲ、Ⅳ现象差异的原因: 。 4、实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。 【实验Ⅰ】向盛有H2O2溶液的试管中,加入过量的K2Cr2O7溶液和硫酸,振荡,溶液立即变为紫红色,此时pH=1。溶液中持续产生气泡,最终溶液变为绿色。 资料: ⅰ.Cr2(SO4)3溶液呈绿色。 ⅱ.酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2。 ⅲ.CrO5是一种+6价Cr的过氧化物,其结构如右图,CrO5可溶于水, 易溶于乙醚得到蓝色溶液。 ⅳ.乙醚是一种无色、不溶于水、密度比水小的有机溶剂,化学性质稳定。 (1)实验Ⅰ中产生的气体是O2,检验的方法是______ __。 (2)实验Ⅰ的紫红色溶液中含有CrO5。 ① 验证紫红色溶液中含有CrO5的操作及现象是_____ ___。 ② 生成CrO5的反应不是氧化还原反应,反应的离子方程式是_____ ___。 (3)对实验Ⅰ中溶液变为绿色和产生O2的原因,作出如下假设: a.CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。 b.CrO5在酸性条件下氧化了溶液中的H2O2,生成Cr3+和O2。 为验证上述假设,用下图装置进行实验Ⅱ和实验Ⅲ(夹持装置已略,B中石蜡油 用于吸收挥发出的乙醚)。实验操作及现象如下: 【实验Ⅱ】 ⅰ.将20 mL CrO5的乙醚溶液加入A中的20 mL pH=1的稀硫酸中,不断搅拌,乙醚层由蓝色 变为无色,水层变为绿色,O2体积为V mL。 ⅱ.步骤ⅰ结束后向A中加入少量K2Cr2O7溶 液,轻轻搅拌,静置,乙醚层又显出蓝色。 【实验Ⅲ】 仅将实验Ⅱ中的pH=1的稀硫酸替换为等量的含H2O2的pH=1的稀硫酸,重复实验。 现象与实验Ⅱ相同,且O2体积仍为V mL。 ① 实验Ⅱ步骤ⅰ中消耗的CrO5与生成的O2的物质的量之比为2∶3,补全离子方程式: 2CrO5 +________ == 2Cr3+ + 3O2↑+ ________ + ________。 ② 甲同学认为依据实验Ⅱ和Ⅲ中生成O2的体积相同,无法说明假设b是否成立,其理由是_____ ___。 (4)实验Ⅰ中总反应的离子方程式是________。 5、实验小组制备硫代硫酸钠(Na2S2O3·5H2O)并探究其性质。 资料: Na2S2O3·5H2O在中性溶液中较稳定,在酸性溶液中分解产生S、SO2。 Ⅰ. 以SO2、Na2S、Na2CO3为原料制备Na2S2O3·5H2O,装置如下图所示: △ (1)A是SO2气体发生装置,常温下用亚硫酸钠固体与浓硫酸反应制取SO2,实验过程中需要控制SO2产生的速率。请在虚框内将装置A补充完整。 (2)B中生成硫代硫酸钠的实质是:S + Na2SO3 === Na2S2O3 ①S是由 、 、H2O反应得到。 ②实验过程中有大量CO2产生,化学方程式为 。 (3)装置C中的试剂为 ,作用是 。 (4)当装置B中溶液的pH约为7时应停止通入SO2,否则Na2S2O3的产率下降,其原因是 。 Ⅱ. 探究Na2S2O3的性质: (5)研究S产生的原因: 已知:Na2S2O3中S元素的化合价分别为-2和+6 提出假设:假设1:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素 假设2:空气中的O2也可能氧化-2价硫元素 步骤1 取Na2S2O3晶体,溶解,配成0.2mol/L溶液。 步骤2 取4mL溶液,向其中加入1mL饱和氯水(pH = 2.4),溶液立即出现浑浊,经检验浑浊物为S。 步骤3 继续滴加氯水,浑浊度增大,最后消失,溶液变澄清。 假设3:酸性条件下Na2S2O3分解产生S 设计实验方案: 1mL饱和氯水 b a 立即出现浑浊 一段时间后出现浑浊 浑浊度较实验a小 4mL 0.2mol/LNa2S2O3溶液 4mL 0.2mol/LNa2S2O3溶液 ①向试管b中加入 。 ②依据现象,S产生的主要原因是 ,说明理由 。 (6)步骤3,继续加入氯水,沉淀消失的原因是 (写化学方程式)。 6、Na2S2O4俗称保险粉,常用做纺织工业的漂白剂、脱色剂等。某科研小组制备并探究其性质。 资料:Na2S2O4易溶于水,具有极强的还原性,易被空气氧化,在碱性介质中稳定。 Ⅰ.制备Na2S2O4(加热等辅助仪器略去) Na2SO3固体 70%的硫酸 NaOH溶液 A B C NaOH溶液 Zn粉-水悬浮液 ① (1)仪器①的名称是 。 (2)B装置用于制备Na2S2O4。第一步反应:Zn+2SO2 ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为 。 (3)B装置反应前,先进行的实验操作是 。 (4)反应后除去B中的沉淀,在滤液中加入一定量的NaCl固体搅拌,有Na2S2O4晶体析出。加入NaCl固体的作用是 。 Ⅱ.探究Na2S2O4的性质 (5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是 。 (可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液) (6)制备纳米级银粉 用NaOH溶液溶解Na2S2O4,加入一定量的AgNO3溶液,生成纳米级的银粉。在制备银粉的反应中,氧化剂和还原剂的物质的量之比为2︰1,且生成的含硫物质只有一种,写出该反应的离子方程式 。 7、某兴趣小组欲探究SO2与Cu(OH)2 的反应。 实验 实验步骤 现象 15 mL 0.5 mol/L CuCl2溶液 步骤1:打开分液漏斗,向烧瓶中加入30 mL 0.5 mol/L NaOH溶液 I. 有蓝色絮状沉淀,静置后分层。 步骤2:从左侧导管通入SO2气体 II. 静置后分层,上层溶液为淡绿色, 底部有白色沉淀, (1)现象I中产生蓝色沉淀的离子方程式是 。 (2)甲为了确认现象II中白色沉淀的成分,进行如下探究。 查阅资料: CuSO3 CuCl Cu2O 溶解性 不溶于水,浅黄色沉淀 不溶于水,白色沉淀 不溶于水,砖红色沉淀 性质 与酸反应 能溶于较浓的HCl溶液 酸性体系中不稳定,进一步反应生成Cu和Cu2+ 并进行如下实验: 试剂a 洗净的白色沉淀 沉淀消失,无气体产生 ① 试剂a是 。 ② 现象II中生成白色沉淀的离子方程式是 。 (3)甲认为Cu(OH)2沉淀全部转化为CuCl,乙依据实验现象对甲的观点进行反驳,依 据的实验现象是 。 (4)丙认为实验存在干扰,欲探究纯净的Cu(OH)2 悬浊液与SO2的反应。 ① 丙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中, (填操作和现象),证明已洗涤干净。再进行如下实验: 实验 实验步骤 现象 纯净的Cu(OH)2悬浊液 从左侧导管通入SO2气体 III. 静置后分层,上层溶液为淡绿色, 底部有砖红色沉淀。 ② 丙预测产物是Cu2O,取砖红色沉淀,洗涤后, (填操作和现象)证明产物是Cu2O。 (5)纯净的Cu(OH)2 悬浊液与SO2发生反应的化学方程式是 。 参考答案 1、(1)① 2H+ + 2e- == H2↑ ② Fe2+ + 2e- == Fe和Fe + 2H+ == Fe2+ + H2↑(FeCl42-合理正确给分,各1分) ③其他条件相同时,pH=0,pH较小,c(H+)较大]时,阴极H+优先于1 mol·L-1 Fe2+放电产生H2,而pH=4.9,pH较大,c(H+)较小时,阴极1 mol·L-1Fe2+优先于H+放电产生Fe 2分 或整体回答:由pH=0变为pH=4.9,c(H+)减小,H+放电能力减弱,Fe2+放电能力增强 (2)①湿润淀粉碘化钾试纸始终未见变蓝 FeCl42- - e- === Fe3+ + 4Cl-(或写为:FeCl42- + 2Cl- - e- === FeCl63-) ②随着溶液pH的越低,c(H+)升高,抑制水解平衡Fe3+ + 3H2O Fe(OH)3 + 3H+正向移动,难以生成Fe(OH)3 或正向回答:随着溶液pH的增大,c(H+)减小,有利于水解平衡Fe3+ + 3H2O Fe(OH)3 + 3H+正向移动,生成Fe(OH)3 (3)可改变条件1:改变c(Cl-) 保持其他条件不变,用2 mol/L FeCl2溶液和n(n>0)mol/L NaCl溶液等体积混合的溶液作为电解液[c(Fe2+)= 1 mol/L,c(Cl-)>2 mol/L],观察阳极“湿润淀粉碘化钾试纸”上的现象 可改变条件2:改变电压 保持其他条件不变,增大电压(或改变电压),观察阳极“湿润淀粉碘化钾试纸”上的现象 2、(1) (2)硝酸浓度大 (3)① 向上拉动活塞a,试管内液面上方出现红棕色气体 ② (或CuO等) (4)解释1.增多 解释2.① 水 ② 浓硝酸 ③ C中溶液变绿 3、(1)一条光亮的“通路” (2)① Fe 滤纸ⅱ上无明显现象,说明Fe3O4不能溶解产生Fe2+,所以滤纸ⅰ上粉末附近变蓝只能是Fe被氧化产生Fe2+ ② H2、Fe2+ (3) H+ < Cu2+ < Fe3+ (4) ① Fe + 2H+ === Fe2+ + H2↑,Fe3+ + 3H2O Fe(OH)3 + 3H+ ( Fe + 2Fe3+ === 3Fe2+) ② 由I、Ⅲ可知,金属与Fe3+、H+反应速率快时,因H+移动速率大,其浓度在金属表面变化小,易被还原,促使Fe3+水解生成Fe(OH)3;Ⅳ中反应慢,Fe表面Fe3+能及时补充,且由Ⅱ知Fe3+的氧化性强,利于Fe3+还原 4、(1)将带火星的木条伸入试管中,木条复燃,说明生成的气体是O2(1分) (2)① 取少量紫红色溶液于试管中,加入乙醚,振荡,静置,液体分为两层,上层呈蓝色(2分) ② Cr2O72− + 4H2O2 + 2H+ == 2CrO5 + 5H2O(2分) (3)① 2CrO5 + 6H+== 2Cr3+ + 3O2↑+ H2O2 + 2H2O(2分) ② 实验Ⅱ、Ⅲ中,O2来源于CrO5、H2O2中的−1价O,且−1价O过量,当CrO5的量相同时,生成O2的体积相同,因而由实验Ⅱ和Ⅲ中生成O2的体积相同无法说明假设b是否成立(1分) (4)Cr2O72− + 3H2O2 + 8H+ == 2Cr3+ + 3O2↑+ 7H2O(2分) 5、(1) (2)① SO2 Na2S ② SO2 + Na2CO3== CO2 + Na2SO3 (3)NaOH 吸收SO2防止污染环境 (4)酸性条件下,Na2S2O3发生分解 (5)① 加入1mLpH=2.4的稀盐酸 ② 氯气等含氯氧化性微粒的氧化是主要因素,酸性分解及氧气氧化是次要因素 理由:实验b中包含酸性条件、空气两种影响因素,反应速率比实验a慢且浑浊度小 (6)3Cl2 + S + 4H2O ===6HCl + H2SO4 628~35℃ 、(1)圆底烧瓶 (2)ZnS2O4+2NaOH Na2S2O4 + Zn(OH)2¯ (3)打开A中分液漏斗活塞,使硫酸与亚硫酸钠先反应产生的SO2,排出装置中残留的O2 (4)加入氯化钠,增大了Na+离子浓度,促进Na2S2O4结晶析出(用沉淀溶解平衡解释可以)(答盐析只给1分) (5)取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质 (6)2Ag++S2O42—+4OH—=2Ag↓+2SO32—+2H2O 7、 (1)Cu2++2OH-Cu(OH)2↓ (2) ① 浓HCl ② SO2+2Cu(OH)2+2Cl-2CuCl+SO42-+2H2O (3)反应后上层为淡绿色溶液 (4) ①滴加HNO3酸化的AgNO3溶液,无白色沉淀产生 ②加入适量H2SO4溶液,产生紫红色固体,溶液变蓝 (5)3Cu(OH)2+SO2Cu2O+CuSO4+3H2O 查看更多