- 2021-05-09 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版氮及其化合物作业(1)
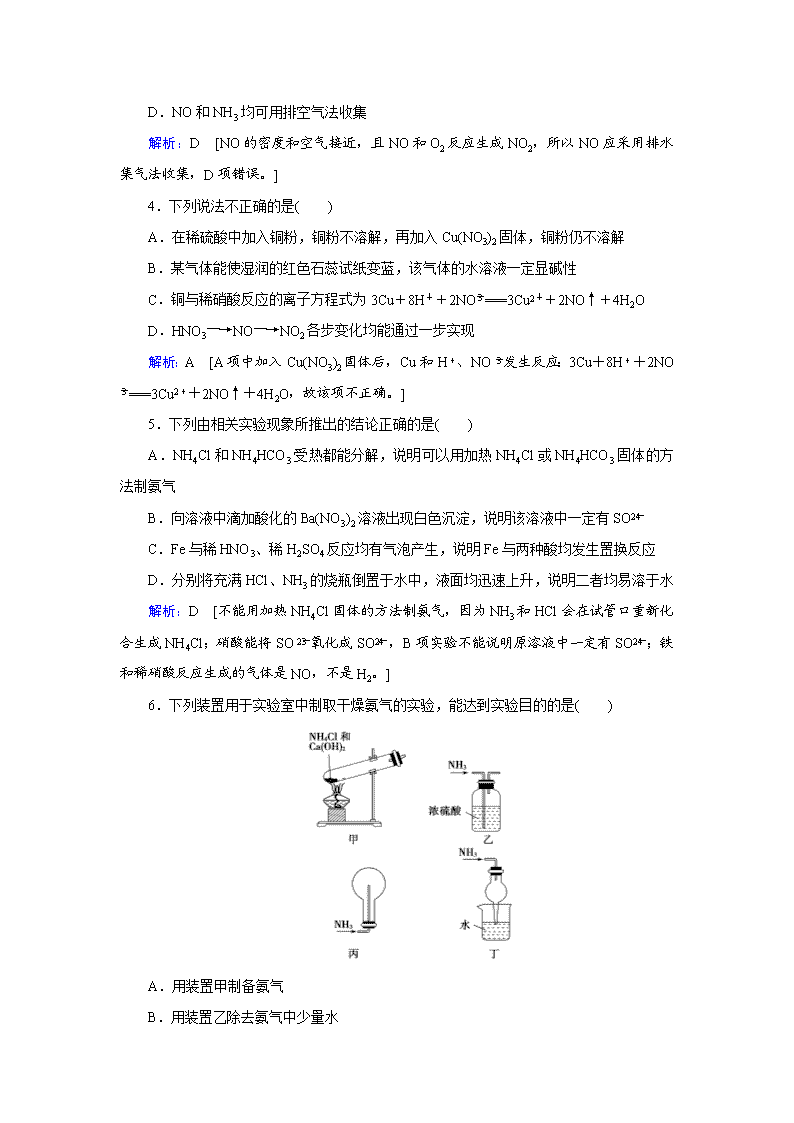
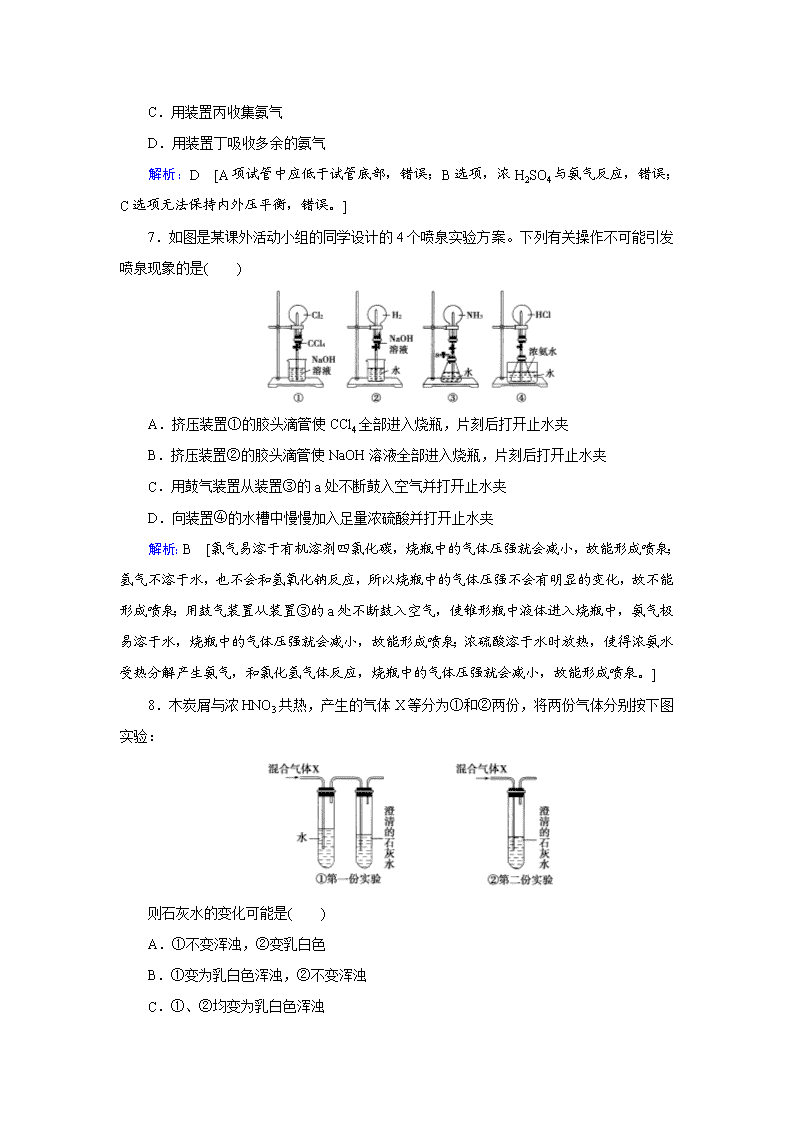
氮及其化合物 1.氮元素在海洋中的循环是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可如图表示。下列关于海洋氮循环的说法正确的是( ) A.海洋中的氮循环起始于氮的氧化 B.海洋中的氮循环中属于固氮作用的是③ C.海洋中的反硝化作用一定有氧气的参与 D.向海洋排放含NO的废水会影响海洋中NH的含量 解析:D [海洋中的氮循环起始于N2→NH,即起始于氮的还原,A错误;海洋中的氮循环中属于固氮作用的是②,B错误;反硝化作用中N元素化合价降低,被还原,而O2是常见氧化剂,不需要有O2参与,C错误;转化关系图中若硝酸根离子增多,反硝化作用增强,向海洋排放含NO的废水会影响海洋中NH的含量,D正确。] 2.下列有关氮气用途的说法不正确的是( ) A.作焊接金属的保护气 B.制硝酸和化肥的原料 C.食品袋中充氮气来防腐 D.与氧气反应制NO从而制硝酸 解析:D [氮气的化学性质不活泼,能防止金属在高温下被空气中的氧气氧化,A正确;氮气可用于合成氨,氨可作生产硝酸和化肥的原料,B正确;食品袋中充氮气可防止食品缓慢氧化而变质,C正确;氮气与氧气的反应很难进行,不能用氮气与氧气反应制NO,D错误。] 3.下列叙述不正确的是( ) A.NH3的喷泉实验说明氨气极易溶于水 B.NH3遇到挥发性强酸就能产生白烟 C.硝酸应放在棕色的细口瓶中保存 D.NO和NH3均可用排空气法收集 解析:D [NO的密度和空气接近,且NO和O2反应生成NO2,所以NO应采用排水集气法收集,D项错误。] 4.下列说法不正确的是( ) A.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 C.铜与稀硝酸反应的离子方程式为3Cu+8H++2NO===3Cu2++2NO↑+4H2O D.HNO3―→NO―→NO2各步变化均能通过一步实现 解析:A [A项中加入Cu(NO3)2固体后,Cu和H+、NO发生反应:3Cu+8H++2NO===3Cu2++2NO↑+4H2O,故该项不正确。] 5.下列由相关实验现象所推出的结论正确的是( ) A.NH4Cl和NH4HCO3受热都能分解,说明可以用加热NH4Cl或NH4HCO3固体的方法制氨气 B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 D.分别将充满HCl、NH3的烧瓶倒置于水中,液面均迅速上升,说明二者均易溶于水 解析:D [不能用加热NH4Cl固体的方法制氨气,因为NH3和HCl会在试管口重新化合生成NH4Cl;硝酸能将SO氧化成SO,B项实验不能说明原溶液中一定有SO;铁和稀硝酸反应生成的气体是NO,不是H2。] 6.下列装置用于实验室中制取干燥氨气的实验,能达到实验目的的是( ) A.用装置甲制备氨气 B.用装置乙除去氨气中少量水 C.用装置丙收集氨气 D.用装置丁吸收多余的氨气 解析:D [A项试管中应低于试管底部,错误;B选项,浓H2SO4与氨气反应,错误;C选项无法保持内外压平衡,错误。] 7.如图是某课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( ) A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹 B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹 C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹 D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹 解析:B [氯气易溶于有机溶剂四氯化碳,烧瓶中的气体压强就会减小,故能形成喷泉;氢气不溶于水,也不会和氢氧化钠反应,所以烧瓶中的气体压强不会有明显的变化,故不能形成喷泉;用鼓气装置从装置③的a处不断鼓入空气,使锥形瓶中液体进入烧瓶中,氨气极易溶于水,烧瓶中的气体压强就会减小,故能形成喷泉;浓硫酸溶于水时放热,使得浓氨水受热分解产生氨气,和氯化氢气体反应,烧瓶中的气体压强就会减小,故能形成喷泉。] 8.木炭屑与浓HNO3共热,产生的气体X等分为①和②两份,将两份气体分别按下图实验: 则石灰水的变化可能是( ) A.①不变浑浊,②变乳白色 B.①变为乳白色浑浊,②不变浑浊 C.①、②均变为乳白色浑浊 D.①、②都不变浑浊 解析:B [木炭与浓硝酸共热可以得到二氧化碳和二氧化氮两种气体,气体先导入适量蒸馏水中,二氧化氮溶于水,得到硝酸和一氧化氮,二氧化碳几乎不溶于水,再导入澄清石灰水中,二氧化碳可以使石灰水变浑浊,即①变浑浊;气体直接导入澄清石灰水中,二氧化氮将氢氧化钙转化为硝酸钙,二氧化碳不与硝酸钙溶液反应,即②不变浑浊。] 9.在容积为672 mL的烧瓶里充满NO、NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且水充满烧瓶(气体体积都折合成标准状况下)。下列有关叙述中,正确的是( ) A.总反应可能为NO+NO2+O2+H2O===2HNO3 B.总反应可能为4NO+8NO2+5O2+6H2O===12HNO3 C.生成HNO3的物质的量浓度接近0.03 mol·L-1 D.生成HNO3的物质的量浓度约为0.45 mol·L-1 解析:B [V(NO2+NO)∶V(O2)=12∶5,因烧瓶中的气体最终均生成了HNO3,故所得溶液的体积与溶解的NO2、NO体积相等,故c(HNO3)=[V(NO2+NO)÷22.4 L·mol-1]÷V(NO2 +NO)=0.045 mol·L-1。] 10.NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是( ) A.NH4Cl和NaHCO3都是常用的化肥 B.NH4Cl、HNO3和Na2CO3受热时都易分解 C.NH3和NO2在一定条件下可发生氧化还原反应 D.图中所涉及的盐类物质均可以水解 解析:C [NaHCO3不是化肥,A错;Na2CO3受热不易分解,B错;题图中所涉及的盐类物质中NaCl不能水解,D错。] 11.实验室模拟合成氨和催化氧化的流程如下: 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。 (1)从图中选择制取气体的合适装置:氮气 ________ 、氢气 ________ 。 (2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有____________ 、________________________________________________________________________。 (3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨, ________ (填“会”或“不会”)发生倒吸,原因是____________________________________________。 (4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是_________________________________________, 锥形瓶中还可观察到的现象是___________________________________________。 (5)写出乙装置中氨氧化的化学方程式:___________________________________ ________________________________________________________________________。 (6)反应结束后锥形瓶内的溶液中含有的离子为H+、OH-、 ________ 、 ________ 。 答案:(1)a b (2)干燥气体 控制氢气和氮气的流速 (3)不会 混合气体中含有大量难溶于水的氮气、氢气 (4)氨的催化氧化反应是一个放热反应 有红棕色气体产生 (5)4NH3+5O24NO+6H2O (6)NH NO 12.氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置。 (1)若分液漏斗中氨水的浓度为9.0 mol/L,配制该浓度的氨水100 mL,用到的玻璃仪器有100 mL容量瓶、烧杯、量筒、玻璃棒、 ________ 。 (2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X为_________ 。 (3)乙装置的作用是 ________________________ ;写出受热时丙装置发生反应的化学方程式: ____________________________ 。 (4)当戊中观察到 __________________ 现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因是 ______________________________________ ,如何改进装置__________________ 。 (5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 ____________________________________________ 。 解析:(2)甲中不需要加热即能同时产生NH3和O2,说明固体X溶于氨水既产生O2又放出大量热,则该固体为Na2O2。(3)乙装置为干燥管,干燥NH3和O2;NH3和O2在加热和Cr2O3的催化作用下,发生催化氧化反应。(4)HNO3能使石蕊试液变红;由于NH3过量,可能会与HNO3反应,致使观察不到溶液变红的现象;可在丙和丁之间连接一个能除去NH3的装置。(5)丁装置中为NO2,NO2会与H2O反应生成无色的NO,且使气体体积减小。 答案:(1)胶头滴管 (2)过氧化钠 (3)干燥氧气和氨气的混合气体 4NH3+5O24NO+6H2O (4)紫色石蕊试液变红 过量的氨气致使戊中溶液不一定呈酸性 在丙和丁之间连接盛有无水氯化钙的干燥管或盛有浓硫酸的洗气瓶 (5)试管丁内水面慢慢上升,上升到一定高度不再变化,试管内气体颜色由红棕色逐渐变淡至无色查看更多