北京市2019-2020学年高二下学期期末考前模拟训练化学试题
2020年北京高二年级下化学期末考前模拟训练(100分)
本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间50分钟。姓名:______
一、选择题(共10小题,每小题3分,共30分)
1. (2020·银川一中高二月考)已知A、B、C、D四种物质都是气体,现在5 L的密闭容器中进行反应:4A+5B4C+6D,30 s后C的物质的量增加了0.30 mol。则下列有关叙述正确的是( )
A.反应开始至30 s,v(A)=0.010 mol·L-1·s-1
B.30 s时容器中D的物质的量至少为0.45 mol
C.30 s时容器中A、B、C、D的物质的量之比一定是4∶5∶4∶6
D.反应开始至30 s,容器中A的物质的量增加了0.30 mol
答案 B
解析 由题给信息可得v(C)==0.002 mol·L-1·s-1,根据化学反应速率之比等于相应物质的化学计量数之比,可知v(A)=0.002 mol·L-1·s-1,A项错误;由于C的物质的量增加了0.30 mol,所以D的物质的量增加了0.30 mol×=0.45 mol,B项正确;因初始量没给,30 s时容器中A、B、C、D的物质的量之比不一定等于相应物质的化学计量数之比,C项错误;反应开始至30 s,A的物质的量减少了0.30 mol,D项错误。
2. 下列叙述正确的是( )
A.电解质溶液导电的过程实际上就是电解的过程
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
C.粗铜精炼时,电解质溶液中铜离子浓度保持不变
D.铁与稀硫酸反应时,加入过量硫酸铜溶液,可使反应速率加快
答案 A
解析 氢氧燃料电池的负极发生失去电子的氧化反应,氢气放电,B错误;粗铜精炼时,阳极是粗铜,粗铜中的杂质也会失去电子,而阴极始终是铜离子放电,因此电解质溶液中铜离子浓度降低,C错误;铁与稀硫酸反应时,加入过量硫酸铜溶液,铁全部被铜离子氧化,不能生成氢气,D错误。
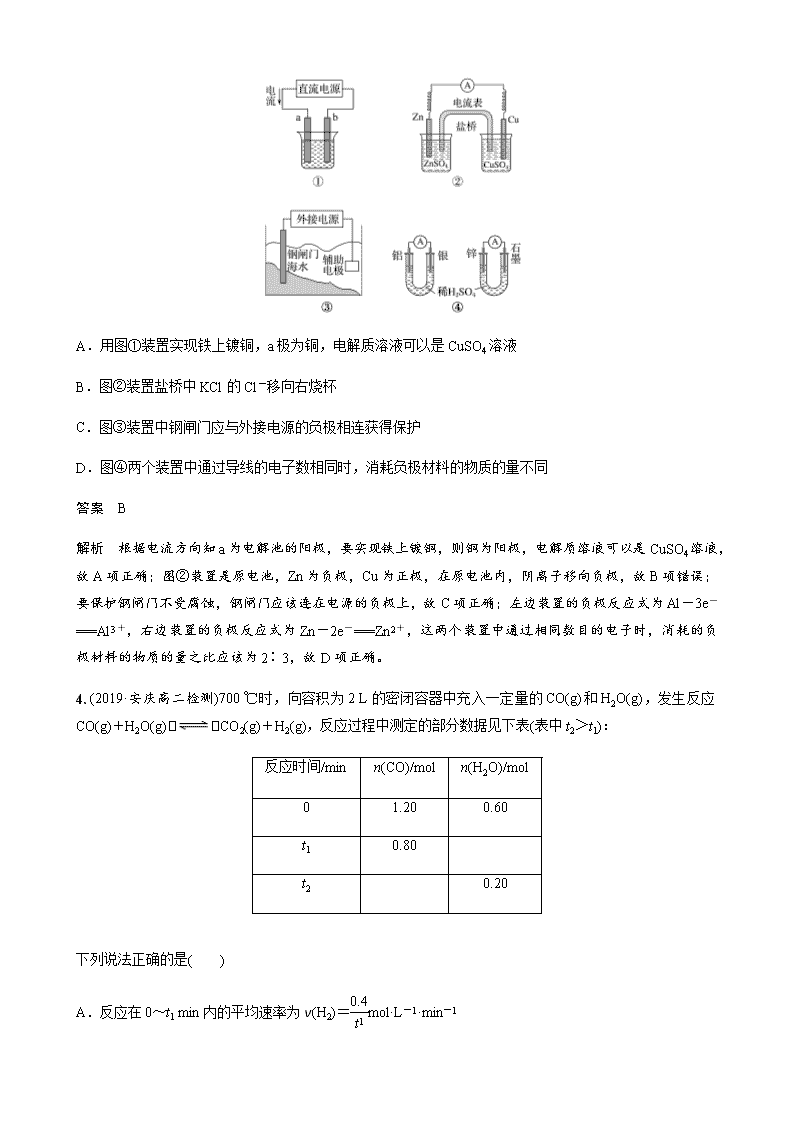
3 . 关于下列各装置图的叙述不正确的是( )
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
答案 B
解析 根据电流方向知a为电解池的阳极,要实现铁上镀铜,则铜为阳极,电解质溶液可以是CuSO4溶液,故A项正确;图②装置是原电池,Zn为负极,Cu为正极,在原电池内,阴离子移向负极,故B项错误;要保护钢闸门不受腐蚀,钢闸门应该连在电源的负极上,故C项正确;左边装置的负极反应式为Al-3e-===Al3+,右边装置的负极反应式为Zn-2e-===Zn2+,这两个装置中通过相同数目的电子时,消耗的负极材料的物质的量之比应该为2∶3,故D项正确。
4. (2019·安庆高二检测)700 ℃时,向容积为2 L的密闭容器中充入一定量的CO(g)和H2O(g),发生反应CO(g)+H2O(g)CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min
n(CO)/mol
n(H2O)/mol
0
1.20
0.60
t1
0.80
t2
0.20
下列说法正确的是( )
A.反应在0~t1 min内的平均速率为v(H2)=mol·L-1·min-1
B.若800 ℃时该反应的平衡常数为0.64,则正反应为吸热反应
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g)和0.40 mol H2(g),则v正>v逆
D.保持其他条件不变,起始时向容器中充入0.60 mol CO(g)和1.20 mol H2O(g),达到平衡时n(CO2)=0.40 mol
答案 D
5. 常温下,下列四种溶液中,水的电离程度最大的是( )
A.pH=5的NH4Cl溶液
B.pH=5的NaHSO4溶液
C.pH=8的CH3COONa溶液
D.pH=8的NaOH溶液
答案 A
解析 B、D选项抑制水的电离,A、C选项促进水的电离,A中水电离出的c(H+)=10-5 mol·
L-1,C中水电离出的c(OH-)=10-6 mol·L-1,A中数值大,水的电离程度大。
6. 在25 ℃某稀溶液中,由水电离产生的c(H+)=10-13 mol·L-1。下列有关该溶液的叙述正确的是( )
A.该溶液一定呈酸性 B.该溶液一定呈碱性
C.该溶液的pH一定为1 D.该溶液的pH可能为13
答案 D
解析 根据水的离子积常数,可知由水电离出的c(H+)=c(OH-)=10-13 mol·L-1,这是由于在水中加酸或碱,抑制了水的电离。若水中加酸,溶液呈酸性,则溶液中OH-只来自水的电离,c(H+)水=c(OH-)水=c(OH-)总=10-13 mol·L-1,由Kw=c(H+)总·c(OH-)总得:c(H+)总= mol·L-1=10-1 mol·L-1,pH=1;若水中加碱,溶液呈碱性,则溶液中H+只来自水的电离,c(H+)总=c(H+)水=10-13 mol·L-1,pH=13。
7. 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
答案 D
解析 稀释前,两种溶液的导电能力相同,所以溶液中离子浓度相同,醋酸是弱电解质,所以醋酸的浓度大于盐酸的浓度,A项错误。导电能力越强,氢离子浓度越大,而溶液的pH越小,大小顺序应为b>a>c,B项错误。温度不变,水的离子积常数不变,C项错误。
8. 今有室温下四种溶液,下列有关叙述不正确的是( )
序号
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
A.③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.V1 L ④与V2 L ①溶液混合后,若混合后溶液pH=7,则V1
c(OH-),正确;C项,分别加水稀释10倍,假设平衡不移动,那么①、②
溶液的pH均为10,但稀释氨水使平衡NH3·H2ONH+OH-右移,使①pH>10,同理醋酸稀释后pH<4,正确;D项,假设是强酸和强碱,混合后溶液呈中性,V1=V2,但①氨水是弱碱,其浓度远远大于④盐酸,所以需要氨水的体积少,即V1>V2,D错误。
9. 下列有关电解质溶液的说法正确的是( )
A.将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干均得不到原溶液
B.保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解
C.室温下,向0.1 mol·L-1的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
答案 A
解析 Ca(ClO)2在水中会水解:Ca(ClO)2+2H2OCa(OH)2+2HClO,HClO不稳定,受热会分解:2HClO2HCl+O2↑,生成的HCl会和Ca(OH)2反应生成CaCl2和H2O,故加热蒸干Ca(ClO)2溶液得到的固体是CaCl2;加热Na2SO3溶液的过程中,2Na2SO3+O2===2Na2SO4,蒸干会得到Na2SO4固体;加热FeCl3溶液:FeCl3+3H2OFe(OH)3+3HCl,HCl挥发,故加热蒸干会得到Fe(OH)3固体,A项正确;保存氯化亚铁溶液时,在溶液中放少量铁粉,可防止Fe2+被氧化为Fe3+,B项错误;水溶液显碱性的物质不一定是碱,如强碱弱酸盐CH3COONa,其水溶液显碱性,CH3COOH溶液中加入少量CH3COONa,CH3COO-浓度增大,会抑制CH3COOH的电离,CH3COOH的电离程度减小,C项错误;CH3COONH4是能发生双水解的盐,CH3COO-、NH的水解均会促进水的电离,溶液中水的电离程度较大,但溶液中的H+浓度与OH-浓度相等,故溶液呈中性,D项错误。
10. 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿。下列叙述正确的是( )
A.锌片上有气泡,铜片溶解
B.锌片发生还原反应
C.电子都是从铜片经外电路流向锌片
D.该装置至少有两种形式的能量转换
答案 D
解析 锌、铜、稀硫酸构成原电池,锌为负极,铜为正极,正极上生成氢气,故A错误;锌为负极,发生氧化反应,故B错误;电子从锌极经外电路流向铜极,故C错误;该装置存在电能与化学能、电能与光能的转化,故D正确。
二、填空题(共70分)
11.(10分)常温下,有四种溶液:
①0.1 mol·L-1CH3COOH溶液 ②0.1 mol·L-1CH3COONa溶液
③0.1 mol·L-1NaHSO3溶液④0.1 mol·L-1NaHCO3溶液
(1)溶液①的pH________(填“>”“<”或“=”)7,溶液中离子的电荷守恒的关系式是________________________________________________________________________。
(2)溶液②呈________(填“酸”“碱”或“中”)性。其原因是_________________
(3)下列有关①和②两种溶液的说法正确的是________(填字母)。
a.两种溶液中c(CH3COO-)都等于0.1 mol·L-1b.两种溶液中c(CH3COO-)都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-)小于CH3COONa溶液中c(CH3COO-)
(4)NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(H2SO3)__________ c(SO)_(填“>”“<”或“=”,下同),NaHCO3溶液中c(H2CO3)________c(CO)。
答案(1)< c(H+)=c(CH3COO-)+c(OH-)
(2)碱 CH3COO-+H2OCH3COOH+OH-,CH3COO-水解显碱性 (3)bc (4)< >
12.(4分)已知在一恒容密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g) ΔH=-196.0 kJ·mol-1。
SO2的平衡转化率与温度、压强的关系如下图所示:
根据图示回答(1)压强:p1________(填“>”“=”或“<”)p2。
(2)升高温度,平衡向_______(填“左”或“右”)移动。
答案:小于 左
13.(16分)氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
请参照下表给出的数据填空。
(1)操作I加入X的目的是___________________________ 。
(2)下列物质都可以作为X,适合本实验的X物质可以是_________(填字母)
A.KMnO4B.NaClOC.H2O2D.Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)__________________________________________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法______________________________________________。
【答案】(1)加入氧化剂,使Fe2+氧化为Fe3+
(2)CD
(3)CuO 3.7~4.7
(4)盐酸 Cu2+水解:Cu2++2H2OCu(OH)2+2H+,加入盐酸抑制其水解
(5)CuO HCl气流中蒸发
14.(10分)常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示。
(1)滴定醋酸的曲线是(填“1”或“2”),判断的理由是。
(2)a=mL。
(3)点E所示溶液pH>7,用离子方程式表示其原因。
(4)D点所示溶液中离子浓度由大到小的顺序为。
(5)下列说法正确的是( )
A.图1滴定过程中宜选用酚酞作指示剂
B.点F所示溶液中:c(CH3COO-)>c(CH3COOH)
C.点F、D、E所示溶液中:水的电离程度最大的是点D
D.滴定过程中可能出现: c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
15.(14分)应用电化学原理,回答下列问题:
(1)上述三个装置中,负极反应物化学性质上的共同特点是_________。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是________。
(3)乙中正极反应式为________;若将H2换成CH4,则负极反应式为_______。
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池______极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① 实验ⅰ中银作______极。
② 综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是______。
【答案】 (1). 失电子被氧化,具有还原性 (2). 钾离子移向硫酸铜溶液、氯离子移向硫酸锌溶液 (3). O2+4e-+2H2O=4OH- (4). CH4-8e-+10OH-=CO32-+7H2O (5). 负 (6). 正
(7). Fe2++Ag+Fe3++Ag
16、(14分)发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的ΔH__________(填“增大”、“减小”或“不变”),判断的理由是__________。
(2)CO2制备甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如下图所示。
①该反应化学平衡常数K的表达式是__________。
②0~9min时间内,该反应的平均反应速率v(H2)=__________。
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是__________(填字母序号)kJ。
a.0L2 温度一定时,增大压强,CO2平衡转化率增大
(3)①a
②CO2+6H++6e-===CH3OH+H2O