- 2021-05-09 发布 |
- 37.5 KB |
- 23页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
初中化学真题汇编溶液
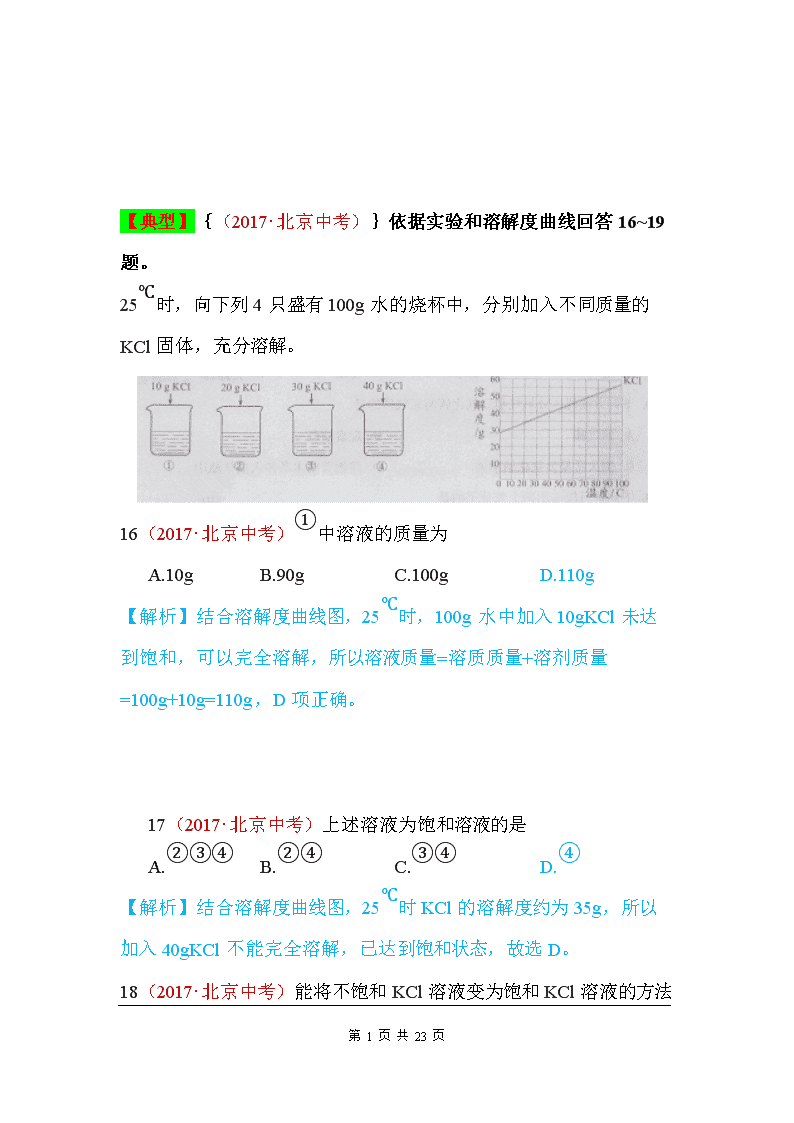
【典型】{(2017·北京中考)}依据实验和溶解度曲线回答16~19题。 25℃时,向下列4只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。 16(2017·北京中考)①中溶液的质量为 A.10g B.90g C.100g D.110g 【解析】结合溶解度曲线图,25℃时,100g水中加入10gKCl未达到饱和,可以完全溶解,所以溶液质量=溶质质量+溶剂质量=100g+10g=110g,D项正确。 17(2017·北京中考)上述溶液为饱和溶液的是 A.②③④ B.②④ C.③④ D.④ 【解析】结合溶解度曲线图,25℃时KCl的溶解度约为35g,所以加入40gKCl不能完全溶解,已达到饱和状态,故选D。 18(2017·北京中考) 第 23 页 共 23 页 能将不饱和KCl溶液变为饱和KCl溶液的方法是 A.升高温度 B.加水 C.加KCl固体 D.倒出部分溶液 【解析】结合溶解度曲线图,KCl的溶解度随温度升高而增大,由不饱和状态向饱和状态转化,可以通过降低温度,蒸发溶剂,或增加溶质,故选C。 19(2017·北京中考)④中溶液的溶质质量分数约为 A.26% B.29% C.35% D.40% 【解析】溶液的溶质质量分数=,结合溶解度曲线,25℃时,100g水中最多能溶解的KCl质量约为35g,由溶质质量分数计算式,计算可得质量分数约为26%。 8(2017·天水中考)甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( ) A.t1℃时,甲、乙两物质的溶解度相等 B.乙物质的溶解度大于甲物质的溶解度 C.t2℃时,乙物质的饱和溶液降温至t1℃,乙溶液变为不饱和溶液 第 23 页 共 23 页 D.t2℃时,30g甲物质能溶解于50g水中形成80g的溶液 【解答】解:A、通过分析溶解度曲线可知,t1℃时,甲、乙两物质的溶解度相等,故A正确; B、在比较物质的溶解度时,需要指明温度,故B错误; C、乙物质的溶解度随温度的降低而减小,所以t2℃时,乙物质的饱和溶液降温至t1℃,乙溶液仍为饱和溶液,故C错误; D、t2℃时,甲物质的溶解度是50g,所以30g甲物质能溶解于50g水中形成75g的溶液,故D错误. 故选:A. 28(2017·兰州中考)甲、乙两种固体物质的溶解度曲线如图所示,请回答问题: (1)t1℃时,甲、乙两种物质的溶解度大小关系为甲 < 乙(填“<”“>“或“=”); (2)P点的含义 t3℃时甲乙两物质的溶解度相等 ; (3)t2℃时,把20g固体甲放入50g水中,充分搅拌,所得溶液的质量是 62.5 g; (4)欲将t2℃时乙物质的不饱和溶液变为该温度下的饱和溶液,可采取的一种方法是 增加溶质或蒸发溶剂 ; (5)如采甲物质中含有少量乙物质,若要提纯甲,一般采用 降温结晶 的方法. 【解答】解:(1)据图可以看出,t1℃时,甲、乙两种物质的溶解度为甲<乙,故填:<; 第 23 页 共 23 页 (2)据图可以看出,P点表示在t3℃时甲乙两物质的溶解度相等,故填:t3℃时甲乙两物质的溶解度相等; (3)t2℃时,甲的溶解度为25g,故把20g固体甲放入50g水中,充分搅拌,只能溶解12.5g,故所得溶液的质量是62.5g,故填:62.5; (4)要将t2℃时乙物质的不饱和溶液变为该温度下的饱和溶液,可采用增加溶质或蒸发溶剂的方法,故填:增加溶质或蒸发溶剂; (5)甲的溶解度随温度的升高而增加很大,故甲物质中含有少量乙物质,若要提纯甲,一般采用降温结晶的方法,故填:降温结晶. 13(2017·庆阳中考)(8分)右图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。 (1)t1 ℃时,将25 g丙加入到50 g水中充分溶解后所得溶液的质量为_______ g。 [来源:Z§xx§k.Com] (2)t2 ℃ 时,甲的溶解度_______(填“>”、“<”或“=”)乙的溶解度。 (3)甲中含有少量的乙,欲提纯甲应采用的方法是_________。 (4)将100 g 10%的甲溶液稀释到4%需加入______g 水。 (1)70 (2)= (3)降温结晶(或冷却热饱和溶液) (4)150 点拨:(1)t1 ℃时丙的溶解度为40 g,即25 g丙加入到50 g水中只能溶解20 g的丙,所以充分溶解后所得溶液的质量为20 g+50 g=70 g。(2)t2 ℃ 时,甲、乙的溶解度曲线相交于一点,所以甲的溶解度等于乙的溶解度。(3)甲的溶解度随温度变化较大,乙的溶解度随温度变化不大,所以甲中含有少量的乙,可以采用的提纯方法有降温结晶或冷却热饱和溶液法。(4)溶液稀释前后总质量不变,设稀释后溶液的质量为x,100 g×10% = x×4%,解得x=250 g,所以需要加入的水的质量为250 g-100 g=150 g。 【转化、制备】25(2017·扬州中考)某工厂以含有FeSO4和少量H2SO4 第 23 页 共 23 页 的废水为原料制备FeSO4•7H2O的步骤如下: ①调节废水pH;②过滤;③蒸发浓缩;④结晶池中结晶;⑤收集晶体,洗涤、干燥. (1)调节废水pH时,适宜加入 a .(填序号) a.Fe b.Cu c.Ca(OH)2 (2)实验室中,完成过滤操作需要的玻璃仪器有玻璃棒、 烧杯 和 漏斗 ,过滤和蒸发操作中玻璃棒的作用分别是 引流 、 搅拌 . (3)结晶池底部有一定坡度的主要目的是 便于收集晶体 . (4)用冰水洗涤FeSO4•7H2O晶体的目的是 减少晶体因溶解而损失 .低温干燥的目的是 防止受热晶体失去结晶水 . (5)结合如图,补充完整由硫酸亚铁溶液中结晶出FeSO4•4H2O的实验方案:蒸发浓缩, 结晶 ,过滤、洗涤、干燥. 故答案为: (1)a; (2)烧杯; 漏斗; 引流; 搅拌. (3)便于收集晶体. (4)减少晶体因溶解而损失. 防止受热晶体失去结晶水. (5)结晶. 【双选】17(2017·扬州中考)物质甲与乙的溶解度曲线如图所示,下列说法一定正确的是( ) 第 23 页 共 23 页 A.常温下,乙易溶于水 B.甲溶液中溶质的质量分数比乙的大 C.从t2℃降至t1℃,甲溶液中有晶体析出 D.甲的溶解度受温度的影响程度比乙的大 【解答】解:A、乙物质在0℃时的溶解度是35.7g,乙物质的溶解度随温度的升高而增大,所以20℃时的溶解度也大于10g,属于易溶物质,故A正确; B、温度不确定,溶液的状态不能确定,所以甲、乙物质的溶质质量分数的大小也不能确定,故B错误; C、从t2℃降至t1℃,甲溶液的状态不能确定,所以不一定有晶体析出,故C错误; D、甲物质的溶解度曲线比乙物质的溶解度曲线陡,所以甲物质的溶解度受温度的影响程度比乙的大,故D正确. 故选:AD. 9(2017·乌鲁木齐中考)2017年4月22日,货运飞船“天舟一号”升入太空和“天宫二号”完成第一次交会对接.高氯酸钾(KClO4)可用作火箭推进剂,如表是高氯酸钾在不同温度时的溶解度.下列说法正确的是( ) 温度/℃ 20 40 60 80 溶解度/g 1.68 3.73 7.3 13.4 A.20℃时高氯酸钾的溶解度为1.68 B.40℃时,将4g高氯酸钾溶于100g水可得到104g溶液 C.80℃的高氯酸钾饱和溶液冷却至40℃有结晶现象 D.高氯酸钾的溶解度随温度升高而减小 第 23 页 共 23 页 【解答】解:A、溶解度的单位是克,20℃时高氯酸钾的溶解度为1.68g,故选项说法错误. B、40℃时,高氯酸钾的溶解度为3.73g,40℃时,将4g高氯酸钾溶于100g水,最多只能溶解3.73g,不能得到104g溶液,故选项说法错误. C、高氯酸钾在不同温度时的溶解度,高氯酸钾的溶解度随着温度的升高而增大,80℃的高氯酸钾饱和溶液冷却至40℃,有晶体析出,有结晶现象,故选项说法正确. D、由高氯酸钾在不同温度时的溶解度,高氯酸钾的溶解度随着温度的升高而增大,故选项说法错误. 故选:C. 3(2017·杭州中考)硫酸镁在工农业以及医疗上有广泛应用,其溶解度如表所示.则下列说法正确的是 ( ) 温度/℃ 10 30 50 70 90 溶解度/g 27.7 39.3 49.0 54.1 51.1 A.硫酸镁的溶解度随温度升高而增大 B.10℃时,27.7g硫酸镁和72.3g水可配制成质量分数为27.7%的硫酸镁溶液 C.50℃时,100g的硫酸镁饱和溶液中溶质和溶剂的质量比为49:100 D.70℃时的硫酸镁饱和溶液升温至90℃,溶液的溶质质量分数增大 【考点】7M:固体溶解度的影响因素;7T:溶质的质量分数、溶解性和溶 【解答】解:A、由硫酸镁在不同温度下的溶解度数据,可以看出10℃~70℃时,硫酸镁的溶解度随温度升高而增大,大于70℃时,硫酸镁的溶解度随温度升高而减小,故选项说法错误. B、10℃时,硫酸镁的溶解度为27.7g,10℃时,100g水中最多溶解27.7g硫酸镁固体,10℃时,72.3g水最多能溶解的硫酸镁的质量小于27.7g,则形成溶液的溶质质量分数小于27.7%,故选项说法错误. C、50℃时,硫酸镁的溶解度为49.0g,50℃时,100g水中最多溶解49.0g硫酸镁固体,该温度下硫酸镁饱和溶液中溶质和溶剂的质量比为49.0g:100g=49:100,故选项说法正确. 第 23 页 共 23 页 D、70℃时的硫酸镁饱和溶液升温至90℃,硫酸镁的溶解度减小,饱和溶液中溶质质量分数=×100%,则溶液的溶质质量分数减小,故选项说法错误. 故选:C. 11(2017·东营中考)我市东临渤海,有着丰富的海洋资源,请思考下列问题 (1)已知东营盐场测得:①海水中含NaCl约为3.5%;②在海边打深井,井水中含NaCl约为8%.晒盐最好用 ② (填序号)作原料. (2)关于晒盐原理的说法正确的是 A . A、利用阳光和风力,使水分蒸发,析出盐 B、日光照晒后,氯化钠的溶解度变小 (3)海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的KCl、MgCl2、MgSO4等物质可作为重要的化工原料,它们的溶解度曲线如图所示. ①60℃时,将50g;硫酸镁加入到100g水中,充分搅拌,所得溶液的溶质质量分数为 33.3% ,若使其形成饱和溶液,可采取的措施有 ABCD . A、增加溶质 B、蒸发溶剂 C、升高温度 D、降低温度 ②对卤水中含有的KCl、MgCl2、MgSO4三种物质,下列说法正确的是 AC . A、三种物质均为易溶物质 B、20℃时,向40gKCl固体和40gMgCl2固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态. C、60℃时,三种物质溶于水形成的溶液浓度可能相等. 第 23 页 共 23 页 (3)①由溶解度曲线可知,海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的KCl、MgCl2、MgSO4等物质可作为重要的化工原料,它们的溶解度曲线如图所示. ①60℃时,硫酸镁的溶解度大于50g,所以在该温度下将50g硫酸镁加入到100g水中,充分搅拌,完全溶解,所得溶液的溶质质量分数为,60℃时,硫酸镁的溶解度最大,若升温或降温,溶解度都会变小,所以可以采取升温或降温的方法使之转化为饱和溶液,也可以通过加溶质或蒸发溶剂的方法使之饱和;故填:33.3%;ABCD; ②A.由溶解度曲线可知,在20℃时,三者的溶解度均大于10g,所以均属于易溶于水的物质,故正确; B.由溶解度曲线可知,20℃时硫酸镁的溶解度小于40g,而氯化钾的溶解度大于40g,所以20℃时,向40gKCl固体和40gMgCl2固体中分别加入100g水充分溶解后,硫酸镁能形成饱和溶液,而氯化钾形成的是不饱和溶液,故错误; C.60℃时,三种物质溶于水形成的溶液浓度可能相等,故正确. 故选AC. 12(2017·菏泽中考)20℃时,将等质量的甲、乙两种固体分别加入盛有100g水的烧杯中,充分搅拌后现象如图1所示,甲、乙两物质的溶解度曲线如图2所示.请回答下列问题: 第 23 页 共 23 页 (1)图l中一定为饱和溶液的是 甲 溶液(填“甲”或“乙”) (2)图2中P点表示的意义 30℃时,甲、乙两种固体物质的溶解度相等 . 17(2017·南京中考)溶液在生产、生活中起着十分重要的作用.请回答下列问题: (1)可以作为溶质的是 D . A.只有固体 B.只有液体 C.只有气体 D.气体、液体、固体都可以 (2)配制100g质量分数为16%的氯化钠溶液,所需氯化钠的质量为 16g ,水的体积为 84 mL (水的密度近似看作1g/cm3). (3)甲、乙两种不含结晶水的固体物质的溶解度曲线如图1.t1℃时,甲物质的溶解度是 40g .t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是 乙 (填“甲”或“乙”)物质的饱和溶液. (4)按图2所示装置,将液体X注入装有固体y的试管中,会导致U形管中右端液面升高.则可能的组合是 AD . 选项 x y 第 23 页 共 23 页 A 水 氧化钙 B 水 硝酸铵 C 浓硫酸 水 D 稀盐酸 镁 20(2017·绥化中考)图1为甲、乙两种物质(均不含结晶水)的溶解度曲线图。请回答下列问题。 (1)在10℃时,甲的溶解度 乙的溶解度,(选填“>”“<”或“=”) (2)在20℃时,向盛有50g水的烧杯中加入25g甲物质,充分搅拌后溶液质量是 g。 (3)取乙进行如图实验,属于饱和溶液的是 ,溶质质量分数最大的是 。(选填字母序号) 20. (1) > (2) 70 (3) AC; B 19(2017·齐齐哈尔中考)右图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题: (1)A点的含义是_____________________。 (2)在30℃ 第 23 页 共 23 页 时,向30克甲物质中加入50克水,充分溶解后所得溶液是____________溶液(填“饱和”或“不饱和”)。 (3)若乙中混有少量甲,最好采用_________的方法提纯乙(填“降温结晶”或“蒸发结晶”)。 (4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_________________。 19、(1)20℃时,曱乙两种物质的溶解度相等 (2)饱和 (3)蒸发结晶 (4)丙 25(2017·龙东地区中考)如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题: ⑴P点含义__________________; ⑵t2℃时,将15g A物质放入50g水中,充分溶解后,形成溶液的质量为____g; ⑶若A物质中含有少量的B物质,提纯A物质的方法是_____;(填“降温结晶”或“蒸发结晶”) (4) t3℃时,将A、B、C三种物质的饱和溶液降温到t1℃,三种溶液中溶质的质量分数由大到小的顺序为___________。 25、⑴t1℃时,A、C两物质的溶解度相等 (2)60 ⑶降温结晶 (4) B>A>C(或B A C) 13(2017·哈尔滨中考)甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法错误的是( ) 第 23 页 共 23 页 A.t2℃时,将甲、乙的两种饱和溶液分别降温到t1℃,所得溶液都是 饱和溶液 B.t1℃时,向50g水中加入甲可得80g饱和溶液,则乙在该温度下的 溶解度为60g C.甲中混有少量乙时,可用降温结晶的方法提纯甲 D.t2℃时,将等质量的甲、乙两种溶液分别降温到0℃,甲溶液的溶质 质量分数一定小于乙溶液的溶质质量分数 18(2017·上海中考)某物质的容解度曲线如图,40℃时将60g该物质放入100g水中充分搅拌溶解,有关判断正确的是( ) A.40℃时形成160g溶液 B.若降温至20℃,溶质质量减少 C.若升温至60℃,溶质质量分数不变 D.若升温至80℃,溶液是饱和溶液 【解答】解:A、通过分析溶解度曲线可知,40℃时,该物质的溶解度小于60g,所以不能形成160g溶液,故A错误; B、该物质的溶解度随温度的降低而增大,所以降温至20℃,溶质质量增大,故B错误; C、该物质的溶解度随温度的降低而增大,所以升温至60℃,溶质质量分数减小,故C错误; D、80℃时,该物质的溶解度小于60g,所以升温至80℃,溶液是饱和溶液,故D正确. 故选:D. 第 23 页 共 23 页 18(2017·河南中考)右图是甲、乙两种固体的溶解度曲线。将t3℃时相同质量的甲、乙两种物质的饱和溶液降温到t1℃,只有甲的溶液中有固体析出。则乙的溶解度曲线为_______(先填“X”或“Y”);甲和乙的溶解度相等时的温度为_______;t3℃时,将30 g 甲的饱和溶液稀释为质量分数为10%的溶液,需加水的质量为________g。xkb1.com 18.Y t2℃ 70 9(2017·三明中考)右图是甲、乙两种固休物质的溶解度曲线。下列说法错误的是 A. t1℃时,25g甲充分溶解于100g水中,配得甲的饱和溶液 B. t2℃时,甲、乙饱和溶液的溶质质量分数相等 C.若甲中含有少量乙,可用溶解、过滤的方法提纯甲 D.将甲的饱和溶液从t2℃ 降温到t1℃,可析出晶体 17(2017·玉林中考)右图是KNO3和NaCl在水中的溶解度曲线,下列说法正确的是 A. 20℃时,KNO3的溶解度是30 第 23 页 共 23 页 B.当KNO3的溶解度大于NaCl的溶解度 C.当KNO3中含有少量NaCl时,可以通过冷却热饱和溶液的方法提纯KNO3 D.将30℃时KNO3的饱和溶液和NaCl的饱和溶液同时降温至24℃,此时所得溶液中NaCl的质量分数大于KNO3的质量分数 15(2017·自贡中考)如表是不同温度时硝酸钾的溶解度,有关说法正确的是( ) 温度/℃ 0 20 40 60 80 100 溶解度/克 13.3 31.6 63.9 110 169 246 A.20℃时,100克水中溶解的硝酸钾越多溶解度就越大 B.40℃时,100克硝酸钾饱和溶液中含有硝酸钾63.9克 C.100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多 D.0℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小 【解答】解:A、20℃时,硝酸钾的溶解度是一定的,是100克水中最多溶解的质量,不是溶解的硝酸钾越多溶解度就越大,故A错误; B、40℃时,163.9克硝酸钾饱和溶液中含有硝酸钾63.9克.故B错误; C、100℃的水能溶解的硝酸钾不一定比80℃的水能溶解的硝酸钾多,因为没有说明水的质量,故C错误; D、0℃的硝酸钾的溶解度比60℃的硝酸钾的溶解度小,因此0℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小,故D正确. 故选D. 10(2017·遂宁中考)右图为甲、乙两种固体物质的溶解度曲线图,请据图回答下列问题: 第 23 页 共 23 页 (1)t2℃时,甲、乙两种物质饱和溶液中溶质质量分数的大小关系为:甲_____乙(填‘‘>”、‘‘<”或“=’’)。 (2)要从乙的饱和溶液中获得较多晶体,宜采用的结晶方法是_______结晶。 (3)t1℃时,取等质量的甲、乙两种固体分别配成饱和溶液,需水质量较多的是_____(填“甲”或“乙”)。 13(2017·南充中考)根据如图中甲、乙、丙三种固体物质的溶解度曲线,回答下列问题. (1)温度为 t2 ℃时,甲、乙物质的溶解度相等. (2)甲、乙、丙三种物质中, 乙 的溶解度受温度影响最小. (3)分别将100g甲、丙的饱和溶液从t3℃降温到t1℃时,对所得溶液的叙述正确的 D (填序号) A.甲、丙都是饱和溶液 B.所含溶剂质量:甲=丙 C.溶液的质量:甲>丙 D.溶质的质量分数:甲>丙. 【解答】解:(1)由溶解度曲线可知:当t2℃时,甲、乙物质的溶解度相等;故答案为:t2; 第 23 页 共 23 页 (2)甲、乙、丙三种物质中,乙的溶解度受温度影响最小;故答案为:乙; (3)分别将100g甲、丙的饱和溶液从t3℃降温到t1℃时,溶质的质量分数:甲>丙;甲、丙都是饱和溶液错误,因为丙变为不饱和;所含溶剂质量:甲<丙,甲=丙是错误的;溶液的质量:甲<丙,甲>丙是错误的,因为甲有固体析出;故答案为:D; P27 T4 (2017·襄阳中考)甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示。 (1) ℃时,甲的溶解度为20g; (2)t2℃时将甲、乙、丙三种物质的饱和溶液各取100g,分别降温到t1℃时,所得溶液中溶剂的质量由大到小依次为 。 【新题】15(2017·泸州中考)课堂上老师对探究干电池原理的实验进行如下改进. 图甲:把一块锌片和一根碳棒同时插入盛有稀硫酸的U型管中; 图乙:用导线将锌片和碳棒连接起来插入盛有稀硫酸的U型管中,并在导线中间连接一只灵敏电流计. 请按要求回答问题: (1)甲主要的能量转化形式是 化学能转化为热能 . (2)乙观察到与甲不同的现象是 电流计指针偏转 、 碳棒上有气泡冒出 . 第 23 页 共 23 页 (3)配制所需硫酸:现有98%的浓硫酸18g(体积为9.8mL),可将其配成24.5%的硫酸溶液 72 g,配制的具体操作过程是 量取9.8mL浓硫酸慢慢沿烧杯壁倒入盛有54g水的烧杯中,且用玻璃棒不停搅拌 . (4)取(3)所配24.5%的硫酸溶液20g,向其中滴加25%的Ba(OH)2溶液至恰好完全反应. ①请计算产生沉淀的质量 11.65 g,写出必要的计算过程. ②沉淀过滤后水的质量是 42.55 g. 8(2017·泸州中考)溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是( ) A.升高温度溴酸银的溶解度增大 B.40℃时溴酸银易溶于水 C.90℃时溴酸银溶液的溶质质量分数一定小于1.3% D.溴酸银可用降温结晶的方法从溶液中析出 【解答】解:A、通过分析溶解度曲线可知,溴酸银的溶解度随温度的升高而增大,故A正确; B、通过分析溶解度曲线可知,40℃时,溴酸银的溶解度是0.3g,在0.01g﹣1g之间,所以溴酸银微溶于水,故B错误; C、90℃时溴酸银的溶解度是1.3g,所以饱和溴酸银溶液的溶质质量分数为: 第 23 页 共 23 页 ×100%=1.28%,所以90℃时溴酸银溶液的溶质质量分一定小于1.3%,故C正确; D、溴酸银的溶解度受温度影响变化较大,所以溴酸银可用降温结晶的方法从溶液中析出,故D正确. 故选:B. 11(2017·达州中考)(4分)如图所示为X、Y、Z三种固体物质(不含结晶水)的溶解度曲线,请回答下列问题: ⑴X中含有少量Y,应采用 的方法提纯X。 ⑵t2℃时,三种物质的溶解度的大小关系是 。 ⑶t3℃时,溶质质量分数为25%的X溶液降温到t1℃,所得溶液中溶质质量分数是 。 ⑷t3℃时,等质量X、Y、Z的饱和溶液分别降温到t1℃,溶液质量没有变化的是 。 11、(4分) ⑴降温结晶 ⑵Y>X=Z ⑶20% ⑷Z (2017·成都中考) 第 23 页 共 23 页 20(2017·娄底中考)分析处理图表信息是学习的一种重要方法,如表是氯化钠和硝酸钾在不同温度下的溶解度. 温度/℃ 20 40 60 80 溶解度/g NaCl 36.0 36.6 37.3 38.4 KNO3 31.6 63.9 110 169 这两种固体物质在水中的溶解度曲线如图所示: 请仔细阅读图表后回到下列问题: (1)A曲线表示的是 KNO3 的溶解度曲线.(填“NaCl”或“KNO3”) (2)P点的含义是 在t1℃时,氯化钠和硝酸钾的溶解度相等 . (3)t2℃时,将等质量的A和B的饱和溶液降温至t1℃,所得溶液的质量分数关系是A = B.(填“<”、“>”或“=”) 【解答】解:(1)由表格信息可知:A曲线表示的是KNO3的溶解度曲线;故答案为:KNO3; (2)P点的含义是:在t1℃时,氯化钠和硝酸钾的溶解度相等,因为它们在该温度下有交点;故答案为:在t1℃时,氯化钠和硝酸钾的溶解度相等; (3)t2℃时,将等质量的A和B的饱和溶液降温至t1℃,所得溶液的质量分数关系是A等于B,因为降温后A、B的溶解度相等;故答案为:=; 第 23 页 共 23 页 6(2017·孝感中考)甲、乙两种固体物质(均不含结晶水)的溶解度曲线如右图所示。下列说法正确的是 A. t1℃时,甲的溶解度大于乙的溶解度 B.t2℃时,乙的饱和溶液升温或降温均会析出晶体 C.乙溶液从t3℃降温到t1℃,乙溶液中的溶质质量分数会发生改变 D. t3℃时,50g水中加入40g的甲物质充分溶解可得到90g甲的饱和溶液 4(2017·随州中考)如图,是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( ) A.20℃时,甲、乙两种固体物质的溶解度都是30 B.40℃时,甲的饱和溶液中溶质质量分数为50% C.40℃时,将50g乙物质全部溶于水中,恰好能得到150g乙的饱和溶液 D.将130g20℃甲的饱和溶液升温到40℃,最多还能溶解甲物质20g 【解答】解:A、通过分析溶解度曲线可知,20℃时,甲、乙两种固体物质的溶解度都是30g,故A错误; B、40℃时,甲物质的溶解度是50g,所以甲的饱和溶液中溶质质量分数为:×100%=33.3%,故B错误; C、40℃时,乙物质的溶解度是40g,所以将50g乙物质全部溶于水中,恰好能得到140g乙的饱和溶液,故C错误; 第 23 页 共 23 页 D、40℃时,甲物质的溶解度是50g,所以将130g20℃甲的饱和溶液升温到40℃,最多还能溶解甲物质20g,故D正确. 故选:D. 39.(2017·鄂州中考)甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题: ( 1 ) 25℃时,将50g甲固体加入到100g水中,充分溶解并恢复到原温度后,得到溶液的质量为_____g。 (2)要使35℃时接近饱和的丙溶液变成该温度下的饱和溶液,可采用的一种方法是______。 (3)现有操作步骤:A.溶解;B.过滤;C.降温结晶;D.加热浓缩。若甲固体中含有少量乙,则提纯甲的操作步骤是_______。(填字母序号) (4)若将35℃时甲的饱和的溶液降温到变成25℃,则其溶液的溶质质量分数会______。(填字母序号) A.变大 B.变小 C.不变 39. (1)130 (2)加入丙物质(或蒸发溶剂) (3)ADCB (4)B (2017·黄石中考)水是生命之源,人类的日常生活和工农业生产都离不开水. (1)生活中常用 肥皂水 来区分硬水和软水; (2)小液滴分散到液体里形成的混合物叫做 乳浊液 ; (3)下列做法有利于节约水资源或减少水体污染的是 ①③ 第 23 页 共 23 页 (填序号,多选); ①农业和园林浇灌改为喷灌、滴灌②工业废水在接排入江河中 ③生活污水集中处理和排放④为提高农作物产量,大量使用化肥农药 (4)甲、乙、丙三种物质的溶解度曲线图如下所示: ①T3℃时,三种物质的溶解度由大到小的顺序是: 甲 > 乙 > 丙 (选填“甲”、“乙”“丙”); ② T2 (选填(“T1”、“T2”或“T3”)℃时,乙和丙的溶解度相等; ③T1℃时甲和丙的饱和溶液,升温到T2℃时仍然是饱和溶液的是 丙 (选填“甲”或“丙”). 第 23 页 共 23 页查看更多