化学键化学反应规律第二节化学反应与能量转化第1课时化学反应中能量变化的本质及转化形式同步练习鲁科版必修第二册
第1课时 化学反应中能量变化的本质及转化形式
课程标准
核心素养
1.认识物质具有能量,认识放热反应和吸热反应。
2.知道化学反应可以实现与其他能量形式的转化。
3.了解化学反应中能量变化的本质。
1.变化观念与平衡思想
认识化学反应中能量变化的本质。
2.宏观辨识与微观探析
能从宏观(反应物和生成物的总能量)和微观(化学键的断裂和形成)相结合的视角分析化学反应中能量的变化。
化学反应中的能量变化
1.化学反应中的能量变化
实验内容
实验现象
化学方程式及结论
NaOH
溶液与盐
酸反应
混合液的温度升高
化学方程式:NaOH+HCl===NaCl+H2O;
结论:反应释放能量
锌与盐酸
反应
有大量气泡产生,溶液温度升高
化学方程式:Zn+2HCl===ZnCl2+H2↑;
结论:反应释放能量
碳酸氢钠
与柠檬酸
反应
混合液的温度降低
结论:反应吸收能量
结论:每一个化学反应都伴随着能量的变化,有的反应释放能量,有的反应吸收能量。
2.化学反应的分类(从能量变化角度)
(1)放热反应:最终表现为释放热量的化学反应。
(2)吸热反应:最终表现为吸收热量的化学反应。
1.常见的放热反应
(1)所有的燃烧反应,如木炭、H2、CH4等在氧气中的燃烧,H2在Cl2中的燃烧。
(2)酸碱中和反应,如H++OH-===H2O。
(3)大多数的化合反应,如H2+Cl22HCl。
(4)铝热反应,如2Al+Fe2O3Al2O3+2Fe。
- 12 -
(5)活泼金属与酸或H2O的反应,如2Al+6H+===2Al3++3H2↑,2Na+2H2O===2Na++2OH-+H2↑。
2.常见的吸热反应
(1)消石灰[Ca(OH)2]与氯化铵固体的反应:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O。
(2)大多数的分解反应,如NH4ClHCl↑+NH3↑。
(3)碳与水蒸气的反应:C+H2O(g)CO+H2。
(4)部分以C、H2、CO为还原剂的氧化还原反应,如C+CO22CO。
吸热反应和放热反应均是化学反应。NaOH固体溶于水、浓H2SO4的稀释,属于放热过程,不属于放热反应;NH4NO3固体溶于水属于吸热过程,不属于吸热反应。
1.判断正误
(1)化学变化遵循质量守恒和能量守恒。( )
(2)有能量变化的过程一定发生了化学反应。( )
(3)化学反应中化学能只能转变为热能。( )
(4)需要点燃或加热才能发生的反应一定是吸热反应。( )
(5)电解水的过程是电能转化为热能。( )
答案:(1)√ (2)× (3)× (4)× (5)×
2.下列反应属于吸热反应的是( )
A.铝与CuCl2溶液反应
B.NaOH和HCl反应
C.NaOH与NH4Cl反应
D.甲烷燃烧
解析:选C。需要识记常见的放热反应和吸热反应。
3.下列反应中属于放热反应的是________,属于吸热反应的是________。
①煅烧石灰石制生石灰(CaO) ②燃烧木炭取暖 ③炸药爆炸 ④NaOH溶液与盐酸的反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败 ⑦硝酸铵溶于水
答案:②③④⑤⑥ ①
化学反应中能量变化的本质及转化形式
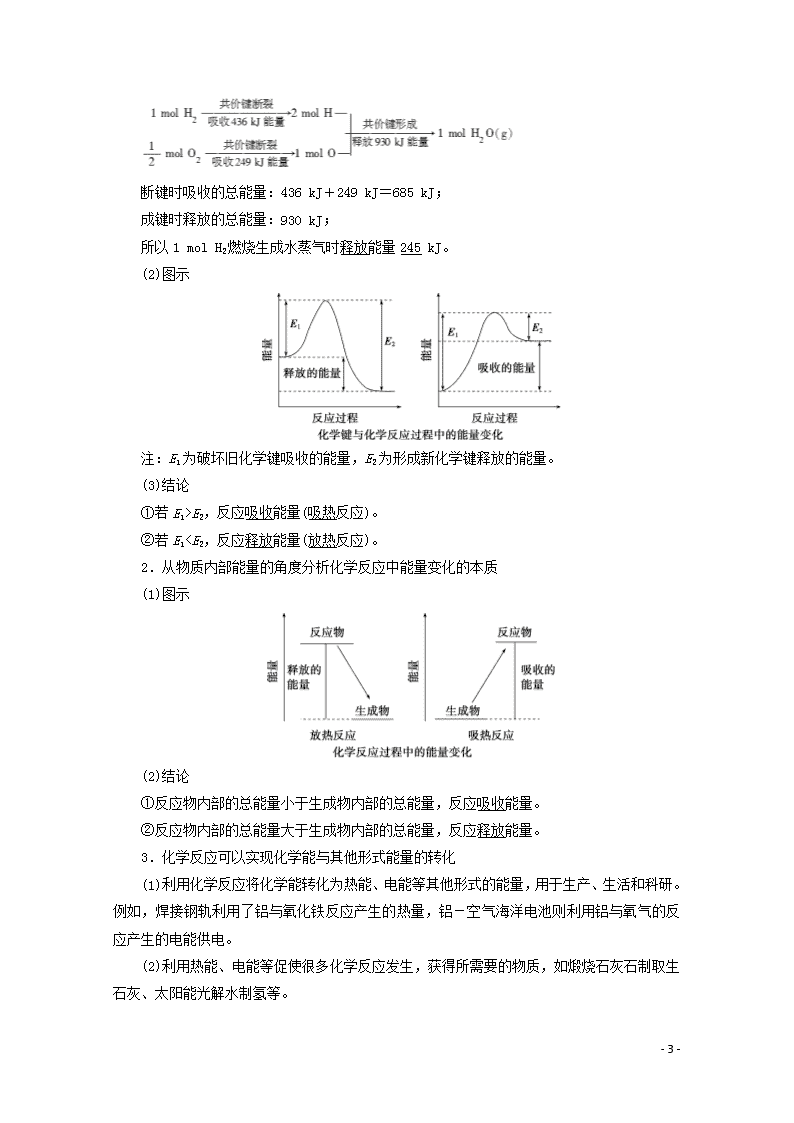
1.从化学键的角度分析化学反应中能量变化的本质
(1)实例分析
- 12 -
断键时吸收的总能量:436 kJ+249 kJ=685 kJ;
成键时释放的总能量:930 kJ;
所以1 mol H2燃烧生成水蒸气时释放能量245 kJ。
(2)图示
注:E1为破坏旧化学键吸收的能量,E2为形成新化学键释放的能量。
(3)结论
①若E1>E2,反应吸收能量(吸热反应)。
②若E1
”或“<”)生成物的总能量。
解析:(1)断裂旧化学键吸收的总能量应该是断裂1 mol H—H键与1 mol Cl—Cl键所吸收的能量之和,即436 kJ+243 kJ=679 kJ。(2)形成新化学键放出的总能量应该是形成2 mol H—Cl键所放出的能量,即2×431 kJ=862 kJ。(3)(4)
- 12 -
由于反应物断裂化学键吸收的总能量小于生成物形成化学键放出的总能量,因此H2+Cl22HCl是放热反应,即反应物的总能量大于生成物的总能量。
答案:(1)679 kJ (2)862 kJ (3)放热 (4)>
等级性测试
1.“摇摇冰”是一种即用即冷的饮料。吸食时,将饮料罐隔离层中的化学物质和水混合摇动即会制冷。根据你的经验判断,该化学物质是( )
A.氯化钠 B.固体氢氧化钠
C.固体硝酸铵 D.生石灰
解析:选C。考查化学物质和水混合时的能量变化问题。氯化钠溶于水的能量变化不明显;固体硝酸铵溶于水是吸热过程;固体氢氧化钠、生石灰溶于水是放热过程。
2.从宏观角度来看化学变化的本质是有新物质生成。从微观角度来看,下列变化不能说明发生了化学变化的是( )
A.变化时有电子的得失或偏移
B.变化过程中有化学键的断裂和形成
C.变化时释放出能量
D.变化前后原子的种类和数目没有改变,分子种类改变了
解析:选C。物质发生变化时有电子的得失或偏移,说明发生了氧化还原反应,A能说明;化学反应的过程就是原子重新组合的过程,所以变化过程中有化学键的断裂和形成,B能说明;物质的状态从气态到液态变化时也会释放出能量,但属于物理变化,C不能说明;化学反应的过程就是原子重新组合的过程,在这个过程中原子的种类和数目没有改变,分子种类可能增加,也可能减少,D能说明。
3.下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铁片与稀硫酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的焦炭与水蒸气的反应
D.镁条在氯气中燃烧
解析:选C。A项中铁片与稀硫酸的反应和D项中镁条在氯气中燃烧都是放热反应;B项中Ba(OH)2·8H2O和NH4Cl的反应是复分解反应,是非氧化还原反应;C项中灼热的焦炭与水蒸气的反应是吸热的氧化还原反应。
4.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
- 12 -
C.反应物的总能量高于生成物的总能量
D.反应的离子方程式为CO+2H+===H2O+CO2↑
解析:选B。根据醋酸逐渐凝固说明该反应是吸热反应,A、C错误,B正确;该反应的离子方程式为HCO+H+===H2O+CO2↑,D错误。
5.下列图示表示吸热反应的是( )
解析:选A。根据图像可知,反应物的总能量低于生成物的总能量,因此是吸热反应,A正确;根据图像可知,反应物的总能量高于生成物的总能量,因此是放热反应,B错误;浓硫酸稀释放热,属于物理变化,既不是吸热反应,也不是放热反应,C错误;锌与稀盐酸发生置换反应生成氯化锌和氢气,属于放热反应,D错误。
6.下列关于化学反应中能量变化的说法正确的是( )
A.化学反应中的能量变化,都表现为热能的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.已知Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)为放热反应,则反应物总能量<生成物总能量
D.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2
解析:选B。化学反应中的能量变化,不都表现为热能的变化,还可能有其他形式能量的变化,如光能等,故A项错误。放热反应中反应物总能量大于生成物总能量,故C项错误。原子结合成分子有新化学键形成,要放出热量,故2E1>E2,故D项错误。
7.反应A+B―→C(反应放热)分两步进行:①A+B―→X(反应吸热),②X―→C(反应放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )
- 12 -
解析:选D。根据吸热反应和放热反应与反应物总能量和生成物总能量的关系分析、判断。A+B―→C为放热反应,则A和B的能量之和大于C的能量,A、B选项错误;A+B―→X为吸热反应,则A和B的能量之和小于X的能量,C选项错误、D选项正确。
8.已知断裂1 mol H—H键吸收能量为436 kJ,形成1 mol H—N键放出能量为391 kJ,若1 mol N2和3 mol H2完全反应:N2+3H22NH3,放出的能量为92.4 kJ,则断裂1 mol NN键吸收的能量是( )
A.433.6 kJ B.945.6 kJ
C.649 kJ D.869 kJ
解析:选B。断键吸收能量为Q吸=E(NN)+3×436 kJ,成键放出能量为Q放=6×391 kJ,Q放-Q吸=92.4 kJ,即6×391 kJ-E(NN)-3×436 kJ=92.4 kJ,解得E(NN )=945.6 kJ。
9.化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):
P—P:198 P—O:360 O===O:497
若生成1 mol P4O6,则反应P4(白磷)+3O2===P4O6中的能量变化为( )
A.吸收1 641 kJ能量 B.放出1 641 kJ能量
C.吸收126 kJ能量 D.放出126 kJ能量
解析:选B。断键吸收的能量:6 mol P—P键为6×198 kJ,3 mol O===O键为3×497 kJ,共为2 679 kJ;成键放出的能量:12 mol P—O键为12×360 kJ=4 320 kJ;故反应放出的能量大于吸收的能量,放出的能量为4 320 kJ-2 679 kJ=1 641 kJ。
10.下表中的数据是破坏1 mol物质中的化学键所消耗的能量:
- 12 -
物质
Cl2
Br2
I2
HCl
HBr
HI
H2
能量/kJ
243
193
151
432
366
298
436
根据表中数据回答下列问题。
(1)下列氢化物中最稳定的是________。
A.HCl B.HBr C.HI
(2)H2+X2===2HX(X代表Cl、Br、I)是________(填“放热反应”或“吸热反应”)。
(3)在相同条件下,X2(X代表Cl、Br、I)分别与H2反应,当消耗的物质的量相同时,放出或吸收的能量最多的是________与H2的反应。
解析:(1)破坏1 mol HX中的化学键所消耗的能量越多,说明HX越稳定,由表中数据可判断氢化物中最稳定的为HCl。
(2)H2+X2===2HX(X代表Cl、Br、I),当有1 mol H2发生反应时,断裂旧化学键吸收的能量分别为(436+243) kJ=679 kJ、(436+193) kJ=629 kJ、(436+151) kJ=587 kJ,形成新化学键放出的能量分别为2×432 kJ=864 kJ、2×366 kJ=732 kJ、2×298 kJ=596 kJ,形成新化学键放出的能量均比断裂旧化学键吸收的能量多,因此都是放热反应。
(3)放出的能量分别是864 kJ-679 kJ=185 kJ、732 kJ-629 kJ=103 kJ、596 kJ-587 kJ=9 kJ,故Cl2与H2反应放出的能量最多。
答案:(1)A (2)放热反应 (3)Cl2
11.化学反应N2(g)+3H2(g)2NH3(g)的能量变化如图所示,请回答下列问题:
(1)图中A、C分别表示________________________________________________、
____________________________,反应________(填“吸收”或“放出”)能量。
(2)反应过程中断裂的化学键及其物质的量为____________________________________
________________________,________(填“吸收”或“放出”,下同)的能量为________(用E1、E2或E3表示,下同);形成的化学键及其物质的量为________________________________________________________________________
________,________的能量为________。
(3)E2=______或______。(用“A、C”或“E1、E3”表示)
解析:(1)A、C分别表示1 mol N2(g)和3 mol H2(g)(反应物)的总能量、2 mol NH3(g)(生成物)的总能量,由于反应物总能量高于生成物总能量,因此反应放出能量。(2)反应过程中断裂的化学键为1 mol N≡N键和3 mol H—H键,吸收的能量为E1;形成的化学键为6 mol
- 12 -
N—H 键,放出的能量为E3。
答案:(1)1 mol N2(g)和3 mol H2(g)(反应物)的总能量
2 mol NH3(g)(生成物)的总能量 放出
(2)1 mol N≡N键和3 mol H—H键 吸收 E1
6 mol N—H键 放出 E3
(3)A-C E3-E1
12.某同学设计如下三种实验方案以探究某反应是放热反应还是吸热反应。
方案一:如图甲,在小烧杯里放一些已除去氧化铝保护膜的铝片,然后向烧杯里加入10 mL 2 mol·L-1稀硫酸,再插入一支温度计,温度计的温度由20 ℃逐渐升至75 ℃,随后,温度逐渐下降至30 ℃,最终停留在20 ℃。
方案二:如图乙,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10 mL 2 mol·L-1硫酸溶液,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来。
方案三:如图丙,A试管中发生某化学反应,实验前U形管中的红墨水液面相平,在化学反应过程中,通过观察U形管两侧红墨水液面高低变化判断某反应是吸热反应还是放热反应。
项目
A试管里发
生反应的物质
U形管里红
墨水液面变化
①
氧化钙与水
左低右高
②
氢氧化钡晶体与氯化
铵晶体(充分搅拌)
?
③
铝片与烧碱溶液
左低右高
④
铜与浓硝酸
左低右高
根据上述实验回答相关问题:
(1)铝片与稀硫酸的反应是________(填“吸热”或“放热”)反应,写出该反应的离子方程式:________________________________________________________________________
________________________________________________________________________。
(2)方案一中,温度升至最大值后又下降的原因是______________________________
________________________________________________________________________。
(3)方案二中,小木片脱落的原因是__________________________________________
- 12 -
________________________________________________________________________,由此得出的结论是
________________________________________________________________________。
(4)方案三中,如果A试管里发生的反应是放热反应,则U形管中红墨水液面高度:左边________(填“高于”“低于”或“等于”)右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是________(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是____________________________
________________________________________________________________________。
(6)方案三实验②的U形管中的现象为______________________________________
________________________________________________________________________,
说明反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量。
解析:(1)金属与酸的反应是放热反应,因此铝片与稀硫酸的反应是放热反应,该反应的离子方程式为2Al+6H+===2Al3++3H2↑。
(2)方案一中,温度升至最大值后又下降的原因可能是反应完全后,热量向空气中传递,烧杯里物质的温度降低。
(3)方案二中,反应放出的热量使得蜡烛熔化,小木片脱落。
(4)方案三中,如果A试管里发生的反应是放热反应,锥形瓶中气体的压强增大,U形管中红墨水液面左边低于右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是放热反应,如果放置较长时间,热量散失,装置中气体的压强与外界压强相等,U形管中红墨水液面左右相平。
(6)方案三中的实验②属于吸热反应,U形管中红墨水液面左高右低。
答案:(1)放热 2Al+6H+===2Al3++3H2↑
(2)反应完全后,热量向空气中传递,烧杯里物质的温度降低
(3)蜡烛受热熔化 氢氧化钠与硫酸反应放热
(4)低于
(5)放热 红墨水液面左右相平
(6)红墨水液面左高右低 小于
- 12 -