- 2021-05-08 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】福建省连城县第一中学2019-2020学年高一下学期期中考试试题
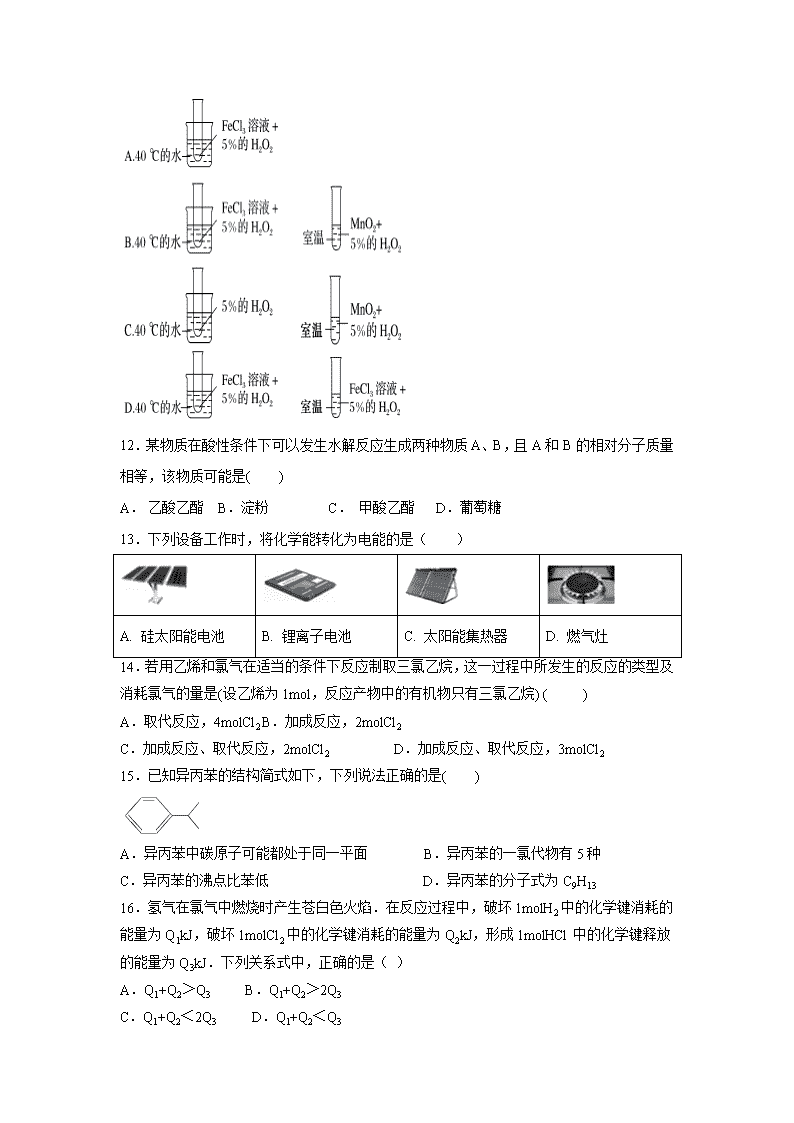
福建省连城县第一中学2019-2020学年高一下学期期中考试试题 (满分:100分 考试时间:90分钟 ) 可能用到的原子量:H—1 C—12 N—14 O—16 S—32 Fe—56 Ba—137 第 Ⅰ 卷 (共22小题) 一、选择题(只有一个选项符合题意,每小题2分,共44分) 1.化学与社会、生产、生活紧密相关,下列说法正确的是 ( ) A.油脂、糖类和蛋白质都是高分子化合物,一定条件下能发生水解 B.鸡蛋清中加入Na2SO4、CuSO4都会因盐析产生沉淀 C.石油的分馏和煤的干馏都属于物理变化 D.75%(体积分数)的乙醇溶液常用于医疗消毒 2. 下列有关化学用语的表示不正确的是 ( ) A.二氧化碳分子的比例模型: B.羟基的电子式: C.中子数为18的氯原子: D.乙酸乙酯的最简式为C2H4O 3. 市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣服的汗渍、血迹及人体排放的蛋白质油渍遇到它,皆能水解而除去,下列衣料中不能用加酶洗衣粉洗涤的是( ) ①棉织品 ②毛织品 ③晴纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥锦纶织品 A.①②③ B. ③④⑤ C. ②④ D.③⑤⑥ 4.下列对物质的用途描述中错误的是( ) A.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性 B.明矾可以消毒杀菌常用于净水 C.氢氧化铝在医疗上是治疗胃酸过多的一种药剂 D.镁燃烧时发出耀眼的火焰,可以用镁来制造照明弹和焰火等 5.工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。以下途径,假设反应都能进行,从经济效益考虑最合理的反应是( ) A.C3H8C3H6+H2 B.C3H83C+4H2 C.2H2O2H2↑+O2↑ D.C3H8+6H2O3CO2+10H2 6.下列变化化学键未被破坏的是( ) A.HCl溶于水 B.NaOH固体熔化 C.NH4HCO3分解 D.碘升华 7.制取一氯乙烷最好采用的方法是( ) A.乙烷和氯气反应 B. 乙烯和氯气反应 C.乙烷和氯化氢反应 D. 乙烯和氯化氢反应 8. 可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是( ) A.将混合气体通过盛有酸性高锰酸钾的洗气瓶 B.将混合气体通过盛有澄清石灰水的洗气瓶 C.将混合气体通过盛有浓硫酸的洗气瓶 D.将混合气体通过盛有足量溴水的洗气瓶 9.喷水溶液法是科学家近期研制出的一种使沙漠变绿洲的新技术。它是先在沙漠中喷洒一定量的聚丙烯酸酯( ) “水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下30—50 cm处形成一个厚0.5 cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用。下列对聚丙烯酸酯的说法中,不正确的是( ) A.在一定条件下能发生加成反应 B.它可由CH2=CH—COOR经过加成聚合反应而得到 C.在一定条件下能发生水解反应 D.合成它的小分子化合物是CH2=CH—COOR 10、在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是( ) 11.已知FeCl3和MnO2都可做H2O2分解制O2的催化剂,为了探究温度对化学反应速率的影响,下列实验方案可行的是( ) 12.某物质在酸性条件下可以发生水解反应生成两种物质A、B,且A和B的相对分子质量相等,该物质可能是( ) A. 乙酸乙酯 B.淀粉 C. 甲酸乙酯 D.葡萄糖 13.下列设备工作时,将化学能转化为电能的是( ) A. 硅太阳能电池 B. 锂离子电池 C. 太阳能集热器 D. 燃气灶 14.若用乙烯和氯气在适当的条件下反应制取三氯乙烷,这一过程中所发生的反应的类型及消耗氯气的量是(设乙烯为1mol,反应产物中的有机物只有三氯乙烷) ( ) A.取代反应,4molCl2 B.加成反应,2molCl2 C.加成反应、取代反应,2molCl2 D.加成反应、取代反应,3molCl2 15.已知异丙苯的结构简式如下,下列说法正确的是( ) A. 异丙苯中碳原子可能都处于同一平面 B.异丙苯的一氯代物有5种 C.异丙苯的沸点比苯低 D.异丙苯的分子式为C9H13 16.氢气在氯气中燃烧时产生苍白色火焰.在反应过程中,破坏1molH2中的化学键消耗的能量为Q1kJ,破坏1molCl2中的化学键消耗的能量为Q2kJ,形成1molHCl中的化学键释放的能量为Q3kJ.下列关系式中,正确的是( ) A.Q1+Q2>Q3 B.Q1+Q2>2Q3 C.Q1+Q2<2Q3 D.Q1+Q2<Q3 17.下表是部分短周期元素的相关信息:(前四种元素位于同一周期内)下列判断正确的是( ) 元素代号 L M T Q R 原子半径/nm 0.154 0.130 0.118 0.102 0.073 主要化合价 +1 +2 +3 +6、-2 -2 A.沸点:H2Q>H2R B.碱性:T(OH)3>M(OH)2 C.T和Q 两者最高价氧化物对应的水化物可以发生反应 D.L与R形成的化合物中只能含有离子键 18. 如图装置,将溶液a逐滴加入固体b中,下列叙述中不正确的是( ) A.若a为浓硫酸,b为Na2SO3固体,c盛石蕊溶液,则c溶液先变红后褪色 B.若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色 C.若a为醋酸溶液,b为碳酸钙,c中盛过量澄清石灰水,则c中溶液变浑浊 D.若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 19.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( ) A.原子半径:W>Z>Y>X B.最高价氧化物对应水化物的酸性:Z>W>X C.四种元素的单质中,Z单质的熔、沸点最低 D.W的单质能与水反应,生成一种具有漂白性的物质 20. X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( ) A.X元素位于ⅥA B.A和C不可能发生氧化还原反应 C.B的沸点高于C的沸点 D.A不能溶解于B中 21.a mL三种气态烃组成的混合物与足量氧气混合,点燃爆炸后,恢复到原来的状态(常温、常压),体积共缩小2a mL。则三种烃可能是( ) A.C2H4、C2H2、CH4 B.C2H6、C3H6、C4H6 C.CH4、C2H6、C3H8 D.CH4、C2H4、C3H4 22.某有机化合物的结构简式如图所示.有关该化合物的叙述正确的是( ) A.该有机物的分子式为C10H7O3 B.1mol该物质最多能与1mol H2发生加成反应 C.该有机物在一定条件下,可以发生加成、氧化、酯化反应 D.1mol该有机物能与活泼金属钠反应,生成2mol氢气 第Ⅱ卷 非选择题(共56分) 23.(14分)Ⅰ.下表是A、B、C、D四种常见有机物的相关信息。根据表中信息回答下列问题: 有机物A 有机物B 有机物C 有机物D ①可用于果实催熟 ②比例模型为 ①由C、H两种元素组成②球棍模型为 ①生活中常见的液态有机物,分子中碳原子数与有机物A相同 ②能与Na反应,但不能与NaOH反应 ①相对分子质量比有机物C大14 ②能由有机物C氧化生成 (1)有机物B的分子式为_____________。 (2)下列有关有机物A、B的说法正确的是_______________。 a.A、B均可使酸性KMnO4溶液褪色 b.A、B分子中所有的原子在同一平面内 c.等质量的A、B完全燃烧,消耗氧气的量相同 d.A、B分子均含有官能团碳碳双键,能发生加成反应 (3)写出有机物C的同分异构体的结构简式 。 (4)在一定条件下,有机物C与有机物D反应能生成具有水果香味的物质E,其化学反应方程式为 ; 某次实验中以6.0gD为原料制得4.84gE,则反应E的产率为______________。 II. 聚四氟乙烯在耐热性和化学稳定性上都超过了其他塑料,号称“塑料之王”,可用于制造飞机、导弹的无油轴承,密封填料,人造血管,滑雪板,不粘锅等。其合成路线如下图所示: ―→―→ A B C D 写出下列反应的化学方程式:A→B:___________________________; B→C:_________________________________________________ 24. (14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题: 族 周期 IA 0 1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 ② ③ ④ 3 ⑤ ⑥ ⑦ ⑧ (1)①形成的阴离子的结构示意图为 。如果③原子中含8个中子,则其原子符号为___________ (2)③、④、⑤、⑥简单离子半径由小到大的顺序为 。(填离子符号) (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式 :, (4)设计实验证明⑧的非金属性比⑦强,用化学方程式表示 。 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: (a) X溶液与Y溶液反应的离子方程式为 。 (b)N→⑥的单质的化学方程式为 。 25.(14分)近年来,乳酸成为研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过发酵法制备。利用乳酸 为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。 (1)请写出乳酸分子中官能团的名称 、 。 (2)乳酸能与纯铁粉反应制备一种补铁药物--乳酸亚铁,反应如下,计算乳酸亚铁中铁的质量分数为______ (3) 乳酸聚合成的纤维非常适合做手术缝合线,其原因是 (4)乳酸发生下列变化 所用的试剂是a ,b (写化学式) (5)请写出乳酸与少量的Na2CO3溶液反应的化学方程式 (6)乳酸乙酯( )是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构) 种。 26.(14分) 硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。 I.[查阅资料] (1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。 (2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3 和Na2SO4。 (3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。 Ⅱ.[制备产品]实验装置如图所示(省略夹持装置) 实验步骤: (1)仪器B和D的作用是 , 按图示加入试剂,E中的试剂是_____________(选填下列字母编号)。 A.浓H2SO4 B.饱和NaHSO3溶液 C.NaOH溶液 D饱和食盐水 (2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4,C中反应生成Na2S2O3和CO2,写出C中反应的离子方程式为 。 (3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经 (填写操作名称)、过滤、洗涤、干燥、得到产品。 Ⅲ.[探究与反思] (4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,洗涤, ,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。 (5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验Ⅱ步骤(2)进行了改进,改进后的操作是 ,然后再向C中烧瓶加入硫化钠和碳酸钠的混合溶液。 (6)探究Na2S2O3是否具有还原性:向新制氯水中滴加Na2S2O3溶液,若看到 氯水颜色变浅(或褪色), 说明有还原性 (已知:Na2S2O3被氧化成Na2SO4),反应的离子方程式为 。 【参考答案】 第 Ⅰ 卷 一、选择题 (只有一个选项是正确,每题2分,共44分) 题号 1 2 3 4 5 6 7 8 9 10 11 答案 D A C B D D D D A D D 题号 12 13 14 15 16 17 18 19 20 21 22 答案 C B C B C C A D B D C 第Ⅱ卷 非选择题(共56分) (方程式书写错不得分,化学式写对但没有配平,单位没写扣一分) 23.(14分)(每空2分) Ⅰ.(1) C6H6 (2) b (3) CH3OCH3 (4) CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O;写“→”不扣分); 55.0 ﹪ II. CHCl3+2 HF CHClF2+2HCl 2CHClF2CF2===CF2+2HCl 24.(14分)(每空2分) (1);157N (2)Al3+查看更多
- 当前文档收益归属上传用户
- 下载本文档