- 2021-05-08 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
陕西省渭南市大荔县2019-2020学年高二上学期期末教学质量检测化学试题
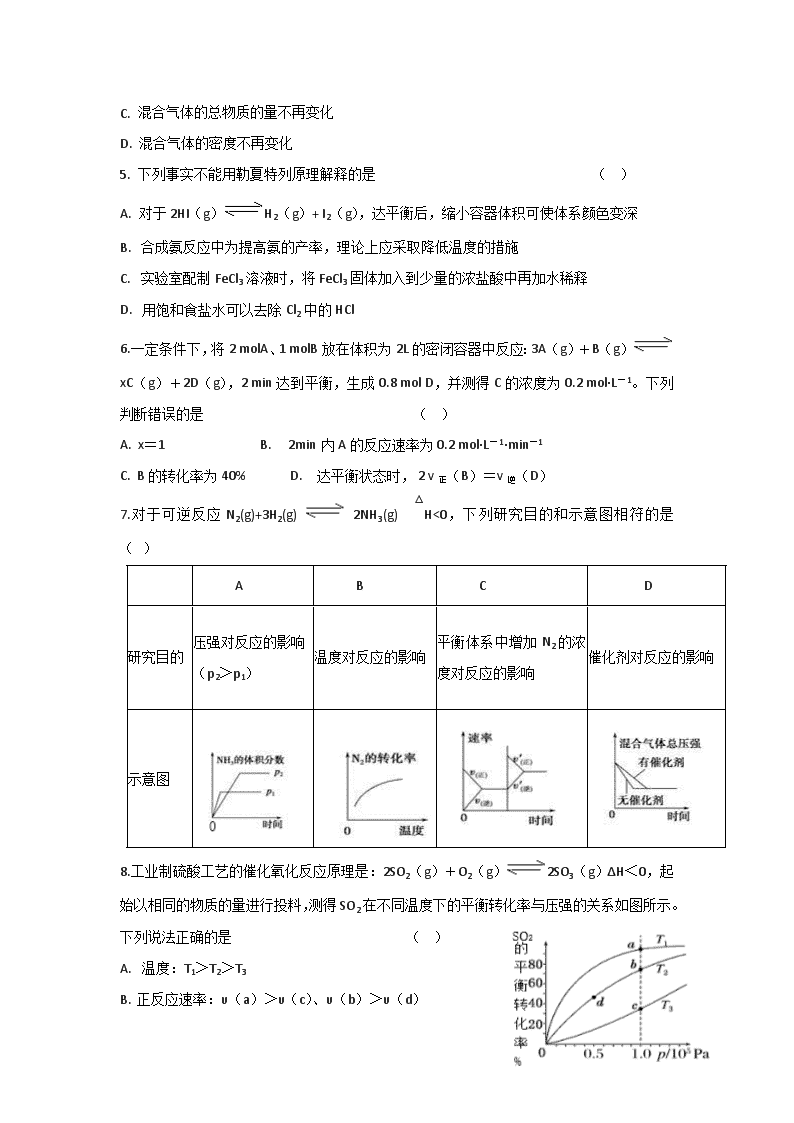
大荔县期末质量检测高二化学试题 本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间90分钟。 试卷可能用到的相对原子质量:H -1 C- 12 O -16 N -14 Na -23 Cl -35.5 Mg-24 Zn -65 S -32 Cu -64 Pb--207 第Ⅰ卷(选择题 共48分) 一、选择题(本小题包括16小题,每小题只有一个选项符合题意,每小题3分,共48分) 1. 生产生活中的下列做法正确的是 ( ) A. 用明矾做自来水的消毒剂 B. 废弃的干电池不能随意丢弃,但可以土埋处理 C. 用电解NaCl溶液来制备金属钠 D. 电工操作中,不能把铜线和铝线拧在一起连接线路 2. 下列说法正确的是 ( ) A. 常温下,0.1mol·L-1盐酸pH大于0.1mol·L-1 醋酸的pH B. 升高温度使反应速率加快,是因为降低了反应的活化能 C. 使用催化剂可以改变反应的平衡常数 D. 光伏电池可实现太阳能到电能的转化 3. 下列有关热化学反应的描述正确的是 ( ) A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol B. CO的燃烧热ΔH=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) ΔH=(2×283.0)kJ/mol C. 已知:C(s)+O2(g)=CO2(g)△H1 ;C(s)+1/2O2(g)=CO(g)△H2 ,则△H1>△H2 D. C(石墨,s)= C(金刚石,s) ΔH=+1.9kJ·mol-1 ,则金刚石比石墨稳定 4.一定温度下,对可逆反应A(g)+2B(g)3C(g)的下列叙述中,能说明反应已达到平衡的是 ( ) A. 单位时间内消耗amolA,同时消耗3amolC B. 容器内的总强不再变化 A. 混合气体的总物质的量不再变化 D. 混合气体的密度不再变化 5. 下列事实不能用勒夏特列原理解释的是 ( ) A. 对于2HI(g)H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深 B. 合成氨反应中为提高氨的产率,理论上应采取降低温度的措施 C. 实验室配制FeCl3溶液时,将FeCl3固体加入到少量的浓盐酸中再加水稀释 D. 用饱和食盐水可以去除Cl2中的HCl 6.一定条件下,将2 molA、1 molB放在体积为2L的密闭容器中反应:3A(g)+B(g) xC(g)+2D(g),2 min达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是 ( ) A. x=1 B. 2min内A的反应速率为0.2 mol·L-1·min-1 C. B的转化率为40% D. 达平衡状态时, 2 v正(B)=v逆(D) 7.对于可逆反应N2(g)+3H2(g) 2NH3(g) △H<0,下列研究目的和示意图相符的是 ( ) A B C D 研究目的 压强对反应的影响 (p2>p1) 温度对反应的影响 平衡体系中增加N2的浓度对反应的影响 催化剂对反应的影响 示意图 8.工业制硫酸工艺的催化氧化反应原理是:2SO2(g)+O2(g)2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 ( ) A. 温度:T1>T2>T3 B. 正反应速率:υ(a)>υ(c)、υ(b)>υ(d) C. 平均摩尔质量:M(a)>M(c)、M(b)>M(d) D. 平衡常数:K(a)>K(c)、K(b)>K(d) 9. 下列物质的性质与用途具有对应关系的是 ( ) A. Na2CO3溶液显碱性,可用作油污去除剂 B. FeCl3易水解,能加快H2O2的分解 C. CuSO4溶液显酸性,可加快锌与硫酸反应的速率 D. Al易于氧气反应,工业上用电解熔融的AlCl3制备铝 10.已知某温度下,K(HCN)=6.2×10-10、K(HF)=6.8×10-4、K(CH3COOH)=1.8×10-5。下列说法正确的是 ( ) A. 酸性:HCN>CH3COOH>HF B. pH:NaF>CH3COONa>NaCN C. CH3COOH可与NaF溶液反应:CH3COOH+NaF==CH3COONa+ HF D. 等质量的NaOH分别与CH3COOH、HCN、HF恰好反应时,耗三种酸的物质的量相同 11.25℃时,草酸(H2C2O4)的Ka1=5.4×10-2,Ka2=5.4×10-5,是一种常用的除锈剂。0.1mol/L的NaHC2O4溶液中,下列粒子的物质的量浓度关系不正确的是 ( ) A. c(Na+)>c(HC2O4-)>c(OH-)>c(H2C2O4)>c(H+) B. c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4) C. c(Na+)+c(H+)= c(HC2O4-)+2c(C2O42-)+c(OH-) D. c(H+)+c(H2C2O4)= c(OH-)+c(C2O42-) 12.下列有关装置图的叙述中正确的是 ( ) A.装置①中桥墩应与电源的负极相连能被保护,该方法叫做外加电流的阴极保护法 B. 装置②的总反应式:Cu+2Fe3+=Cu2++2Fe2+ C. 装置③为氢氧燃料电池的工作原理,A中通入的气体是氧气 D. 装置④为碱性锌锰干电池,其负极的电极反应式为:Zn-2e-==Zn2+ 13.根据下列实验操作和现象所得到的结论正确的是 ( ) 选项 实验操作和现象 实验结论 A 向0.1mol/L碳酸钠溶液中滴入酚酞,溶液变红,加热,红色加深。 碳酸钠属于弱碱 B 测定醋酸溶液pH,用玻璃棒蘸取溶液,点在pH试纸上,试纸显红色。 醋酸溶液显酸性 C 将铜片和锌片用导线相连,插入CuSO4溶液中,锌片质量减小,铜片质量增加。 锌被还原 D 向氯化银的浊液中滴入KI溶液,浊液中的固体由白色变为黄色。 Ksp(AgCl)查看更多