- 2021-05-08 发布 |
- 37.5 KB |
- 27页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习化学工艺流程题课件(27张)(全国通用)
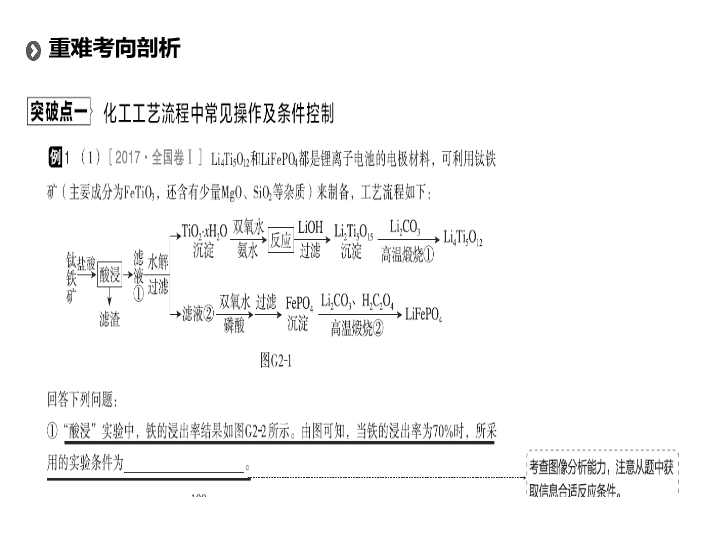
题型二 化学工艺流程题 高考 题型突破 重难考向剖析 题型强化训练 · · 题型特点 本题型以现代工业生产为基础,与化工生产成本、产品提纯、环境保护等相融合,考查物质的制备、检验、分离、提纯等基本实验原理在化工生产中的实际应用,要求考生依据流程图分析原理、紧扣信息、抓住关键、准确答题。这类试题具有较强的实用性和综合性,能较好地考查学生信息获取能力、分析问题能力、语言表达能力和计算能力等。 重难考向剖析 【 答案 】 (1)①100 ℃ 、 2 h , 90 ℃、 5 h ② FeTiO 3 + 4H + + 4Cl - =Fe 2 + + TiOCl 4 2- + 2H 2 O ③低于 40 ℃ , TiO 2 · x H 2 O 转化反应速率随温度升高而增加;超过 40 ℃ ,双氧水分解与氨气逸出导致 TiO 2 · x H 2 O 转化反应速率下降 (2)① 将样品中可能存在的 Fe 2 + 氧化为 Fe 3 + H 2 O 2 ② SiO 2 ( 或 H 2 SiO 3 ) SiO 2 + 4HF=SiF 4 ↑+ 2H 2 O( 或 H 2 SiO 3 + 4HF=SiF 4 ↑+ 3H 2 O) ③防止胶体生成,易沉淀分离 Al(OH) 3 Fe(OH) 3 (3)①Mg 2 B 2 O 5 · H 2 O + 2H 2 SO 4 2H 3 BO 3 + 2MgSO 4 提高反应温度、减小铁硼矿粉粒径 ② Fe 3 O 4 SiO 2 和 CaSO 4 ③将 Fe 2 + 氧化成 Fe 3 + 使 Fe 3 + 与 Al 3 + 形成氢氧化物而除去 ④ ( 七水 ) 硫酸镁 【 解析 】 (1)① 由图示知,在 “ 酸浸 ” 时,浸出率为 70% 时的条件为 100 ℃ 、 2 h 或 90 ℃ 、 5 h 。 ② 利用信息知,“酸浸 ” 时 FeTiO 3 与 HCl 反应生成 TiOCl 4 2- ,然后结合原子守恒、电荷守恒可得反应的离子方程式为 FeTiO 3 + 4H + + 4Cl - =Fe 2 + + TiOCl 4 2- + 2H 2 O 。 ③ 当低于 40 ℃ 时,随温度升高,反应速率加快,故温度低于 40 ℃ 时,相同时间内,随温度升高 TiO 2 · x H 2 O 转化率升高;当超过 40 ℃ 时, H 2 O 2 易分解、氨水易挥发,所以当温度高于 40 ℃ 时, H 2 O 2 的分解与氨水的挥发使 TiO 2 · x H 2 O 转化反应速率下降,在相同时间内, TiO 2 · x H 2 O 转化率下降;因此,在 40 ℃ 时 TiO 2 · x H 2 O 转化率最高。 (2)①Fe 3 + 在 pH 较小时容易沉淀,所以加入 HNO 3 的目的是将溶解液中可能存在的 Fe 2 + 氧化为 Fe 3 + ; H 2 O 2 将 Fe 2 + 氧化为 Fe 3 + 时不会引入杂质,故可利用 H 2 O 2 来替代 HNO 3 作氧化剂氧化 Fe 2 + 。 ② 根据水泥的成分和相关的反应可知,沉淀为不溶于盐酸、硝酸的 SiO 2 ; SiO 2 与弱酸 HF 反应的化学方程式为 SiO 2 + 4HF=SiF 4 ↑+ 2H 2 O 。 ③ 加氨水能使金属阳离子生成氢氧化物沉淀,加热能使生成的微量胶体聚沉,故加氨水过程中加热的目的是防止胶体生成,易沉淀分离;加氨水前滤液中有四种金属阳离子,它们形成的碱的碱性由弱到强的顺序是 Fe(OH) 3 、 Al(OH) 3 、 Mg(OH) 2 、 Ca(OH) 2 ,因此加热生成沉淀的主要成分是前两种: Fe(OH) 3 、 Al(OH) 3 。 (3)① 根据题干表述及流程图知硫酸酸浸铁硼矿过程中,与 Mg 2 B 2 O 5 · H 2 O 反应的产物应有 H 3 BO 3 、 MgSO 4 ;铁硼矿与硫酸的反应为固液反应,为提高反应速率可通过升高温度、增大溶液浓度、增大固体表面积 ( 粉碎矿石 ) 、搅拌等措施。 ②Fe 3 O 4 俗名磁性氧化铁,可利用其磁性从滤渣中分离,剩余固体为 SiO 2 和 CaSO 4 。 ③Fe 2 + 沉淀所需溶液 pH 较大, Fe 3 + 沉淀所需溶液 pH 较小,可加入 H 2 O 2 将 Fe 2 + 转化为 Fe 3 + 后调节 pH ,使之沉淀除去。 ④ 从流程图看,铁硼矿中的 Fe 3 O 4 、 Fe 2 O 3 、 FeO 、 Al 2 O 3 和 SiO 2 等杂质经过前几次操作均已被除去,剩余含 MgSO 4 和硼酸的溶液,会有 MgSO 4 · 7H 2 O 晶体混杂在硼酸中。 解题策略 1 .化工生产的一般工艺流程 (1) 原料预处理的几种常用方法 研磨 减小固体的颗粒度,增大固体与液体或气体间的接触面积,加快反应速率 水浸 使可溶性的有用成分从固体原料混合物中转移到溶液中 酸浸 使金属、金属氧化物或盐转化成可溶于水的物质进入溶液,不溶物通过过滤除去 碱浸 除去油污、溶解酸性氧化物 ( 如二氧化硅 ) 、铝及其氧化物等 醇浸 对于非金属矿物,通常用稀醇溶液浸取,水中加入乙醇是为了降低溶剂的极性,提高非金属单质的溶解程度 灼烧 除去可燃性杂质或使原料初步转化,如从海带中提取碘时的灼烧就是为了除去可燃性杂质 加热煮沸 排除溶液中溶解的气体 (2) 反应条件控制 调 pH 确保 “ 某离子 ” 完全形成氢氧化物沉淀,防止 “ 另外离子 ” 的沉淀。调节 pH 所需的物质一般应满足两点: ① 能与 H + ( 或 OH - ) 反应,使溶液的 pH 增大 ( 或减小 ) ; ② 不引入新的杂质 升温 加快反应速率,加速某固体的溶解,促进平衡向吸热方向移动,使某些物质汽化或升华,防止堵塞导管等 降温 防止某物质在高温时分解、挥发、升华或促进平衡向放热方向移动 控温 温度过高,物质会分解或挥发;温度过低,物质无法挥发或者反应速度慢 控制压强 改变反应速率,影响化学平衡 趁热过滤 “ 趁热 ” 是为了让产品溶解,防止其结晶析出。趁热过滤的目的:一是提高纯度,二是减少结晶损失 加入物质 加沸石或碎瓷片:防止液体暴沸;加有机溶剂:萃取某些物质,或降低某些物质的溶解度 冰水洗涤 洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗 【 答案 】 (1)2OH - + SO 2 =SO 3 2- + H 2 O SO 3 2- 与 Ca 2 + 生成 CaSO 3 沉淀,平衡向正向移动,有 NaOH 生成 (2)①CO(NH 2 ) 2 + H 2 O CO 2 + 2NH 3 ② 8NH 3 + 6NO 2 7N 2 + 12H 2 O ③ 2SO 2 + O 2 + 4NH 3 + 2H 2 O=2(NH 4 ) 2 SO 4 (3)①V 2 O 5 + 2H + =2VO 2 + + H 2 O SiO 2 ② 2NH 4 VO 3 V 2 O 5 + 2NH 3 ↑+ H 2 O ↑ 【 解析 】 (1)SO 2 遇碱反应生成亚硫酸盐和水。 Na 2 SO 3 电离出 SO 3 2- , SO 3 2- 与 Ca 2 + 结合生成 CaSO 3 沉淀,平衡正向移动,生成 NaOH 。 (2)① 反应物为尿素和水,产物为 NH 3 和 CO 2 ; ②NH 3 与 NO 2 反应生成 N 2 和 H 2 O ; ③ 根据产物 (NH 4 ) 2 SO 4 ,该反应原理可以理解为 SO 2 与 O 2 反应生成 SO 3 , SO 3 与氨水反应生成 (NH 4 ) 2 SO 4 ,或者 SO 2 与氨水反应生成 (NH 4 ) 2 SO 3 , (NH 4 ) 2 SO 3 再被 O 2 氧化为 (NH 4 ) 2 SO 4 ,类似于酸雨的形成过程。 (3)①“ 酸浸 ” 时 V 2 O 5 与硫酸反应,转化为 VO 2 + , V 的化合价不变,离子方程式为 V 2 O 5 + 2H + =2VO 2 + + H 2 O 。 “ 酸浸 ” 时 SiO 2 与硫酸不反应,而其他物质与硫酸反应或溶于硫酸,故 “ 废渣 1” 为 SiO 2 ; ②NH 4 VO 3 中 V 为+ 5 价,“煅烧 ” 时生成 V 2 O 5 , V 的化合价不变,则为非氧化还原反应,故化学方程式为 2NH 4 VO 3 V 2 O 5 + 2NH 3 ↑+ H 2 O ↑。 解题策略 分析题给流程中反应物,什么条件下反应,生成了什么物质;根据化合价变化规律或元素守恒确定其他生成物;结合氧化还原反应规律或其他,配平并完成方程式的书写。 1 . 碱式硫酸铁 [Fe(OH)SO 4 ] 是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑 ( 含少量氧化铝、氧化铁等 ) 生产碱式硫酸铁的工艺流程如图 G27 : 专题强化训练 图 G27 已知部分阳离子以氧氧化物形式沉淀时溶液的 pH 见下表。 Fe 3 + Fe 2 + Al 3 + pH( 开始沉淀 ) 2.3 7.5 3.4 pH( 完全沉淀 ) 3.2 9.0 4.4 回答下列问题: (1) 碱式硫酸铁能够净水的原因是 _________________ 。 (2) 加入少量 NaHCO 3 的目的是调节溶液的 pH ,使溶液中的 ________ 沉淀。 (3) 假设沉淀完全时溶液中金属离子的浓度为 1.0×10 - 5 mol · L - 1 ,试估算 K sp [Fe(OH) 2 ] = ________ 。 (4) 反应 Ⅱ 中加入 NaNO 2 的目的是氧化亚铁离子,该反应的离子方程式为 ____________ 。 (5) 实际生产中,反应 Ⅱ 常同时通入 O 2 以减少 NaNO 2 的用量,若参与反应的 O 2 体积为 11.2 L( 标准状况 ) ,则相当于节约 NaNO 2 的物质的量为 ________ 。 (6) 在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有 Fe 2 + 及 NO ,某同学根据提供的试剂设计实验检验所得产品中不含 Fe 2 + ,含有 SO 4 2- ,可供选择的试剂如下: A .新制氯水 B . 0.1 mol · L - 1 KSCN 溶液 C . 10% NaOH 溶液 D . 20% HNO 3 溶液 E . 0.05 mol·L - 1 酸性 KMnO 4 溶液 F . 0.1 mol · L - 1 BaCl 2 溶液 请你帮助该同学完成实验,将相关项目填入表中: 实验操作 现象 结论 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀 得红棕色溶液 溶液中含有 Fe 3 + __________________ ________ 溶液中不含 Fe 2 + __________________ ________ 溶液中含有 SO 4 2- (7) 为测定含 Fe 2 + 和 Fe 3 + 溶液中铁元素的总含量,实验操作如下:准确量取 20.00 mL 溶液于带塞锥形瓶中,加入足量 H 2 O 2 ,调节 pH < 2 ,加热除去过量 H 2 O 2 ;加入过量 KI 充分反应后,加少量淀粉,再用 0.100 0 mol·L - 1 Na 2 S 2 O 3 标准溶液滴定至终点,消耗标准溶液 20.00 mL 。已知: 2Fe 3 + + 2I - =2Fe 2 + + I 2 , I 2 + 2S 2 O 3 2- =2I - + S 4 O 6 2- 。 则溶液中铁元素的总含量为 ________ g·L - 1 。 【 答案 】 (1)Fe 3 + 能水解生成吸附能力较强的胶体 (2)Al 3 + (3)10 - 15 (4)2H + + Fe 2 + + NO 2 - =Fe 3 + + NO↑ + H 2 O (5)2 mol (6) (7)5.6 【 解析 】 废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,发生反应 Fe + H 2 SO 4 =FeSO 4 + H 2 ↑、 Al 2 O 3 + 3H 2 SO 4 =Al 2 (SO 4 ) 3 + 3H 2 O 、 Fe 2 O 3 + 3H 2 SO 4 =Fe 2 (SO 4 ) 3 + 3H 2 O 、 Fe 2 (SO 4 ) 3 + Fe=3FeSO 4 ,然后加入 NaHCO 3 并搅拌,调节溶液的 pH ,发生反应 Al 3 + + 3HCO 3 - =Al(OH) 3 ↓+ 3CO 2 ↑,所以滤渣中成分是 Al(OH) 3 ,过滤得到硫酸亚铁溶液,向硫酸亚铁溶液中加入稀硫酸和 NaNO 2 ,酸性条件下, NaNO 2 和 FeSO 4 发生氧化还原反应生成铁离子、 NO ,将溶液蒸发 取少量溶液于试管中,滴加 0.05 mol/L 的酸性高锰酸钾溶液 溶液不褪色 溶液中不含 Fe 2 + 取少量溶液于试管中,滴加 0.1 mol/L 的氯化钡溶液,再加入 20% 稀硝酸溶液 有白色沉淀生成,加稀硝酸后沉淀不溶解 溶液中含有 SO 4 2- 浓缩、过滤得到碱式硫酸铁。 (1) 铁离子水解生成氢氧化铁胶体,胶体具有吸附性,所以氢氧化铁胶体能吸附水中的悬浮物而净水。 (2) 过量废铁屑溶于稀硫酸得 FeSO 4 、 Al 2 (SO 4 ) 3 混合溶液,根据表中数据可知,向混合溶液中加入少量 NaHCO 3 ,沉淀 Al 3 + 而不沉淀 Fe 2 + ,反应方程式为 Al 3 + + 3HCO 3 - =Al(OH) 3 ↓+ 3CO 2 ↑,所以加入碳酸氢钠调节溶液 pH 除去 Al 3 + 。 (3) 亚铁离子完全沉淀时溶液的 pH = 9.0 ,则溶液中 c (OH - ) = 10 - 5 mol/L , K sp [Fe(OH) 2 ] = c (Fe 2 + ) · c 2 (OH - ) = 10 - 5 × (10 - 5 ) 2 = 10 - 15 。 (4) 酸性条件下,亚硝酸根离子和亚铁离子发生氧化还原反应生成铁离子和 NO ,离子方程式为 2H + + Fe 2 + + NO 2 - =Fe 3 + + NO↑ + H 2 O 。 (6) 亚铁离子能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以可以用酸性高锰酸钾溶液检验亚铁离子,其操作为取少量溶液于试管中,滴加 0.05 mol/L 的酸性高锰酸钾溶液,如果溶液不褪色,就说明原来产品中不含亚铁离子;用氯化钡溶液检验硫酸根离子,硫酸钡不溶于稀硝酸,其操作为取少量溶液于试管中,滴加 0.1 mol/L 的氯化钡溶液,有白色沉淀生成,再加入 20% 稀硝酸溶液,白色沉淀不溶解,就说明溶液中含有 SO 4 2- 。 (7) 根据 2Fe 3 + + 2I - =2Fe 2 + + I 2 、 I 2 + 2S 2 O 3 2- =2I - + S 4 O 6 2- 知,存在 Fe 3 + ~ S 2 O 3 2- ,设加入 H 2 O 2 后溶液中 Fe 3 + 的物质的 量为 n 。 Fe 3 + ~ S 2 O 3 2- 1 1 n 0.100 0 mol·L - 1 × 0.020 L 1 ∶ 1 = n ∶ (0.100 0 mol·L - 1 × 0.020 L) n = 0.100 0 mol/L×0.020 L = 0.002 mol , m (Fe) = 0.002 mol×56 g/mol = 0.112 g 则溶液中铁元素的总含量= 0.112 g÷0.020 L = 5.6 g/L 。 2 . 锗是重要的半导体材料,应用于航空航天测控、光纤通信等领域。一种提纯二氧化锗粗品 ( 主要含 GeO 2 、 As 2 O 3 ) 的工艺如下: 已知: ①“ 碱浸 ” 过程中的反应为 GeO 2 + 2NaOH=Na 2 GeO 3 + H 2 O As 2 O 3 + 2NaOH=2NaAsO 2 + H 2 O ②“蒸馏”过程中的反应为 Na 2 GeO 3 + 6HCl=2NaCl + GeCl 4 + 3H 2 O ③ GeCl 4 的熔点为- 49. 5 ℃ , AsCl 3 与 GeCl 4 的沸点分别为 130.2 ℃ 、 84 ℃ 。 图 G28 (1) 锗的原子序数为 32 ,锗在元素周期表中的位置为第 ________ 周期 ________ 族。 (2)“ 氧化除砷 ” 的过程是将 NaAsO 2 氧化为 Na 3 AsO 4 ,其反应的化学方程式为 ________ 。 (3) 传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是 _________ 。 (4) 工业上与蒸馏操作相关的设备有 ________ 。 A .蒸馏釜 B .离心萃取机 C .冷凝塔 D .加压过滤机 (5)“ 水解 ” 操作时发生的化学反应方程式为 _______________________ ,“水解 ” 操作时保持较低温度有利于提高产率,其可能的原因是 ________________( 答一条即可 ) 。 (6) 若 1 t 二氧化锗粗品 ( 含杂质 30%) 经提纯得 0.745 t 的高纯二氧化锗产品,则杂质脱除率为 ________ 。查看更多