- 2021-05-08 发布 |
- 37.5 KB |
- 33页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习 非选择题专项指导 课件(33张)(全国通用)
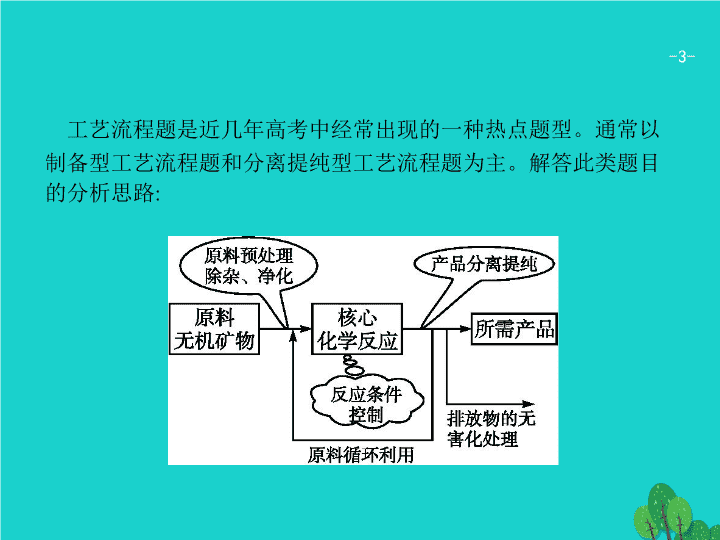
专题二 非选择题专项指导 题型一 工艺流程题 - 3 - 工艺流程题是近几年高考中经常出现的一种热点题型。通常以制备型工艺流程题和分离提纯型工艺流程题为主。解答此类题目的分析思路 : - 4 - 解答工艺流程题可按照以下步骤进行 : 1 . 认真阅读题干 , 了解生产目的及有用信息。 2 . 整体分析工艺流程 , 掌握生产过程分为哪几个阶段。 3 . 分析每一个阶段的生产原理、物质变化、条件控制及其实验操作。 4 . 了解生产过程中的有关物质的回收和原料的循环利用 , 以及对 “ 绿色化学 ” 思想的运用和所采取的环保措施。 5 . 认真分析题中设问 , 规范作答。 - 5 - 一 二 一、物质制备型工艺流程题 例 1 硫酸是一种重要的化工产品 , 接触法制硫酸的简要流程如下图所示 : 请回答下列问题 : (1) 上图中的造气和催化反应分别在甲、乙设备中进行 , 请写出乙设备名称 : 。 - 6 - 一 二 (2) 有关接触法制硫酸的下列说法中 , 正确的是 ( 填字母 ) 。 A. 从甲设备出来的炉气需净化 , 是为了防止混合气体污染空气 B. 乙设备中使用催化剂 , 是为了提高反应速率和 SO 2 的转化率 C. 煅烧含硫 48% 的黄铁矿时 , 若 FeS 2 损失了 2%, 则 S 损失 4% D. 接触室中适宜条件是 V 2 O 5 催化剂、高温、高压 E. 乙设备中需安装热交换器 - 7 - 一 二 (3) 硫酸工厂排放的尾气中含少量二氧化硫。为防止污染大气 , 在排放前必须进行尾气处理并设法进行综合利用。硫酸工厂排放尾气中的 SO 2 通常用足量石灰水吸收 , 然后用稀硫酸处理。 ① 写出上述过程的化学方程式 : 。 ② 若某硫酸厂每天排放的 1 万立方米 ( 标准状况 ) 尾气中含 0.224%( 体积分数 ) 的 SO 2 , 通过上述方法处理 , 理论上需生石灰 kg 。 (4) 硫酸厂等排放的 SO 2 尾气还可用电解法处理 , 如图所示 ,Pt(1) 电极的反应式为 ; 碱性条件下 , 用排出的含 的溶液吸收 NO 2 , 使其转化为 N 2 , 同时有 生成。若阳极转移电子 6 mol, 则理论上可处理 NO 2 气体 mol 。 - 8 - 一 二 - 9 - 一 二 - 10 - 一 二 解题指导 解答好本题一是要熟悉工业生产的原料、设备、基本原理以及相关反应方程式。二是关于相关计算 [ 如本题第 (3) 小问 ② ] 要采用关系式求解 , 利用原子守恒或得失电子守恒找出反应物和生成物之间的量的关系 , 然后根据相应数据列式计算。三是解答电解原理应用题目 , 首先要弄清楚图示中箭头走向 , 判断出反应物得失电子情况和生成物 , 然后根据守恒原理得出对应电极反应或相关计算结果。 - 11 - 一 二 方法规律拓展 无机化工流程题的审题角度 化工生产流程题中经常会出现一些表述性词语 , 这些表述性词语包含隐性信息 , 它可以暗示我们审题所应考虑的角度。常见的有 : (1)“ 控制较低温度 ”—— 常考虑物质的挥发 , 物质的不稳定性和物质的转化等。 (2)“ 加过量试剂 ”—— 常考虑反应完全或增大某种反应物的转化率等。 (3)“ 能否加其他物质 ”—— 常考虑会不会引入杂质或是否影响产品的纯度。 (4)“ 在空气中或在其他气体中 ”—— 主要考虑 O 2 、 H 2 O 、 CO 2 或其他气体是否参与反应或达到防氧化、防水解、防潮解等目的。 (5)“ 判断沉淀是否洗净 ”—— 常取少量最后一次洗涤液于试管中 , 向其中滴加某试剂 , 以检验其中的某种离子。 - 12 - 一 二 (6)“ 检验某物质的设计方案 ”—— 通常取少量某液体于试管中 , 加入另一试剂产生某现象 , 然后得出结论。 (7)“ 控制 pH”—— 常考虑防水解、促进生成沉淀或除去杂质等。 (8)“ 用某些有机试剂清洗 ”—— 常考虑降低物质溶解度有利于析出、减少损耗和提高利用率等。 - 13 - 一 二 对点训练 1 (2016 全国乙 )NaClO 2 是一种重要的杀菌消毒剂 , 也常用来漂白织物等 , 其一种生产工艺如下 : 回答下列问题 : (1)NaClO 2 中 Cl 的化合价为 。 (2) 写出 “ 反应 ” 步骤中生成 ClO 2 的化学方程式 。 - 14 - 一 二 (3)“ 电解 ” 所用食盐水由粗盐水精制而成 , 精制时 , 为除去 Mg 2+ 和 Ca 2+ , 要加入的试剂分别为 、 。 “ 电解 ” 中阴极反应的主要产物是 。 (4)“ 尾气吸收 ” 是吸收 “ 电解 ” 过程排出的少量 ClO 2 。此吸收反应中 , 氧化剂与还原剂的物质的量之比为 , 该反应中氧化产物是 。 (5)“ 有效氯含量 ” 可用来衡量含氯消毒剂的消毒能力 , 其定义是 : 每克含氯消毒剂的氧化能力相当于多少克 Cl 2 的氧化能力。 NaClO 2 的有效氯含量为 。 ( 计算结果保留两位小数 ) - 15 - 一 二 - 16 - 一 二 - 17 - 一 二 二、分离提纯型工艺流程题 例 2 卤素单质及其化合物在生产和生活中有广泛应用 : Ⅰ . 氟化钠主要用作农作物杀菌剂、杀虫剂、木材防腐剂。实验室以氟硅酸 (H 2 SiF 6 ) 等物质为原料 , 通过下图所示的流程制取较纯净的氟化钠 , 并得到副产品氯化铵 : - 18 - 一 二 已知 :20 ℃ 时氯化铵的溶解度为 37.2 g, 氟化钠的溶解度为 4 g,Na 2 SiF 6 微溶于水。请回答下列有关问题 : (1) 完成并配平上述流程中 ①② 的化学反应方程式 : ② 。 (2) 操作 Ⅲ 分为两步 , 其顺序是 ( 填序号 ) 。 A. 过滤 B. 加热浓缩 C. 冷却结晶 D. 洗涤 操作 Ⅱ 是洗涤、干燥 , 其目的是 , 在操作 Ⅰ , Ⅲ ~ Ⅴ 中与之相同的操作步骤是 。 (3) 流程 ① 中 NH 4 HCO 3 必须过量 , 其原因是 - 19 - 一 二 Ⅱ . 紫菜与海带类似 , 是一种富含生物碘的海洋植物 , 可用于食用补碘。以下为某兴趣小组模拟从紫菜中提取碘的过程 : 已知商品紫菜轻薄松脆、比海带更易被焙烧成灰 ( 此时碘转化为碘化物无机盐 ) 。 (4) 将焙烧所得的紫菜灰与足量的过氧化氢和稀硫酸作用 , 写出反应的离子方程式 : 。 - 20 - 一 二 (5) 操作 ① 中涉及两步操作 , 名称是 、 , 所用的主要玻璃仪器为 , 所用试剂 A 最好选用表格中的 ( 填试剂名称 ) 。 (6) 将下列装置图中缺少的必要仪器补画出来 , 最终将单质碘与试剂 A 分离。 - 21 - 一 二 - 22 - 一 二 - 23 - 一 二 解题指导 工艺流程题 分析问题的方法。 (1) 有些问题并不需要流程图中的信息就可回答。 (2) 有些问题只需要部分信息 , 并不需要看懂全部信息就可回答 , 题目给出完整的工业流程图是为了使其与实际工业生产相对应 , 所以不要纠缠于与问题无关的步骤之中。 (3) 当遇到问题无从解答时 , 要根据工业流程的目的思考 , 就会打开思路 , 找到解决问题的方法。 - 24 - 一 二 方法规律拓展 1 . 对原料进行预处理的常用方法。 (1) 研磨 : 减小固体颗粒 , 增大固体与液体或气体间的接触面积 , 加快反应速率。 (2) 水浸 : 与水接触反应或溶解。 (3) 酸浸 : 与酸接触反应或溶解 , 使可溶性金属离子进入溶液 , 不溶物通过过滤除去。 (4) 灼烧 : 除去可燃性杂质或使原料初步转化 , 如从海带中提取碘时 , 灼烧就是为了除去海带中的可燃性杂质。 (5) 煅烧 : 改变物质结构 , 并使一些杂质在高温下氧化、分解 , 如煅烧高岭土。 - 25 - 一 二 2 . 无机化工流程题常见设问方向 : (1) 反应速率与平衡理论的运用 ; (2) 氧化还原反应的判断、化学方程式或离子方程式的书写 ; (3) 利用控制 pH 分离除杂 ; (4) 化学反应的能量变化 ; (5) 实验基本操作 : 除杂、分离、检验、洗涤、干燥等 ; (6) 流程中的物质转化和循环 , 资源的回收和利用 ; (7) 环境保护与绿色化学评价。 - 26 - 一 二 对点训练 2 (2015 广西南宁模拟 ) 水处理技术在生产、生活中应用广泛 , 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。 (1) 下列试剂能够用于对饮用水进行杀菌消毒 , 且不会造成二次污染的是 ( 填字母 ) 。 A. 福尔马林 B. 漂白粉 C. 氯气 D. 臭氧 (2)Na 2 FeO 4 是一种新型水处理剂 , 工业上可用 FeSO 4 制备 , 其工艺流程如下 : - 27 - 一 二 ① 测得 FeSO 4 溶液中 c (Fe 2+ ) = a mol·L -1 , 若要处理 1 m 3 该溶液 , 理论上需要消耗 25% 的 H 2 O 2 溶液 kg( 用含 a 的代数式表示 ) 。 ② 写出由 Fe(OH) 3 制取 Na 2 FeO 4 的化学方程式 : 。 (3) 废旧电池若不进行回收利用 , 将对水体产生严重污染。某兴趣小组对废旧镍电池正极材料 [ 由 Ni(OH) 2 、炭粉、 Fe 2 O 3 等涂覆在铝箔上制成 ] 进行回收研究 , 设计实验流程如下图所示 : - 28 - 一 二 已知 : ① NiCl 2 易溶于水 ,Fe 3+ 不能氧化 Ni 2+ ,Cl 2 能氧化 Ni 2+ 为 Ni 3+ ; ② NiO+2HCl NiCl 2 +H 2 O; ③ Fe 3+ 、 Al 3+ 、 Ni 2+ 以氢氧化物形式沉淀时溶液的 pH 如表所示 : ④ K sp [Ni(OH) 2 ]=5.0×10 -16 , K sp (NiC 2 O 4 )=4.0×10 -10 。 - 29 - 一 二 请回答下列问题 : ① 加入盐酸酸溶后溶液中存在的金属阳离子为 。 ② 步骤 X 的操作为 。 ③ 写出加入 Na 2 C 2 O 4 溶液后反应的化学方程式 : 。 ④ 写出加入 NaOH 溶液所发生反应的离子方程式 : , 该反应的平衡常数为 。 ⑤ 用化学反应方程式表示沉淀 Ⅲ 转化为 Ni(OH) 3 : - 30 - 一 二 - 31 - 一 二 - 32 - 一 二 - 33 - 一 二查看更多