- 2021-05-08 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省泸县第五中学2019-2020学年高二下学期第一次在线月考试题
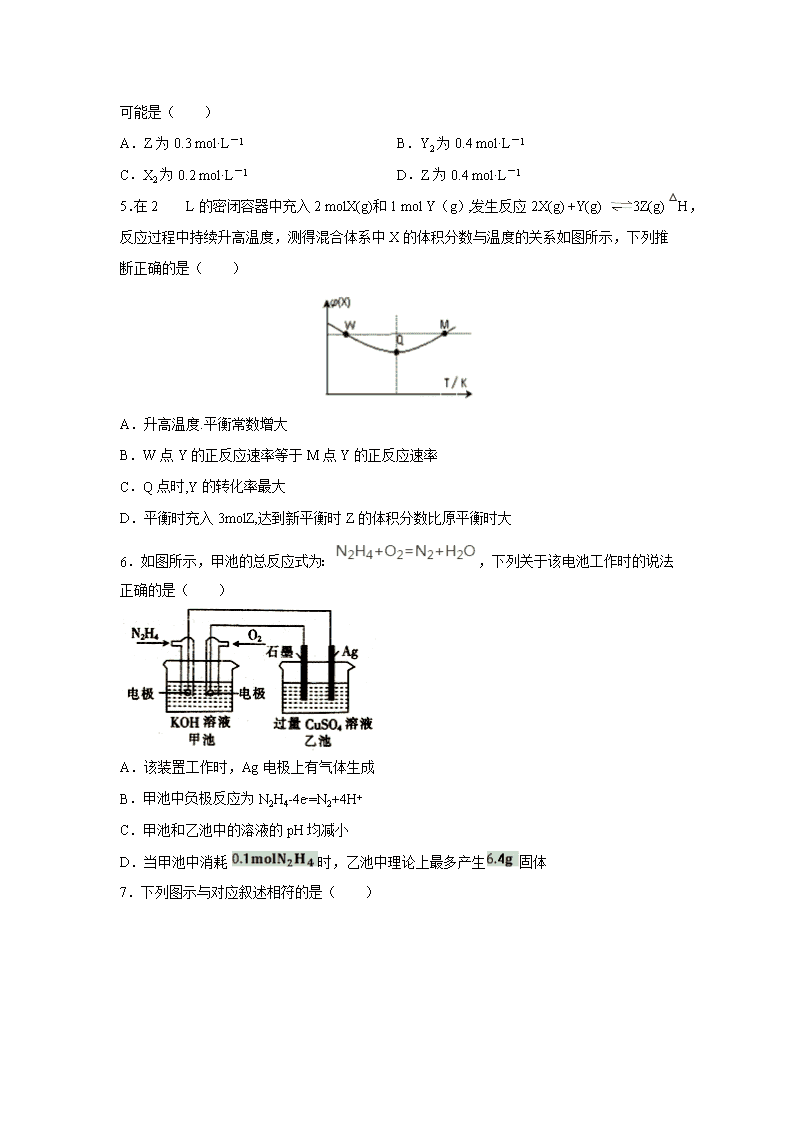
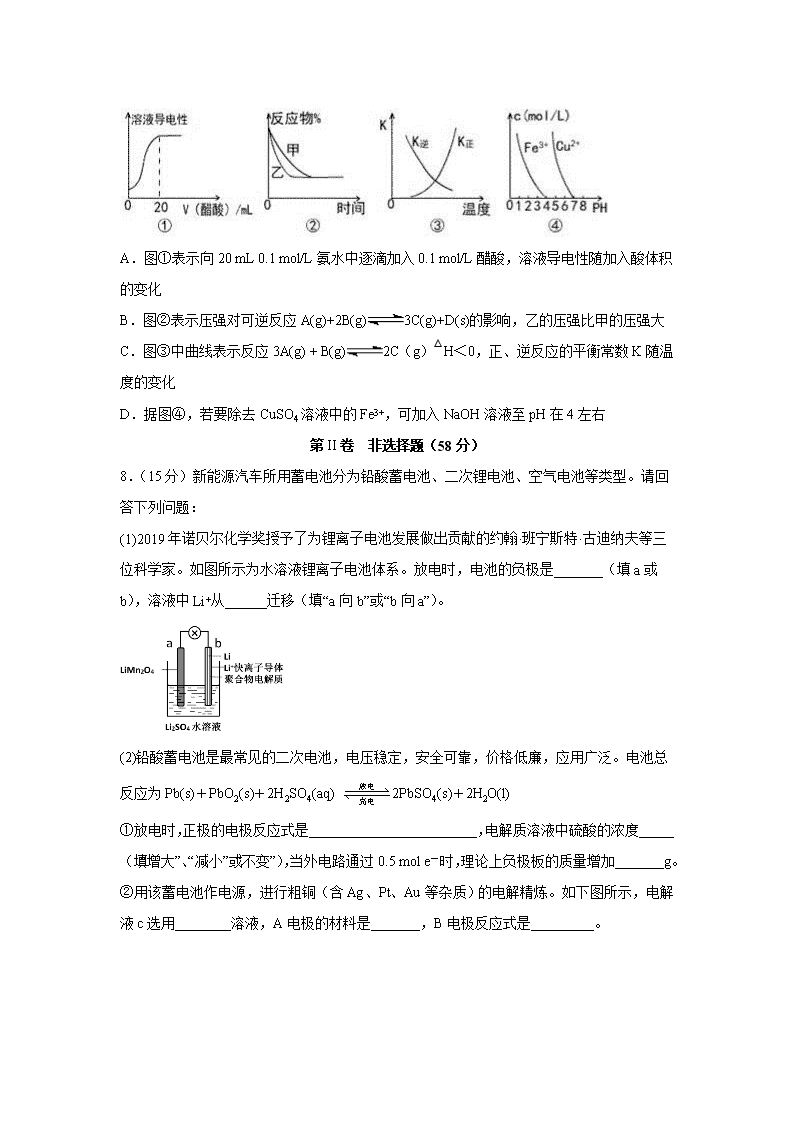
四川省泸县第五中学2019-2020学年高二下学期第一次在线月考试题 注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。 2.答题时请按要求用笔。 3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。 4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。 5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。 6.考试时间:150分钟;物理化学生物同堂分卷考试,物理110分,化学100分,生物分90分,共300分 7.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 23 P 31 S 32 Fe 56 Cu 64 第I卷 选择题(42分) 一、选择题(每小题6分,共7个小题,共42分;其中每题都为单选题。) 1.化学与社会生活密切相关,下列说法正确的是( ) A.军舰船底镶嵌锌块作正极,以防船体被腐蚀 B.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 C.金属冶炼过程是金属离子得电子变成金属单质的氧化过程 D.PM2.5颗粒微粒直径约为2.5×106m)分散在空气中形成气溶胶 2.25℃时,将0.1mol·L-1氨水溶液加水稀释,下列数值变大的是( ) A.c(OH-) B.pH C.Kb D.n(H+)·n(OH-) 3.下列措施中,不符合生产实际的是( ) A.电解法精炼粗铜,用纯铜作阴扱 B.利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连 C.为保护地下管道中的金属铁,可将其与锌极相连 D.在镀件上电镀锌,用锌作阳极 4.在密闭容器中进行反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1 ,在一定条件下,当反应达到平衡时,各物质的浓度可能是( ) A.Z为0.3 mol·L-1 B.Y2为0.4 mol·L-1 C.X2为0.2 mol·L-1 D.Z为0.4 mol·L-1 5.在2 L的密闭容器中充入2 molX(g)和1 mol Y(g),发生反应2X(g) +Y(g) 3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是( ) A.升高温度.平衡常数增大 B.W点Y的正反应速率等于M点Y的正反应速率 C.Q点时,Y的转化率最大 D.平衡时充入3molZ,达到新平衡时Z的体积分数比原平衡时大 6.如图所示,甲池的总反应式为:,下列关于该电池工作时的说法正确的是( ) A.该装置工作时,Ag电极上有气体生成 B.甲池中负极反应为N2H4-4e-=N2+4H+ C.甲池和乙池中的溶液的pH均减小 D.当甲池中消耗 时,乙池中理论上最多产生固体 7.下列图示与对应叙述相符的是( ) A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化 B.图②表示压强对可逆反应A(g)+2B(g)3C(g)+D(s)的影响,乙的压强比甲的压强大 C.图③中曲线表示反应3A(g) + B(g)2C(g)△H<0,正、逆反应的平衡常数K随温度的变化 D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右 第II卷 非选择题(58分) 8.(15分)新能源汽车所用蓄电池分为铅酸蓄电池、二次锂电池、空气电池等类型。请回答下列问题: (1)2019年诺贝尔化学奖授予了为锂离子电池发展做出贡献的约翰·班宁斯特·古迪纳夫等三位科学家。如图所示为水溶液锂离子电池体系。放电时,电池的负极是_______(填a或b),溶液中Li+从______迁移(填“a向b”或“b向a”)。 (2)铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉,应用广泛。电池总反应为Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l) ①放电时,正极的电极反应式是________________________,电解质溶液中硫酸的浓度_____(填“增大”、“减小”或“不变”),当外电路通过0.5 mol e-时,理论上负极板的质量增加_______g。 ②用该蓄电池作电源,进行粗铜(含Ag、Pt、Au等杂质)的电解精炼。如下图所示,电解液c选用________溶液,A电极的材料是_______,B电极反应式是_________。 ③用该蓄电池作电源,A、B为石墨电极,c为氯化钠溶液,进行电解。如上图所示,则A电极产生的气体是________,B电极附近溶液的pH_____(填“增大”、“减小”或“不变”)。 9.(14分)电解质溶液是中学化学中的非常重要的知识点,请根据要求填空。 (1)向NaHSO3溶液滴加石蕊溶液后变红,则HSO3-的电离程度___其水解程度(填“>”或“=”或“<”)。该物质能___(填“促进”或“抑制”)水的电离。 (2)酸碱中和滴定时,不宜用___(填“酚酞”“石蕊”或“甲基橙” )用作指示剂。用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是___(填字母)。 A.未用标准液润洗碱式滴定管 B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确 (3)醋酸(CH3COOH)是一种弱电解质,25℃时,醋酸的电离平衡常数表达式Ka=___。 ①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈___(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)___c(CH3COO-)(填“>”或“=”或“<”)。 ②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈___。若物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+)=c(CH3COO-),则混合后溶液呈___。 (4)现有a.醋酸、b.盐酸、c.硫酸三种溶液,根据要求答题。 ①若它们物质的量浓度相等,它们的pH由大到小的关系为___(用abc表示,下同)。 ②若它们的pH相等,它们物质的量浓度由大到小的关系为___。 ③若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为___。 10.( 15分)某化学兴趣小组要完成中和热的测定。 (1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol/L盐酸、0.55 mol/L NaOH溶液,实验尚缺少的玻璃用品是____________________________________________、________。 (2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?________(填“能”或“否”),其原因是___________________________________________________________。 (3)他们记录的实验数据如表: 实验用品 溶液温度 中和热 t1 t2 ΔH ① 50 mL0.55 mol/L NaOH溶液 50 mL0.5 mol/L HCl溶液 20 ℃ 23.3 ℃ ________ ② 50 mL0.55 mol/L NaOH溶液 50 mL0.5 mol/L HCl溶液 20 ℃ 23.5 ℃ 已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ/(℃·kg),各物质的密度均为1 g/cm3。 ①计算完成上表。 ②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:___________________________________。 (4)若用KOH代替NaOH,对测定结果_______________________________ (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果________(填“有”或“无”)影响。 11.(14分)某化学兴趣小组拟从I2-CCl4中提取碘并回收CCl4,查阅资料得到如下信息: I2 紫黑色晶体,沸点184.3 °C,易升华,升华后易凝华。在水中的溶解度很小,易溶于许多有机溶剂中 CCl4 无色有毒液体,沸点76.8℃,易挥发,与水互不相溶,可与乙醇、乙醚、氯仿及石油醚等混溶,不可燃烧,常作有机溶剂。 I.兴趣小组根据表中信息并结合已学知识,按上图组装仪器进行实验: (1)该装置中仪器A的名称是____________。 (2)锥形瓶置于冰水中的目的是_____________。 (3)实验结果发现得到的CCl4呈浅紫红色。为进一步提纯CCl4,拟采用除杂分液的方法进行提纯,则下列操作次序正确的是:_______________________________。 ①静置,待液体分层后,分液 ②加入稍过量的Na2SO3溶液 ③充分振荡,放气 ④将待分离溶液转移到分液漏斗中 ⑤对分液漏斗进行检漏 II.由于方法I没有达到预期目标,兴趣小组又设定如下方案进行实验: 已知:3I2+6NaOH=5NaI+NaIO3+3H2O (4)操作2的名称是____________。 (5)滴加少量硫酸时,溶液颜色变黄,试写出相应的离子方程式:________________。 (6)该实验中必须要控制NaOH溶液的浓度较_______(填“高”或“低”)和体积较_______(填“大”或“小”),理由是:__________ 【参考答案】 1.B 2.D 3.B 4.A 5.C 6.C 7.B 8.b b向a PbO2+2e-+4H++2SO42-═PbSO4+2H2O 减少 24 CuSO4(CuCl2等) 粗铜 Cu2++2e-=Cu 氯气 增大 9.> 抑制 石蕊 A、C Ka= 碱性 > 酸性 中性 a>b>c a>b>c b=c>a 10.量筒 温度计 否 金属易导热,热量散失多,导致误差偏大 -56.8 kJ/mol NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-56.8 kJ/mol 无 有 11.蒸馏烧瓶 冷却CCl4,防止CCl4 挥发造成空气污染 ⑤④②③① 过滤 5I- +IO3- + 6H+ = 3I2 + 3H2O 高 小 确保I2被NaOH溶液完全转化为离子进入水层,使V总较小,减少I2在水中的溶解损耗 查看更多