- 2021-05-08 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖北省恩施州2019-2020学年高二上学期期末考试化学试卷
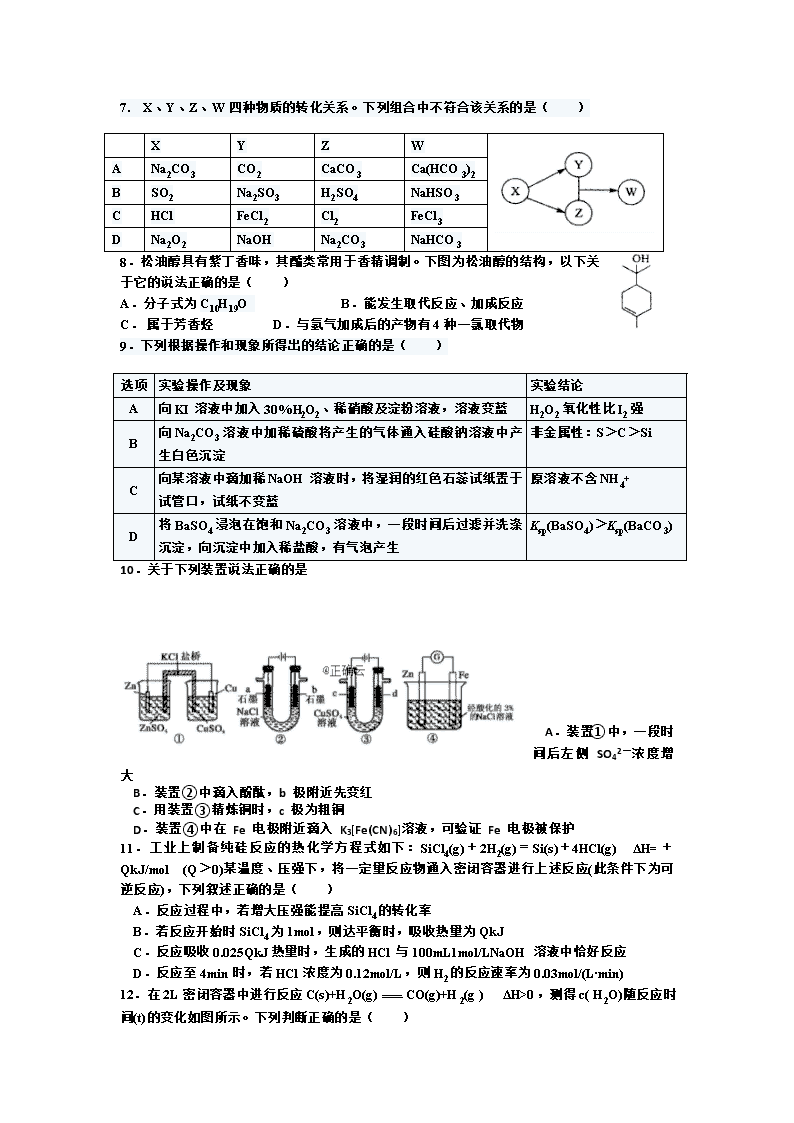
化学试题 可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 Si 28 第I卷(选择题,共42分) 一、选择题:本题共14小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.化学与生产、生活密切相关,下列说法正确的是( ) A.石油的分馏和煤的液化都是物理变化 B.聚乙烯塑料的老化是因为发生了加成反应 C.被称为“黑金”的新型纳米材料石墨烯属于有机化合物 D.利用化学工艺调整织物孔隙直径,可以制作出防水透气面料 2.常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A.加铝粉能放出氢气的溶液:Na+、NO3-、Cl-、Ba2+ B.滴加甲基橙显红色的溶液:K+、NH4+、Cl-、SO42- C.c(H+)/c(OH -)= 1013的溶液:Fe2+、Cl-、MnO4-、SO42- D.使红色石蕊试纸变蓝色的溶液:Na+、ClO-、Cl-、S2- 3.用NA表示阿伏伽德罗常数的值,下列说法正确的是( ) A.60 g SiO2晶体中含有Si—O键数目为2NA B.常温常压下,36g16O2中所含的中子数为16NA C.电解饱和食盐水,阳极上生成22.4L气体时转移的电子数为2NA D.密闭容器中2 mol NO与l mol O2充分反应,产物的分子数为2NA 4下列反应的离子方程式正确的是( ) A.石灰水中加入过量小苏打溶液: B.用石墨作电极电解AIC13溶液: C.酸性高锰酸钾溶液与H2O2溶液混合: D.0.2 mol/L的NH4Al( SO4)2溶液与0.3 mol/L的Ba( OH)2溶液等体积混合: 5.下列除杂方案合理的是 A.除去溴苯中少量的溴:加入苯萃取,分液 B.除去乙酸乙酯中的少量乙酸:加入饱和 Na2CO3 溶液,分液 C.除去乙烯中少量的 SO2:气体通过盛有酸性高锰酸钾溶液的洗气瓶 D.除去 MgCl2 溶液中少量的 FeCl3:加入稍过量氢氧化钠,过滤 6.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、6、8、8,它们的最外层电子数之和为10。下列说法正确的是( ) A.X的简单氢化物在同主族元素的氢化物中沸点最高,说明X的非金属性最强 B.工业生产中,通常用电解Z的熔融氧化物来制取Z的单质 C.X和Z形成的原子个数1:1的化合物中,既含有极性键又含有非极性键 D.W与Y可以形成离子化合物 7. X、Y、Z、W四种物质的转化关系。下列组合中不符合该关系的是( ) X Y Z W A Na2CO3 CO2 CaCO3 Ca(HCO3)2 B SO2 Na2SO3 H2SO4 NaHSO3 C HCl FeCl2 Cl2 FeCl3 D Na2O2 NaOH Na2CO3 NaHCO3 8.松油醇具有紫丁香味,其酯类常用于香精调制。下图为松油醇的结构,以下关于它的说法正确的是( ) A.分子式为C10H19O B.能发生取代反应、加成反应 C. 属于芳香烃 D.与氢气加成后的产物有4种一氯取代物 9.下列根据操作和现象所得出的结论正确的是( ) 选项 实验操作及现象 实验结论 A 向KI溶液中加入30%H2O2、稀硝酸及淀粉溶液,溶液变蓝 H2O2氧化性比I2强 B 将BaSO4浸泡在饱和Na2CO3溶液中,一段时间后过滤并洗涤沉淀,向沉淀中加入稀盐酸,有气泡产生 Ksp(BaSO4)>Ksp(BaCO3) C 向Na2CO3溶液中加稀硫酸将产生的气体通入硅酸钠溶液中产生白色沉淀 非金属性:S>C>Si D 向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 原溶液不含NH4+ 选项 实验操作及现象 实验结论 A 向KI溶液中加入30%H2O2、稀硝酸及淀粉溶液,溶液变蓝 H2O2氧化性比I2强 B 向Na2CO3溶液中加稀硫酸将产生的气体通入硅酸钠溶液中产生白色沉淀 非金属性:S>C>Si C 向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 原溶液不含NH4+ D 将BaSO4浸泡在饱和Na2CO3溶液中,一段时间后过滤并洗涤沉淀,向沉淀中加入稀盐酸,有气泡产生 Ksp(BaSO4)>Ksp(BaCO3) 10.关于下列装置说法正确的是 A.装置①中,一段时间后左侧 SO42-浓度增大 B.装置②中滴入酚酞,b 极附近先变红 C.用装置③精炼铜时,c 极为粗铜 D.装置④中在 Fe 电极附近滴入 K3[Fe(CN)6]溶液,可验证 Fe 电极被保护 11.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)=Si(s)+4HCl(g) ΔH=+QkJ/mol (Q>0)某温度、压强下,将一定量反应物通入密闭容器进行上述反应(此条件下为可逆反应),下列叙述正确的是( ) A.反应过程中,若增大压强能提高SiCl4的转化率 B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ C.反应吸收0.025QkJ热量时,生成的HCl与100mL1mol/LNaOH溶液中恰好反应 D.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L·min) 12.在2L密闭容器中进行反应C(s)+H2O(g)CO(g)+H2(g ) ΔH>0,测得c( H2O)随反应时间(t)的变化如图所示。下列判断正确的是( ) A.0—5 min内,v(H2) =0.05 mol/(L.min) B.5 min时该反应的v(正)大于11 min时的v(逆) C.5 min时该反应的K值一定小于12 min时的K值 D.10 min时,改变的外界条件可能是减小压强 13.常温下,将0.02mol/LMOH溶液逐滴滴入100mL0.01mol/LHA溶液中,溶液pH随滴入MOH溶液的体积变化如图所示。若忽略溶液混合时的体积变化,下列叙述正确的是( ) A.温度不变,滴入MOH溶液的过程中水的电离程度不变 B.X点MOH过量,故溶液中c(M+)>c(A-) C.HA为弱酸,MOH为强碱 D.Y点的c(MOH)+c(M+)=0.01mol/L 14.25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是 A.曲线b表示Cu(OH)2饱和溶液中的变化关系 B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1 D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液 第Ⅱ卷(非选择题,共58分) 二、非选择题(包括必考题和选考题两部分。第15题~第18题为必考题,每个题考生都必须作答。第19题~第20题为选考题,考生根据要求作答。) (一)必考题(本题包括5小题,共43分) 15.(5分) 短周期元素X、Y、Z、W的原子序数依次增加。甲、丙、戊是由这些元素组成的二元化合物。乙是元素W的单质,通常为黄绿色气体,丁的水溶液具有漂白性,0.01 mol/L戊溶液的pH为2,己通常是难溶于水的混合物。上述物质的转化关系如图所示。回答下列问题: (1)写出化合物丁的结构式_________________。 (2)X、Z元素可形成原子个数比为1∶1的化合物,它的电子式为 。 (3)X、Y元素组成的某化合物分子中含18个电子。10g该化合物在空气充分燃烧生成稳定的氧化物放出的热量为QkJ,写出表示该物质燃烧热的热化学方程式 。 (4)Z、W两种元素组成的化合物WZ2的用途有 。 16.(14分)氮氧化物是环境污染物,研究氮氧化物转化有重要的意义。回答下列问题: (1)催化转化器可使汽车尾气反应而转化: 2NO(g) +2CO(g)N2(g)+2CO2(g) ΔH 已知: 2C(s)+ O2(g)=2CO(g) ΔH1=akJ·mol-1 ; C(s)+ O2(g)=CO2(g) ΔH2=bkJ·mol-1; N2(g) + O2(g)=2NO(g) ΔH3=ckJ·mol-1 ΔH=______kJ·mol-1(用含a、b、c 的代数式表示) ; (2) T℃时,将等物质的量的NO 和CO 充入容积为1 L 的密闭容器中发生尾气转化反应,容器中NO 物质的量随时间变化如上图所示。 ①T℃时,该化学反应的平衡常数K= 。 ②下列事实能判断汽车尾气转化反应达到到化学平衡状态的是____________; A.体系中NO 的转化率和CO 的转化率相等 B.气体的密度不再变化 C.NO 消耗速率等于N2 消耗速率的2倍 D.混合气体平均相对分子质量不再变化 ③已知汽车尾气转化反应的ΔH<0。10min 后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系不正确的是____________。(填序号) (3) 碘蒸气存在能大幅度提高N2O 的分解速率,反应历程为: 第一步I2 (g)2I(g) (快反应) 第二步I(g)+N2O(g)→N 2(g)+IO(g) (慢反应) 第三步IO(g)+N2O(g)→N2 (g)+O2(g)+I(g)(快反应) 实验表明,含碘时N2O 分解速率方程v=k·c(N2O)·[c(I2)] 0.5(k为速率常数)。 下列表述不正确的是 (填标号)。 A.IO 为反应的中间产物 B.第二步活化能比第三步小 C.第二步对总反应速率起决定作用 D.N2O 分解反应中,k 值与是否含碘蒸气无关 (4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。 ①碱吸收的常见产物为NaNO2。常温下,pH=8 的NaNO2 溶液中c(Na+)-c(NO2-)= mol·L-1 (用精确值表示); ②碳还原法是在高温条件下将NO 与NO2 混合气体与焦炭反应,生成CO2 和N2,且物质的量之比为4:3,写出该方法的化学方程式 。 17.(11分)现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图1所示),并测定电离平衡常数Kb. (1)实验室可用浓氨水和X固体制取NH3,X固体不可以是 ; A.五氧化二磷 B.生石灰 C.碱石灰 D.无水氯化钙 (2)检验三颈瓶集满NH3的方法是 。 (3)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口, ,引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2所示。图2中 点时喷泉最剧烈。 (4)从三颈瓶中用 (填仪器名称)量取20.00 mL氨水至锥形瓶中,用0.05000 mol/L HC1滴定。用pH计采集数据、电脑绘制滴定曲线如图3所示。 (5)据图3计算,当pH=11.0时,NH3·H2O电离平衡常数Kb近似值,Kb 。 18.(13分)用钒钛磁铁矿为原料冶炼铁,产生一种固体废料,主要成分如下表。 通过下列工艺流程可以实现元素Ti、Al、Si的回收利用,并得到纳米二氧化钛和分子筛。 请回答下列问题: (1)步骤①②③中所用的玻璃仪器 。 (2)下列固体废料的成分中,不属于碱性氧化物的是 (填字母序号)。 a.TiO2 b. SiO2 c.MgO d.CaO (3)熔融温度和钛的提取率关系如右图,适宜温度为500℃,理由是 。 (4)滤液①中溶质的主要成分是 。 (5)步骤②中发生反应的离子方程式是 。 (6)将步骤③中制取分子筛的化学方程式补充完整: 根据成分表中数据,计算100kg固体废料,理论上应再加入Na2 Si03物质的量的计算式是n( Na2SiO3)= mol(摩尔质量/g/mol :SiO2 60 Al2O3 102)。 (二)选考题:15分。请考生从给出的2道试题中任选一题作答。 19.香料M的一种合成流程如下: 请回答下列问题: (1)M中含碳的官能团名称是___________;设计R→X和Y→Z步骤的目的是___________。 (2)A→B的反应类型是___________,B的名称是___________。 (3)R分子中最多有___________个原子共平面。 (4)R和M在下列仪器中信号完全相同的是___________(填字母) a质谱仪 b元素分析仪 c红外光谱仪 d核磁共振氢谱仪 (5)写出C和Z反应生成M的化学方程式:______________________。 (6)在Y的同分异构体中,同时满足下列条件的结构有___________种(不考虑立体异构)。 ①能发生银镜反应 ②遇氯化铁溶液发生显色反应 ③1mol有机物最多能消耗3 mol NaOH (7)已知苯环上有烃基时,新引入取代基主要取代邻位、对位氢原子。参照上述合成流程,设计以苯和异丙醇为原料制备Br的合成路线:______________________________(无机试剂任选) 20.【化学——选修3:物质结构与性质】(15分) 1.镁、硅及其化合物用途非常广泛。回答下列问题: (1)基态Si原子价层电子的电子排布式为__________,基态Mg原子电子占据最高能级的能层符号__________。 (2)Mg2C3与CaC2的结构相似,与水反应可生成H2C=C=CH2,H2C=C=CH2端位碳原子的杂化方式是__________,该反应所涉及的元素中电负性最小的是________(填元素符号),Mg2C3和H2C=C=CH2中均不存在_______(填字母)。 A.σ键 B.配位键 C.氢键 D.π键 (3)晶格能又叫点阵能。它是1 mol离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。MgO晶格能可通过图1的Born− Haber循环计算得到。 MgO的晶格能为__________kJ·mol−1,O=O键的键能为_________kJ·mol−1;Mg的第一电离能为__________kJ·mol−1; (4)Mg2Si晶胞结构如图2所示,已知其密度为1.84 g·cm−3,NA为阿伏加德罗常数的值。则晶胞参数a=__________nm(列出计算式即可)。 化学答案查看更多