高考化学考点39 化学平衡的移动
1
一、化学平衡的移动
1.化学平衡的移动
(1)定义
达到平衡状态的反应体系,条件改变,引起平衡状态被破坏的过程。
(2)化学平衡移动的过程
2.影响化学平衡移动的因素
(1)温度:在其他条件不变的情况下,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平
衡向放热反应方向移动。
(2)浓度:在其他条件不变的情况下,增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移
动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。
(3)压强:对于反应前后总体积发生变化的化学反应,在其他条件不变的情况下,增大压强,化学平
衡向气体体积减小的方向移动;减小压强,化学平衡向气体体积增大的方向移动。
(4)催化剂:由于催化剂能同时同等程度地增大或减小正反应速率和逆反应速率,故其对化学平衡的
移动无影响。
3.勒夏特列原理
在密闭体系中,如果改变影响化学平衡的一个条件(如温度、压强或浓度等),平衡就向能够减弱这种改
变的方向移动。
二、外界条件对化学平衡移动的影响
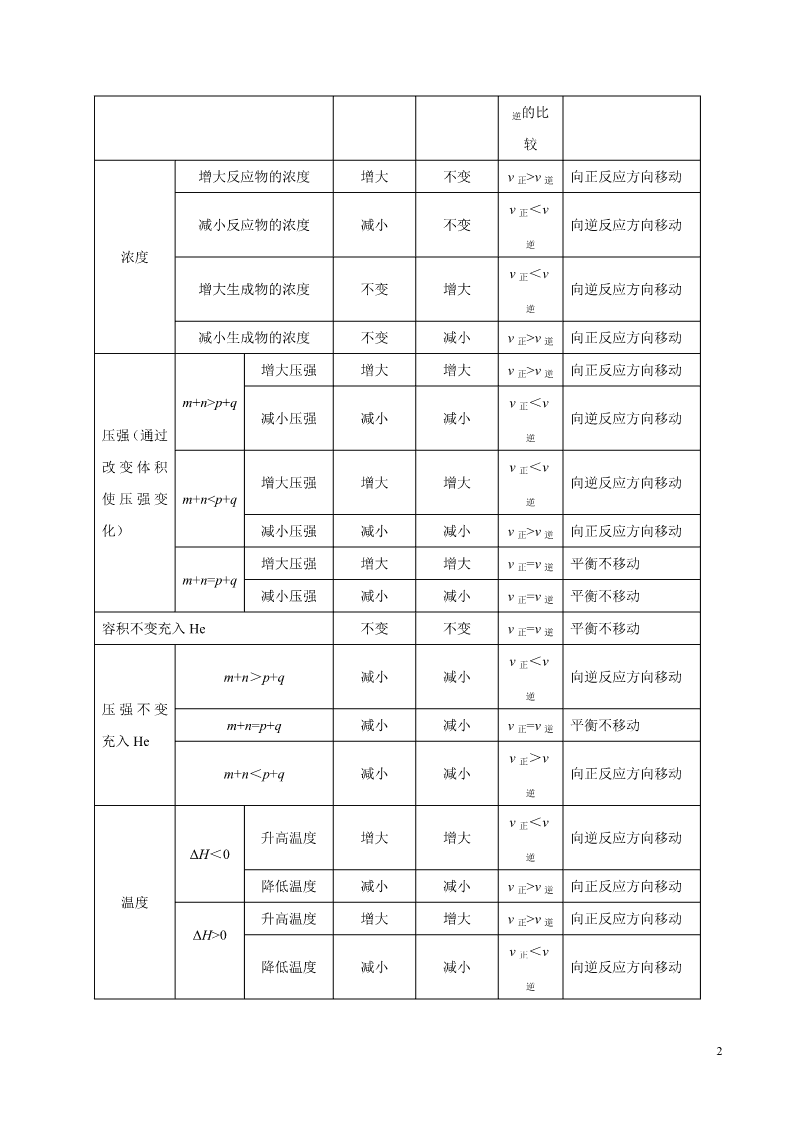
1.外界条件的变化对速率的影响和平衡移动方向的判断
在一定条件下,浓度、压强、温度、催化剂等外界因素会影响可逆反应的速率,但平衡不一定发生移
动,只有当 v 正≠v 逆时,平衡才会发生移动。对于反应 mA(g)+nB(g) pC(g)+qD(g),分析如下:
条件改变的时刻 v 正的变化 v 逆的变化 v 正与 v 平衡移动方向
2
逆的比
较
增大反应物的浓度 增大 不变 v 正>v 逆 向正反应方向移动
减小反应物的浓度 减小 不变
v 正<v
逆
向逆反应方向移动
增大生成物的浓度 不变 增大
v 正<v
逆
向逆反应方向移动
浓度
减小生成物的浓度 不变 减小 v 正>v 逆 向正反应方向移动
增大压强 增大 增大 v 正>v 逆 向正反应方向移动
m+n>p+q
减小压强 减小 减小
v 正<v
逆
向逆反应方向移动
增大压强 增大 增大
v 正<v
逆
向逆反应方向移动
m+n
v 逆 向正反应方向移动
增大压强 增大 增大 v 正=v 逆 平衡不移动
压强(通过
改 变 体 积
使 压 强 变
化)
m+n=p+q
减小压强 减小 减小 v 正=v 逆 平衡不移动
容积不变充入 He 不变 不变 v 正=v 逆 平衡不移动
m+n>p+q 减小 减小
v 正<v
逆
向逆反应方向移动
m+n=p+q 减小 减小 v 正=v 逆 平衡不移动
压 强 不 变
充入 He
m+n<p+q 减小 减小
v 正>v
逆
向正反应方向移动
升高温度 增大 增大
v 正<v
逆
向逆反应方向移动
ΔH<0
降低温度 减小 减小 v 正>v 逆 向正反应方向移动
升高温度 增大 增大 v 正>v 逆 向正反应方向移动
温度
ΔH>0
降低温度 减小 减小
v 正<v
逆
向逆反应方向移动
3
使用正催化剂 增大 增大 v 正=v 逆 平衡不移动
催化剂
使用负催化剂 减小 减小 v 正=v 逆 平衡不移动
2.浓度、压强和温度对平衡移动影响的几种特殊情况
(1)改变固体或纯液体的量,对平衡无影响。
(2)当反应混合物中不存在气态物质时,压强的改变对平衡无影响。
(3)对于反应前后气体体积无变化的反应,如 H2(g)+I2(g) 2HI(g),压强的改变对平衡无影响。但
增大(或减小)压强会使各物质的浓度增大(或减小),混合气体的颜色变深(或浅)。
(4)恒容时,同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响,增大(减小)浓度
相当于增大(减小)压强。
(5)在恒容容器中,当改变其中一种气态物质的浓度时,必然会引起压强的改变,在判断平衡移动的
方向和物质的转化率、体积分数变化时,应灵活分析浓度和压强对化学平衡的影响。若用 α 表示物质的转
化率,φ 表示气体的体积分数,则:
①对于 A(g)+B(g) C(g)类反应,达到平衡后,保持温度、容积不变,加入一定量的 A,则平衡向正
反应方向移动,α(B)增大而 α(A)减小,φ(B)减小而 φ(A)增大。
②对于 aA(g) bB(g)或 aA(g) bB(g)+cC(g)类反应,达到平衡后,保持温度、容积不变,加入一
定量的 A,平衡移动的方向、A 的转化率变化,可分以下三种情况进行分析:
特点 示例 改变 分析 移动方向 移动结果
Ⅰ
Δn>0 PCl5(g) PCl3(g)+Cl2(g) 充入 PCl5 c(PCl5)增大,v 正>v 逆,
但压强增大不利于 PCl5
的分解
α(PCl5)减小,
φ(PCl5)增大
Ⅱ
Δn=0 2HI(g) H2(g)+I2(g) 充入 HI c(HI)增大,v 正>v 逆,压
强增大,对 v 正、v 逆的
影响相同
α(HI)、φ(HI)
不变
Ⅲ
Δn<0 2NO2(g) N2O4(g) 充入 NO2 c(NO2)增大,v 正>v 逆,
同时压强增大更有利于
NO2 的转化
正反应方
向
α(NO2)增大,
φ(NO2)减小
三、化学平衡图象题的解题方法
化学平衡图象类试题是高考的热点题型,该类试题经常涉及到的图象类型有物质的量(浓度)、速率—时
间图象,含量—时间—温度(压强)图象,恒温、恒压曲线等,图象中蕴含着丰富的信息量,具有简明、直观、
4
形象的特点,命题形式灵活,难度不大,解题的关键是根据反应特点,明确反应条件,认真分析图象充分
挖掘蕴含的信息,紧扣化学原理,找准切入点解决问题。该类题型在选择题和简答题中都有涉及,能够很
好地考查学生分析问题和解决问题的能力,在复习备考中应引起足够的重视。
1.常见的化学平衡图象
以可逆反应 aA(g)+bB(g) cC(g) ΔH=Q kJ·mol−1
(1)含量—时间—温度(或压强)图:
(曲线 a 用催化剂,b 不用催化剂或化学计量数 a+b=c 时曲线 a 的压强大于 b 的压强)
(T2>T1,ΔH>0) (T1p2,a+b>c) (p1>p2,a+bc,则 p1> p2>p3,ΔH<0) (若 T1>T2,则 ΔH>0,a+b>c)
(3)速率−时间图象
根据 v−t 图象,可以很快地判断出反应进行的方向,根据 v 正、v 逆的变化情况,可以推断出外界条件的
改变情况。
以合成氨反应为例:N2(g)+3H2(g) 2NH3(g) ΔH<0。
条件 c(N2)增大 c(H2)减小 c(NH3)增大
v−t 图象
平衡移动方向 正反应方向移动 逆反应方向移动 逆反应方向移动
条件 c(NH3)减小 增大压强 减小压强
v−t 图象
平衡移动方向 正反应方向移动 正反应方向移动 逆反应方向移动
条件 升高温度 降低温度 使用催化剂
v−t 图象
平衡移动方向 逆反应方向移动 正反应方向移动 不移动
(4)其他
6
如下图所示曲线,是其他条件不变时,某反应物的最大转化率(α)与温度(T)的关系曲线,图中标出的 1、
2、3、4 四个点,v(正)>v(逆)的点是 3,v(正)T1,正反应是放热反应。
图 B 表示 p1c。
四、等效平衡
1.含义
(1)化学平衡状态与建立平衡的条件有关,与建立平衡的途径无关。
(2)对于同一可逆反应,在一定条件(恒温恒容或恒温恒压)下,无论是从正反应(反应物)、逆反应(生
成物)或从中间状态(既有反应物、也有生成物)开始,只要建立平衡后,平衡混合物中各组分的比例相同,
或各组分在混合物中的百分含量相等,这样的化学平衡互称为等效平衡。
(3)注意只是组分的百分含量相同,包括体积百分含量、物质的量百分含量或质量百分含量,而各组
分的浓度不一定相等。
2.审题方法
(1)注意反应特点:反应前后气体的物质的量是否发生变化。
(2)分清平衡建立的条件:是恒温恒压还是恒温恒容。
3.理解等效平衡的意义
(1)对于反应前后气体物质的量有变化的反应,如 2SO2(g)+O2(g) 2SO3(g)等温等压、等温等容下
建立平衡如下图:
8
容易得出 A 与 C 等效,A 与 D 不等效。因为 C→D 是对反应前后气体体积有变化的反应加压,平衡发
生了移动。
结论:对于反应前后气体物质的量有变化的反应,恒温恒压时只要起始加入的物质按方程式化学计量
数转化到方程式一侧,比例相同就可建立等效平衡;而恒温恒容时,则需起始加入的物质按方程式化学计
量数转化到方程式一侧,完全相同才能建立等效平衡,因为反应物物质的量的变化会引起平衡的移动。
(2)对于反应前后气体物质的量没有变化的反应,如:H2(g)+I2(g) 2HI(g)等温等压、等温等容下
建立平衡如下图:
容易得出 A 与 C 等效,A 与 D 等效。因为 C→D 平衡不发生移动。对反应前后气体体积不变的反应加
压,平衡不移动。
结论:对于反应前后气体物质的量不变的反应,无论是恒温恒压还是恒温恒容,只要加入的物质按方
程式化学计量数转化到方程式一侧,比例相同就可建立等效平衡。
考向一 外界条件对化学平衡的影响
典例 1 将 NO2 装入带活塞的密闭容器中,当反应 2NO2(g) N2O4(g)达到平衡后,改变下列一个条件,
其中叙述正确的是
9
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
【答案】C
1.在密闭容器中通入 A、B 两种气体,在一定条件下反应:2A(g)+B(g) 2C(g) ΔH<0。达到平衡后,改
变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
X Y
A 再加入 A B 的转化率
B 再加入 C A 的转化率
C 增大压强 A 的质量分数
D 升高温度 混合气体平均摩尔质量
解答化学平衡移动题目的思维模型
=正 逆
正 逆
正、逆速率不变:如容积不变,充入稀有气体,平衡不移动
使用催化剂
程度相同 气体体积无变化 平衡不移动
的反应改变压强改变条件 正、逆速率改变
浓度
程度不同 压强 平衡移动
温度
v v
v v
10
考向二 化学平衡移动结果的分析与判断
典例 1 在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温
度,容器内气体的密度增大,则下列叙述正确的是
A.若正反应是吸热反应,则 A 为非气态
B.若正反应是放热反应,则 A 为非气态
C.在平衡体系中加入少量 C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动一定无影响
【答案】A
2.在容积固定的密闭容器中充入一定量的 X、Y 两种气体,一定条件下发生可逆反应 3X(g)+Y(g)
2Z(g),并达到平衡。已知正反应是放热反应,测得 X 的转化率为 37.5%,Y 的转化率为 25%。下列有关
叙述正确的是
A.若 X 的反应速率为 0.2 mol·L−1·s−1,则 Z 的反应速率为 0.3 mol·L−1·s−1
B.若向容器中充入氦气,压强增大,Y 的转化率提高
11
C.升高温度,正反应速率减小,平衡向逆反应方向移动
D.开始充入容器中的 X、Y 物质的量之比为 2∶1
构建“虚拟的第三平衡”法解决平衡间的联系
在解题时若遇到比较条件改变后的新、旧平衡间某量的关系有困难时,可以考虑构建一个与旧平衡等
效的“虚拟的第三平衡”,然后通过压缩或扩大体积等手段,再与新平衡沟通,以形成有利于问题解决的新模
式,促使条件向结论转化,例如:
(1)构建等温等容平衡思维模式:新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当
于增大压强。
(2)构建等温等压平衡思维模式(以气体物质的量增加的反应为例,见图示):新平衡状态可以认为是
两个原平衡状态简单的叠加,压强不变,平衡不移动。
考向三 借助图象判断化学平衡的移动
典例 1 甲烷蒸气的转化反应为 CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0,工业上可利用此反应生产合成氨
原料气 H2。下列有关该反应的图象正确的是
12
【答案】C
3.向绝热恒容密闭容器中通入 SO2 和 NO2,一定条件下使反应 SO2(g)+NO2(g) SO3(g)+NO(g)达到平
衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
A.反应在 c 点达到平衡状态
B.反应物浓度:a 点小于 b 点
C.升高温度该平衡正向移动
D.Δt1=Δt2 时,SO2 的转化率:a~b 段小于 b~c 段
13
考向四 化学平衡图象的综合分析
典例 1 运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2 催化氧化生成 SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中 SO3 的百分含量
和温度的关系如图 1 所示(曲线上任何一点都表示平衡状态)。
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态 D 时,v 正________(填“>”“<”或“=”)v 逆。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g) 2NH3(g) ΔH<0,应用此法反应达到平衡
时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L 的密闭容器中发生合成氨的反应,图 2 表示 N2 的物质的量随时间的变化曲线。
用 H2 表示 0~10 min 内该反应的平均速率 v(H2)=________。从第 11 min 起,压缩容器的体积为 1 L,
则 n(N2)的变化曲线为________(填编号)。
【解析】(1)①恒压条件下向题述平衡体系中通入氦气,则反应器的体积会增大,各物质的浓度会减
小,平衡会向气体分子数增大的方向(向左)移动。②反应进行到状态 D 时没有达到平衡,需要反应向右进行,
所以 v 正>v 逆。
14
【答案】(1)①向左 ②>
(2)①D ②0.06 mol·L-1·min-1 d
4.乙苯催化脱氢制苯乙烯的反应:
+H2(g) ΔH=+124 kJ·mol−1
工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为 1∶9),控制反应温度
600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂
作用下苯乙烯的选择性(指除了 H2 以外的产物中苯乙烯的物质的量分数)示意图如下:
(1)掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实: 。
(2)控制反应温度为 600 ℃的理由是 。
考向五 等效平衡
典例 1 在密闭容器中进行 N2+3H2 2NH3 反应,起始时 N2 和 H2 分别为 10 mol 和 30 mol,当达到平
衡时,N2 的转化率为 30%。若以 NH3 作为起始反应物,反应条件与上述反应相同时,要使其反应达到
平衡时各组成成分的物质的量分数与前者相同,则 NH3 的起始物质的量和它的转化率正确的是
A.40 mol 35% B.20 mol 30% C.20 mol 70% D.10 mol 50%
15
【答案】C
5.将 2 mol A 和 1 mol B 充入某密闭容器中发生反应:2A(g)+B(g) xC(g),达到化学平衡后,C 的体积
分数为 a,假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是
A.若在恒温恒压下:当 x=1 时,按 1.5 mol A、1 mol C 作为起始物质,达到平衡后,C 的体积分数仍为 a
B.若在恒温恒容下:当 x=2 时,将 3 mol C 作为起始物质,达到平衡后,C 的体积分数仍为 a
C.若在恒温恒压下:当 x=3 时,按 1 mol A、1 mol B、1 mol C 作为起始物质,达到平衡后,C 的体积
分数为 a
D.若在恒温恒容下:按 0.6 mol A、0.3 mol B、1.4 mol C 作为起始物质,达到平衡后,C 的体积分数仍
为 a,则 x 为 2 或 3
1.已知反应 C(s)+H2O(g) CO(g)+H2(g) ΔH 在一定温度和压强下于密闭容器中达到平衡。下列叙述
正确的是
A.升高温度,平衡常数 K 增大,则 ΔH<0
B.缩小容器体积,c(CO)减小
C.更换高效催化剂, H2O(g)的转化率增大
D.恒压条件下,充入一定量的氮气,n(H2)增大
16
2.在恒温恒容密闭容器中分别充入 A、B、C 三种气体,一定条件下发生反应,各物质浓度随时间的变化
曲线如图 1 所示。若从 t2 min 开始,每个时刻只改变一个且不同的条件,物质 C 的正、逆反应速率随时
间的变化曲线如图 2 所示。下列说法不正确的是
A.t2 min 时改变的条件可能是增大压强或加入催化剂
B.该反应的正反应为放热反应
C.0~t1 min 内 A 与 B 的平均反应速率之比为 3∶2
D.该反应中 C 一定为产物
3.某恒容密闭容器中 CH4、H2O(g)的起始浓度分别为 1.8 mol·L-1 和 3.6 mol·L-1,二者反应生成 CO2 和 H2,
该反应过程中部分物质的浓度随时间变化的曲线如图(部分时间段的浓度变化未标出),其中第 6 min 开始
升高温度。下列有关判断正确的是
A.X 是 H2 B.增大压强,平衡逆向移动,平衡常数减小
C.第一次平衡时的平衡常数约为 0.91 D.该反应为放热反应
4.在恒容密闭容器中通入物质的量浓度均为 0.1 mol·L-1 的 CH4 与 CO2,在一定条件下发生反应:CO2(g)+
CH4(g) 2CO(g)+2H2(g),测得 CH4 的平衡转化率与温度及压强的关系如图所示,下列有关说法一
定正确的是
17
A.上述反应的 ΔH>0
B.压强 p1>p2>p3>p4
C.1 100 ℃该反应的平衡常数为 64
D.压强为 p4 时,在 Y 点:v(正)T1)其他条件相同时,下列图象正确的是
A. B.
C. D.
6.已知 2SO2(g)+ O2(g) 2SO3(g) ΔH=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:
(甲)2 mol SO2 和 1 mol O2;(乙) 1 mol SO2 和 0.5 mol O2;(丙) 2 mol SO3。在恒温、恒容条件下反应达到
平衡时,下列关系一定正确的是
A.容器内压强 p:p 甲=p 丙>2p 乙
B.SO3 的质量 m:m 甲=m 丙>2m 乙
C.c(SO2)与 c(O2)之比 k:k 甲=k 丙>k 乙
D.反应放出或吸收热量的数值 Q:Q 甲=Q 丙>2Q 乙
7.在恒温恒压下,向密闭容器中充入 4 mol SO2 和 2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g)
ΔH<0。2 min 后,反应达到平衡,生成 SO3 为 1.4 mol,同时放出热量 Q kJ。则下列分析正确的是
A.在该条件下,反应前后的压强之比为 6∶5.3
18
B.若反应开始时容器体积为 2 L,则 v(SO3)=0.35 mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后 n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于 Q kJ
8.在恒温恒容的密闭容器中,发生反应 3M(g)+N(g) xP(g)(注:x 为 P 物质前的系数)。
①将 3 mol M 和 2 mol N 在一定条件下反应,达平衡时 P 的体积分数为 a;
②若起始时 M、N、P 投入的物质的量分别为 n(M)、n(N)、n(P),平衡时 P 的体积分数也为 a。
下列说法正确的是
A.若①达平衡时,再向容器中各增加 1 mol M、N、P,则 N 的转化率一定增大
B.若向①平衡中,再加入 3 mol M 和 2 mol N,P 的体积分数若大于 a,可断定 x>4
C.若 x=2,则②体系起始物质的量应当满足 3n(N)=n(M)
D.若②体系起始物质的量满足 3n(P)+ 8n(M)=12n(N),可断定 x=4
9.工业上可用 CO2 与 H2 反应生成甲醇,在 T ℃下,将 1 mol CO2 和 2 mol H2 充入 5 L 恒容密闭容器中发生
反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得 H2 的物质的量随时间的变化情况如下图中曲线Ⅰ
所示。
(1)按曲线Ⅰ计算反应从 0 到 4 min 时,v(H2)=____________________。
(2)在 T ℃时,若仅改变某一外界条件时,测得 H2 的物质的量随时间的变化情况如图中曲线Ⅱ所示,
则改变的外界条件为_______________________________________________;反应按曲线Ⅱ进行,计算达
到平衡时容器中 c(CO2)=______________。
(3)判断该反应达到平衡的依据为________(填字母)。
A.混合气体的平均相对分子质量不随时间改变
B.3v(H2)正=v(CH3OH)逆
C.混合气体的压强不随时间改变
D.单位时间内生成 CH3OH 和 H2O 的物质的量相同
10.碳、氮及其化合物是同学们经常能接触到的重要物质,是科学研究的重要对象。
19
(1)H2NCOONH4 是工业合成尿素的中间产物,该反应的能量变化如图甲所示。用 CO2 和氨气合成尿
素的热化学方程式为________________________________________。
(2)合理利用 CO2、CH4,抑制温室效应成为科学研究的新热点。一种以二氧化钛表面覆盖 Cu2Al2O4
为催化剂,可以将 CO2 和 CH4 直接转化成乙酸(ΔH<0)。在不同温度下催化剂的催化效率与乙酸的生成
速率分别如图乙所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是________________。250
℃和 400 ℃时乙酸的生成速率几乎相等,实际生产中应选择的温度为________℃。
(3)T ℃时,将等物质的量的 NO 和 CO 充入体积为 2 L 的密闭容器中发生反应 2NO+2CO2CO2+N2。
保持温度和体积不变,反应过程中 NO 的物质的量随时间的变化如图丙所示。
①平衡时若保持温度不变,再向容器中充入 CO、N2 各 0.8 mol,平衡将________(填“向左”“向右”或“不”)
移动。
②图中 a、b 分别表示在一定温度下,使用相同质量、不同表面积的催化剂时,达到平衡过程中 n(NO)
的变化曲线,其中表示催化剂表面积较大的曲线是________(填“a”或“b”)。
③15 min 时,若改变外界反应条件,导致 n(NO)发生如图所示的变化,则改变的条件可能是________(任
答一条即可)。
1.[2018 天津]室温下,向圆底烧瓶中加入 1 molC2H5OH 和含 1molHBr 的氢溴酸,溶液中发生反应;
C2H5OH+HBr C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br 和 C2H5OH 的沸点分别为
38.4℃和 78.5℃。下列有关叙述错误的是
A.加入 NaOH,可增大乙醇的物质的量
B.增大 HBr 浓度,有利于生成 C2H5Br
20
C.若反应物增大至 2 mol,则两种反应物平衡转化率之比不变
D.若起始温度提高至 60℃,可缩短反应达到平衡的时间
2.[2017 江苏][双选]温度为 T1 时,在三个容积均为 1 L 的恒容密闭容器中仅发生反应:2NO2(g)
2NO(g)+O2 (g) (正反应吸热)。实验测得:v 正= v(NO2)消耗=k 正 c2(NO2),v 逆=v(NO)消耗=2v(O2)消耗=k 逆
c2(NO)·c(O2),k 正、k 逆为速率常数,受温度影响。下列说法正确的是
A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5
B.达平衡时,容器Ⅱ中 比容器Ⅰ中的大
C.达平衡时,容器Ⅲ中 NO 的体积分数小于 50%
D.当温度改变为 T2 时,若 k 正=k 逆,则 T2> T1
3.[2016 江苏][双选]一定温度下,在 3 个体积均为 1.0 L 的恒容密闭容器中反应
2H2(g)+CO(g) CH3OH(g)达到平衡。下列说法正确的是
物质的起始浓度/mol·L−1 物质的平衡浓度/mol·L−1
容器 温度/K
c(H2) c(CO) c(CH3OH) c(CH3OH)
Ⅰ 400 0.20 0.10 0 0.080
Ⅱ 400 0.40 0.20 0
Ⅲ 500 0 0 0.10 0.025
A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中 c(H2)大于容器Ⅲ中 c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
4.[2016 四川]一定条件下,CH4 与 H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),设起始 =Z,
在恒压下,平衡时 (CH4)的体积分数与 Z 和 T(温度)的关系如图所示。下列说法正确的是
2
2
O
NO
c
c
2
4
(H O)
(CH )
n
n
21
A.该反应的焓变 ΔH>0
B.图中 Z 的大小为 a>3>b
C.图中 X 点对应的平衡混合物中 =3
D.温度不变时,图中 X 点对应的平衡在加压后 (CH4)减小
5.[2015 江苏][双选]在体积均为 1.0 L 的两恒容密闭容器中加入足量的相同的炭粉,再分别加入 0.1 mol CO2
和 0.2 mol CO2,在不同温度下反应 CO2(g)+C(s) 2CO(g)达到平衡,平衡时 CO2 的物质的量浓度 c(CO2)
随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.反应 CO2(g)+C(s) 2CO(g)的 ΔS>0、ΔH<0
B.体系的总压强 p 总:p 总(状态Ⅱ)>2p 总(状态Ⅰ)
C.体系中 c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率 v 逆:v 逆(状态Ⅰ)>v 逆(状态Ⅲ)
6.[2017 新课标Ⅱ]丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制 1−丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ O2(g)= C4H8(g)+H2O(g) ΔH2=−119 kJ·mol−1
③H2(g)+ O2(g)= H2O(g) ΔH3=−242 kJ·mol−1
反应①的 ΔH1 为________kJ·mol−1 。图(a)是反应①平衡转化率与反应温度及压强的关系图,
2
4
(H O)
(CH )
n
n
1
2
1
2
22
x_________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出
口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中 n(氢气)/n(丁烷)的关系。图中曲线
呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。
丁烯产率在 590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率
快速降低的主要原因可能是_____________。
1.【答案】A
【解析】达平衡后,再加入 A,平衡正向移动,促进 B 的转化,即 B 的转化率增大,与图象符合,A 正确;
达平衡后,再加入 C,化学平衡逆向移动,则 A 的转化率减小,与图象不符合,B 错误;达平衡后,增大
压强,平衡正向移动,则 A 的质量分数减小,与图象不符合,C 错误;达平衡后,升高温度,化学平衡逆
向移动,由 M= 可知,反应逆向进行时 n 增大,m 不变,则混合气体平均摩尔质量减小,与图象不符合,
D 错误。
2.【答案】D
【解析】化学反应速率之比等于化学方程式化学计量数之比,若 X 的反应速率为 0.2 mol·L−1·s−1,则 Z
的反应速率为 mol·L−1·s−1,A 错误;若向容器中充入氦气,恒容容器充入惰性气体,总压增大,分
压不变,平衡不移动,Y 的转化率不变,B 错误;升高温度,正、逆反应速率均增大,平衡向逆反应方
向移动,C 错误;设开始充入容器中的 X、Y 分别为 x mol 和 y mol,Y 的变化量为 a mol,由转化率可
知 ∶ =37.5%∶25%,所以开始充入容器中的 X、Y 物质的量之比为 2∶1,D 正确。
m
n
0.4
3
3a
x
a
y
23
4.【答案】(1)正反应方向气体分子数增加,加入水蒸气稀释,相当于起减压的效果
(2)600 ℃时,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;温度过高,
选择性下降。高温还可能使催化剂失活,且能耗大
【解析】(1)因为该容器内保持恒压,掺入水蒸气,相当于增大了容器的体积,而该反应的正反应是气
体的物质的量增大的反应,化学平衡向右移动,提高了乙苯的平衡转化率。
(2)从图象可知,600 ℃时,乙苯的转化率和苯乙烯的选择性均较高。如果温度过低,反应速率慢且转
化率低;如果温度过高,选择性下降。且高温还可能使催化剂失去活性,同时还会消耗更多的能量。
5.【答案】D
【解析】恒温恒压时,极值等比时两平衡等效,在 A 项中: = ≠ ,在 C 项中 =
= ≠ ,A、C 错误;恒温恒容下,当 x=2 时,将 3 mol C 作为起始物质,通过反应的化学计量数之比换
算成 A 和 B 的物质的量,则相当于起始时有 3 mol A 和 1.5 mol B,与起始充入 2 mol A 和 1 mol B 相比,
压强增大,平衡右移,达平衡后,C 的体积分数增大,B 错误;若在恒温恒容下,按 0.6 mol A、0.3 mol
B、1.4 mol C 作起始物质,若是 x=2,通过反应的化学计量数之比换算成 A 和 B 的物质的量分别为 2 mol
A、1 mol B,与原反应等效;但是若 x=3 时,反应方程式两边的气体化学计量数之和相等,压强不影响
平衡,由于加入的 A、B 的物质的量满足 2∶1,达到平衡时与原平衡也是等效平衡,所以 x=2、x=3 都
可以,D 正确。
1.【答案】D
【解析】本题考查影响化学平衡移动的因素,意在考查考生的分析能力。升高温度,平衡常数 K 增大,
说明平衡向正反应方向移动,故该反应的正反应是吸热反应,ΔH>0,A 错误;该反应为气体分子数增大
的反应,因此缩小容器体积,相当于增大压强,平衡逆向移动,n(CO)减小,但根据勒夏特列原理可知,
A
B
n
n
1.5 2 mol
1mol
2
1
A
B
n
n
21 3
11 3
5
4
2
1
24
c(CO)增大,B 错误;催化剂对化学平衡移动无影响,因此更换高效催化剂,H2O(g)的转化率不变,C 错
误;恒压条件下充入 N2,容器的体积增大,各组分浓度降低,相当于减小压强,则平衡正向移动,n(H2)
增大,D 正确。
3.【答案】C
【解析】本题考查化学平衡,意在考查考生对化学平衡理论的理解及应用能力。该反应为
CH4(g)+2H2O(g) CO2(g)+4H2(g),根据题图知,0~4 min 内 CH4 减少的浓度为 0.5 mol·L-1,X 增加的浓
度为 0.5 mol·L-1,故 X 为 CO2,A 错误;温度不变时,增大压强,平衡常数不变,B 错误;反应在第 4 min
时第一次达到平衡状态,根据三段式法,有:
平衡常数 K≈0.91,C 正确;第 9 min 平衡时,根据三段式法,有:
平衡常数 K= ≈300.5>0.91,故升高温度,平衡正向移动,该反应为吸热反应,D 错误。
【备注】CH4(g)+2H2O(g) CO2(g)+4H2(g)
起始(mol·L-1) 1.8 3.6 0 0
4
2
4.4 1.1
0.7 1.4
25
转化(mol·L-1) 0.5 1.0 0.5 2.0
平衡(mol·L-1) 1.3 2.6 0.5 2.0
CH4(g)+2H2O(g) CO2(g)+4H2(g)
起始(mol·L-1) 1.8 3.6 0 0
转化(mol·L-1) 1.1 2.2 1.1 4.4
平衡(mol·L-1) 0.7 1.4 1.1 4.4
4.【答案】A
【解析】A 项,温度越高,转化率越大,升温平衡右移,ΔH>0,正确;B 项,增大压强,平衡左移,CH4
的转化率减小,所以 p4>p3>p2>p1,错误;C 项,
CO2(g)+CH4(g) 2CO(g)+2H2(g)
起始/mol·L-1 0.1 0.1 0 0
平衡/mol·L-1 0.1-x 0.1-x 2x 2x
×100%=80%
x=0.08
K= =1.638 4,错误;D 项,Y 点未达平衡,若要达平衡,CH4 的转化率应增大,所以 v(正)>
v(逆)。
6.【答案】B
【解析】将丙容器中,起始投料全部转化为左边的物质,可知甲和丙为等效平衡,则 p 甲=p 丙、m 甲=m
丙、k 甲=k 丙,Q 甲+Q 丙=197 kJ。甲和乙的比较可用如图所示帮助理解:
经过变化 1 后,两个容器为等效平衡,去掉隔板,乙容器和“乙+乙”容器中浓度、压强等均相等;经过
26
变化 2 后,容器甲的体积比“乙+乙”的缩小一半,若平衡不发生移动,则压强为原来的 2 倍,但体积减
小,压强增大,平衡正向移动,则 SO3 的质量:m甲>2m 乙,总物质的量减小,导致平衡压强减小,故 p
甲<2p 乙,放出或吸收的热量:Q甲<2Q 乙,因甲、乙两容器中起始投入的 SO2 与 O2 的物质的量之比为 2∶1(即
化学计量数之比),两者在反应中按照 2∶1 的比例转化,故达到平衡时,两容器中 c(SO2)与 c(O2)之比仍
为 2∶1,即 k 甲=k 乙。
7.【答案】C
【解析】由平衡时 n(SO3)=1.4 mol 可知此时 n(SO2)=2.6 mol,n(O2)=1.3 mol。A 选项,因是恒温恒压
条件,所以反应前后压强不变;B 选项,因该反应是气体分子数之和变小的反应,所以随着反应的进行,
体积逐渐变小,小于 2 L,所以 v(SO3)大于 0.35 mol/(L·min);C 选项,该反应为放热反应,在绝热条件
下随着反应的进行要放热,达到平衡时与恒温恒压条件下的平衡比较,平衡要逆向移动,所以
n(SO3)<1.4 mol;D 选项,恒温恒容条件下的平衡与原来恒温恒压下的平衡比较,平衡要逆向移动,所以
放出的热量小于 Q kJ。
8.【答案】D
【解析】A 中由于 x 的值未知,无法判断平衡的移动方向,A 不正确;B 中可断定 x<4;分析反应①②,
由等效平衡原理,得 n(M)+ =3 mol (1)
n(N)+ =2 mol (2)
方程式(1)(2)变形可得 x= = 即无论 x 取何值,恒有 3n(N)=n(M)+3 mol,
故 C 不正确;由(1)×8-(2)×12 向已知 D 中的关系式靠拢,变形可得:8n(M)+ =12n(N)+
即:8n(M)+ =12n(N),则 x=4,故 D 项正确。
9.【答案】(1)0.05 mol·L-1·min-1
(2)增大二氧化碳的浓度(或增加 CO2 的量) 2.4 mol·L-1
(3)AC
3 Pn
x
Pn
x
3 P
3mol M
n
n
P
2mol N
n
n
24 Pn
x
12 Pn
x
12 Pn
x
27
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始(mol) 1 2 0 0
转化(mol) 1
平衡(mol) 1
所以该温度下的平衡常数 K= = 。
利用平衡常数不变:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始(mol) 2 0 0
转化(mol) 1.5 0.5 0.5
平衡(mol) x 0.5 0.5 0.5
所以该温度下的平衡常数 K= = ,
解得 x=12
平衡时容器中 c(CO2)= mol·L-1=2.4 mol·L-1。
(3)该反应是体积有变化的反应,A、C 都可以作为判断平衡的依据;B 项应为 v(H2)正=3v(CH3OH)逆,
错误;同一个方向的速率,没有反映出正、逆两个方向,D 错误。
10.【答案】(1)2NH3(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=-134 kJ·mol-1
(2)250 ℃时,催化剂的催化效率最好,之后催化剂的催化效率急剧降低 250
(3)①向右 ②b ③增加 CO 的物质的量浓度、增大压强、减少生成物浓度
(3)由图丙可知:起始时 NO 为 0.4 mol,平衡时为 0.2 mol,则有
1
3
1
3
1
3
2
3
1
3
1
3
3
1 1
3 5 3 5
1 2( )5 3 5
25
6
3
0.5 0.5
5 5
0.5( )5 5
x
25
6
12
5
28
2NO(g)+2CO(g) 2CO2(g)+N2(g)
起始/mol 0.4 0.4 0 0
转化/mol 0.2 0.2 0.2 0.1
平衡/mol 0.2 0.2 0.2 0.1
平衡时浓度/mol·L-1 0.1 0.1 0.1 0.05
K= = =5
Qc= = =1.8<K,故反应向右移动。
②催化剂表面积大,反应速率快,达平衡时间短,由图可知,b 曲线代表条件下的反应速率快,b 的催
化剂表面积大。
③由图像可知,NO 的浓度减小,平衡正向移动,所以改变条件为增加 CO 的物质的量浓度、增大压强、
减小生成物浓度。
1.【答案】D
【解析】A.加入 NaOH,中和 HBr,平衡逆向移动,可增大乙醇的物质的量。选项 A 正确。
B.增大 HBr 浓度,平衡正向移动,有利于生成 C2H5Br。选 B 正确。
点睛:本题中的反应是反应前后物质的量不变的反应,但是考虑到反应是在水溶液中进行的,而生成的
溴乙烷是不溶于水的,即本题中的溴乙烷应该是没有浓度的,所以选项 D 中是不需要考虑温度升高将溴
乙烷蒸出的影响的。
2.【答案】CD
【解析】由容器 I 中反应 2NO2 2NO+O2
起始量(mol/L) 0.6 0 0
变化量(mol/L) 0.4 0.4 0.2
平衡量(mol/L) 0.2 0.4 0.2
2
2 2
2 2
(CO ) (N )
(NO) (CO)
c c
c c
2
2 2
0.1 0.05
0.1 0.1
2
2 2
2 2
(CO ) (N )
(NO) (CO)
c c
c c
2
2 2
0.1 0.45
0.1 0.5
29
可以求出平衡常数 K= ,平衡时气体的总物质的量为 0.8 mol,其中 NO 占 0.4 mol,所以 NO
的体积分数为 50%, 。在平衡状态下,v 正=v(NO2)消耗=v 逆=v(NO)消耗,所以 k 正 c2(NO2)=k 逆
c2(NO)•c(O2),进一步求出 。
A.根据容器 II 的起始投料,浓度商 Q= = <K,平衡将向正反应方向移动,所以容器 II 在平
衡时气体的总物质的量一定大于 1 mol,故达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比一定小于 4∶5,A
错误;B.若容器 II 在某时刻, ,
由反应 2NO2 2NO + O2
起始量(mol/L) 0.3 0.5 0.2
变化量(mol/L) 2x 2x x
平衡量(mol/L) 0.3−2x 0.5+2x 0.2+x
因为, ,解之得 x= ,求出此时浓度商 Qc= >K,所以容器 II 达
平衡时, 一定小于 1,B 错误;C.若容器 III 在某时刻,NO 的体积分数为 50%,
由反应 2NO2 2NO + O2
起始量(mol/L) 0 0.5 0.35
变化量(mol/L) 2x 2x x
平衡量(mol/L) 2x 0.5−2x 0.35−x
由 0.5−2x=2x+0.35−x,解之得,x=0.05,求出此时浓度商 Qc= > ,说明此时反应未达平
衡,反应继续向逆反应方向进行,NO 进一步减少,所以 C 正确;D.温度为 T2 时, >0.8,
因为正反应是吸热反应,升高温度后化学平衡常数变大,所以 T2>T1,D 正确。
【名师点睛】试题主要从浓度、温度对化学反应速率、化学平衡的影响以及平衡常数的计算等方面,考
查学生对化学反应速率、化学平衡等化学基本原理的理解和应用,关注信息获取、加工和处理能力的提
2
2
0.4 0.2 0.80.2
2
2
O 1NO
c
c
0.8k Kk 正
逆
2
2
0.2 0.5
0.3
5
9
2
2
O 1NO
c
c
2
2
O 0.2 1NO 0.3 2
c x
c x
1
30
2
2
17 7
28930 30
2107
30
2
2
O
NO
c
c
2
2
0.4 0.3 4.80.1
1
K
2 1k Kk 正
逆
30
高。解题时首先要分析反应的特征,如是恒温恒容还是恒温恒压反应,是气体分子数目增加的还是气体
分子数目减小的反应,其次分析所建立的平衡状态的条件和平衡状态的特征,最后逐一分析试题中所设
计的选项,判断是否正确。本题只给了一个平衡量,通过化学平衡计算的三步分析法,分析容器 I 中平
衡态的各种与 4 个选项相关的数据,其他容器与 I 进行对比,通过浓度商分析反应的方向,即可判断。
本题难度较大,如能用特殊值验证的反证法,则可降低难度。
3.【答案】AD
【解析】本题考查化学平衡,意在考查考生对等效平衡的理解应用能力。A 项,若反应Ⅲ的温度为 400
℃,则反应Ⅰ和反应Ⅲ达到的平衡为等效平衡,而反应Ⅲ的实际温度为 500 ℃,500 ℃时 CH3OH 的平
衡浓度比 400 ℃时的小,说明升高温度后,平衡逆向移动,故正反应为放热反应,正确;B 项,反应Ⅱ
相当于给反应Ⅰ加压,加压时,平衡正向移动,故容器Ⅱ中反应物的转化率大,错误;C 项,由表中数
据知,达到平衡时,可求得容器Ⅰ中 c(H2)=0.04 mol·L−1,可推知容器Ⅱ中 c(H2)<0.08 mol·L−1,容器Ⅲ
中 c(H2)=0.15 mol·L−1, < = ,错误;D 项,达到平衡时,容器Ⅲ中反应物
的浓度比容器Ⅰ中反应物的浓度大,且容器Ⅲ中的温度高,所以容器Ⅲ中正反应速率大于容器Ⅰ中的,
正确。
5.【答案】BC
【解析】由图可知,升高温度,c(CO2)降低,即平衡正向移动,所以该反应为吸热反应,ΔH>0,A项错
误;相同温度下,图中Ⅱ点所在曲线对应的c(CO2)高,表示通入0.2 mol CO2,则Ⅰ点所在曲线表示通入
0.1 mol CO2,Ⅰ点和Ⅱ点的c(CO2)相等,由图知参加反应的CO2的物质的量:Ⅱ点大于Ⅰ点的2倍,且该
反应为气体分子数增多的反应,同时Ⅱ点的温度比Ⅰ点高,所以体系的总压强p总:p总(状态Ⅱ)>2p总(状态
Ⅰ),B项正确;状态Ⅱ中CO2的投入量为状态Ⅲ的2倍,因状态Ⅱ压强比状态Ⅲ大,而加压平衡逆向移动,
则状态Ⅱ中的c(CO)小于状态Ⅲ中c(CO)的2倍,C项正确;状态Ⅲ比状态Ⅰ的温度高,温度越高,反应速
率越快,所以状态Ⅲ的反应速率快,D项错误。
6.【答案】(1)+123 小于 AD
2
2
2 (H )
(H )
c
c
Ⅱ
Ⅲ
1
1
2 0.080mol L
0.15mol L
16
15
31
(2)氢气是产物之一,随着 n(氢气)/n(丁烷)增大,逆反应速率增大
(3)升高温度有利于反应向吸热方向进行 温度升高反应速率加快 丁烯高温裂解生成短链烃类
【解析】(1)根据盖斯定律,用②式−③式可得①式,因此 ΔH1=ΔH2−ΔH3=−119 kJ/mol +242 kJ/mol =+123
kJ/mol。由图(a)可以看出,温度相同时,由 0.1 MPa 变化到 x MPa,丁烷的转化率增大,即平衡正向
移动,根据反应前后气体系数之和增大,减小压强,平衡向正反应方向移动,即 x<0.1。提高丁烯的产率,
要求平衡向正反应方向移动,A、因为反应①是吸热反应,升高温度,平衡向正反应方向移动,即丁烯
转化率增大,故 A 正确;B、降低温度,平衡向逆反应方向移动,丁烯的转化率降低,故 B 错误;C、
反应前气体系数之和小于反应后气体系数之和,增大压强,平衡向逆反应方向移动,丁烯的转化率降低,
故 C 错误;D、根据 C 选项分析,降低压强,平衡向正反应方向移动,丁烯转化率提高,故 D 正确。
(2)因为通入丁烷和氢气,发生①,氢气是生成物,随着 n(H2)/n(C4H10)增大,相当于增大氢气的量,
反应向逆反应方向进行,逆反应速率增加。
(3)根据图(c),590℃之前,温度升高时反应速率加快,生成的丁烯会更多,同时由于反应①是吸热反
应,升高温度平衡正向移动,平衡体系中会含有更多的丁烯。而温度超过 590℃时,由于丁烷高温会裂
解生成短链烃类,所以参加反应①的丁烷也就相应减少。