- 2021-05-07 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
安徽省宣城市2019-2020学年高二上学期期末考试化学试题 Word版含答案
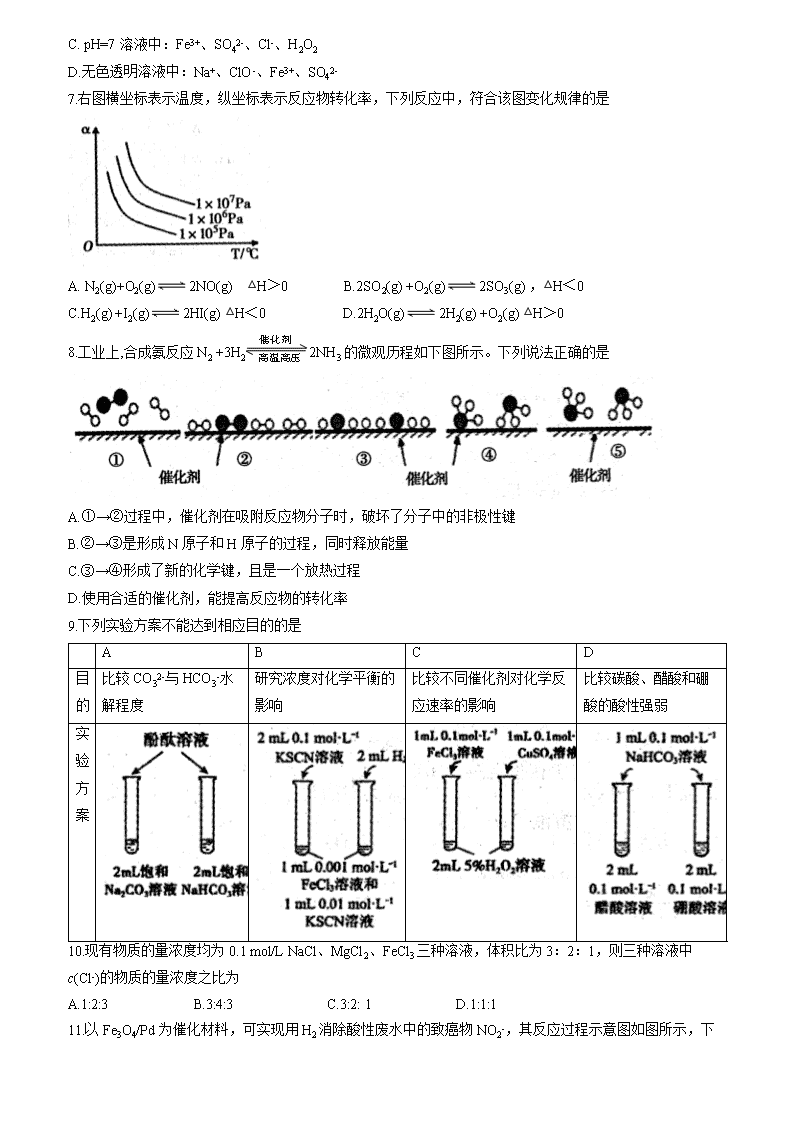
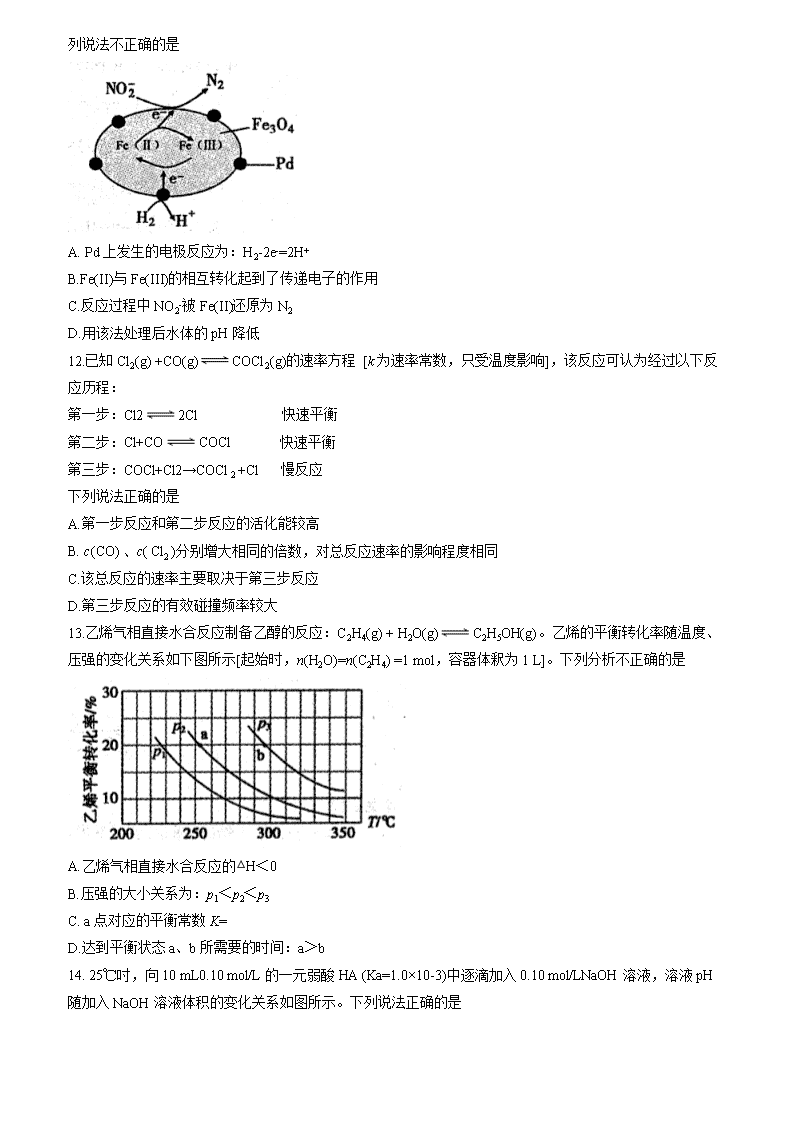
安徽省宣城市2019-2020学年高二上学期期末考试 化学试题 考生注意事项: 1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分,满分100分,考试时间100分钟。 2.答题前,考生先将自己的姓名、考号在答题卡指定位置填写清楚并将条形码粘贴在指定区域。 3.考生作答时,请将答案答在答题卡上。第I卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;第II卷请用0.5毫米的黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷草稿纸上作答无效。 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 K-39 Mn-55 第I卷 选择题(共48分) 一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个正确答案) 1.中华传统文化中蕴藏着很多化学原理。下列对古文或古诗词的说明正确的是 选项 古文或古诗词 说明 A 冰,水为之,而寒于水 冰变成水过程中放出能量 B 蜡烛成灰泪始干 蜡烛燃烧过程中化学能全部转化为光能 C 日照香炉生紫烟 紫烟指的是碘的升华 D 用浓酒和糟入甑,蒸令气上,用器承滴露 该过程中利用到蒸馏原理 2.化学与生产生活、社会密切相关。下列有关说法不正确的是 A.明矾常用于水体的杀菌消毒 B.用热的纯碱溶液可洗涤金属表面的油污 C.高纯度的二氧化硅广泛用于制作光导纤维 D.石墨烯弹性气凝胶制成的轻质“碳海绵”可用于吸附海上泄漏的原油 3.下列属于吸热的氧化还原反应的是 A.可燃物的燃烧 B.铵盐和碱反应生成氨气 C.水煤气的生成 D.铝热反应 4.化学概念的理解需要从本质上进行分析,否则易产生错误。下列有关“电”概念中,不需要通电即可进行的是 A.电泳 B.电离 C.电镀 D.电解 5. NA表示阿伏加德罗常数的值,下列说法正确的是 A. 28 g乙烯和氮气的混合气体中所含原子数为4NA B.标准状况下,11.2 LSO3所含原子数为2NA C.100 mL 0.1mol/L的Na2S溶液中含有的S2-数为0.01NA D.常温常压下,1.7 g —CHD2含中子数为0. 8NA 6.常温下,下列各组离子在指定溶液中能大量共存的是 A.含大量Al3+的溶液中:K+、Mg2+、NO3-、HCO3- B.= 10-12的溶液中:NH4+、Na+、SO42-、NO3- C. pH=7溶液中:Fe3+、SO42-、Cl-、H2O2 D.无色透明溶液中:Na+、ClO-、Fe3+、SO42- 7.右图横坐标表示温度,纵坐标表示反应物转化率,下列反应中,符合该图变化规律的是 A. N2(g)+O2(g)2NO(g) △H>0 B.2SO2(g) +O2(g)2SO3(g) ,△H<0 C.H2(g) +I2(g)2HI(g) △H<0 D.2H2O(g)2H2(g) +O2(g) △H>0 8.工业上,合成氨反应N2 +3H22NH3的微观历程如下图所示。下列说法正确的是 A.①→②过程中,催化剂在吸附反应物分子时,破坏了分子中的非极性键 B.②→③是形成N原子和H原子的过程,同时释放能量 C.③→④形成了新的化学键,且是一个放热过程 D.使用合适的催化剂,能提高反应物的转化率 9.下列实验方案不能达到相应目的的是 A B C D 目的 比较CO32-与HCO3-水解程度 研究浓度对化学平衡的影响 比较不同催化剂对化学反应速率的影响 比较碳酸、醋酸和硼酸的酸性强弱 实验方案 10.现有物质的量浓度均为0.1 mol/L NaCl、MgCl2、FeCl3三种溶液,体积比为3:2:1,则三种溶液中c(Cl-)的物质的量浓度之比为 A.1:2:3 B.3:4:3 C.3:2: 1 D.1:1:1 11.以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2- ,其反应过程示意图如图所示,下列说法不正确的是 A. Pd上发生的电极反应为:H2-2e-=2H+ B.Fe(II)与Fe(III)的相互转化起到了传递电子的作用 C.反应过程中NO2-被Fe(II)还原为N2 D.用该法处理后水体的pH降低 12.已知Cl2(g) +CO(g)COCl2(g)的速率方程 [k为速率常数,只受温度影响],该反应可认为经过以下反应历程: 第一步:Cl22Cl 快速平衡 第二步:Cl+COCOCl 快速平衡 第三步:COCl+Cl2→COCl2 +Cl 慢反应 下列说法正确的是 A.第一步反应和第二步反应的活化能较高 B. c(CO) 、c( Cl2 )分别增大相同的倍数,对总反应速率的影响程度相同 C.该总反应的速率主要取决于第三步反应 D.第三步反应的有效碰撞频率较大 13.乙烯气相直接水合反应制备乙醇的反应:C2H4(g) + H2O(g)C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下图所示[起始时,n(H2O)=n(C2H4) =1 mol,容器体釈为1 L]。下列分析不正确的是 A.乙烯气相直接水合反应的△H<0 B.压强的大小关系为:p1<p2<p3 C. a点对应的平衡常数K= D.达到平衡状态a、b所需要的时间:a>b 14. 25℃吋,向10 mL0.10 mol/L的一元弱酸HA (Ka=1.0×10-3)中逐滴加入0.10 mol/LNaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是 A. a点吋,c(HA) +c(OH-) =c(Na+) +c(H+) B.溶液在a点和b点吋,水的电离程度相同 C. b点吋,c(Na+) =c(HA) +c(A-)+c(OH-) D. V=10 mL吋,c(Na+)>c(A-) >c(H+) >c(HA) 15. Li- SO2Cl2电池可用于心賍起搏器。该电池的电极材料分別カLi和C,申解液是LiAlCl4-SO2Cl2,总反应为:2Li+SO2Cl2=2LiCl+SO2↑,其工作示意图如下图所示。下列叙述中正确的是 A.电池工作时负极材料是Li,发生还原反应 B.电池工作肘,电子流向:锂电极→负载→碳棒→电解液→锂电极 C.外电路流过0.2 mol电子,生成2.24 L气体 D.电池必须在无水、无氣的条件下迸行工作 16.某温度下,在恒容(2 L)密闭容器中发生反应:N2(g) +3H2(g)2NH3(g)。 甲、乙、丙三狆情况下,起始充入N2和H2的物质的量如下表所示,其中甲经2 min达平衡时,N2的转化率为50%。下列判断正确的是 起始物质的量mol 甲 乙 丙 n(N2) 1 2 2 n(H2) 3 3 6 A.容器中气体的密度可作为判断反应是否达到平衡状态的标志 B.平衡时,乙中H2转化率大于50% C.反应达平衡时,丙中H2的物质的量浓度c(H2)等于甲中的2倍 D.甲、乙、丙三种条件下的化学平衡常数之间的关系为K甲 <K乙<K丙 第II卷 (非选择题 共52分) 二、填空题(本题共5小题,共52分) 17. (10分)现有下列10种物质: ①Na2CO3(aq) ②NaHCO3(s) ③液态氢化氢 ④Al(OH)3(s) ⑤NaOH(s) ⑥氯水 ⑦浓氨水 ⑧熔融的NaCl (1)其中能导电且属于电解质的是________(填序号),NaHCO3电离方程式为________ 。 (2)Na2CO3溶液显碱性的原因________________ (用离子方程式表示)。 (3)④加入⑤的水溶液中,反应的离子方程式为________________。 (4)实验室可在⑦中加入⑤快速制取氨气,请用化学平衡移动原理简述原因________________。 (5)分别采取下列措施后,氯水的漂白能力从强到弱的顺序为____________( 用字母表示)。 A.加入少量Na2CO3固体 B.不加任何物质 C.加入少量Na2SO3固体 18. (10分)2018年7月至9月,国家文物局在辽宁开展水下考古,搜寻、发现并确认了甲午海战北洋水师沉舰——经远舰。 已知:正常海水呈弱碱性。 (1)经远舰在海底“沉睡”124年后,钢铁制成的舰体腐蚀严重。舰体发生电化学腐蚀时,负极的电极反应式为_______________ 。 (2)为了保护文物,考古队员采用“牺牲阳极的阴极保护法”对舰船进行了处理。 ①下列说法不正确的是________。 A.锌块发生氧化反应:Zn-2e- = Zn2+ B.舰体有电子流入,可以有效减缓腐蚀 C.若通过外加电源保护舰体,应将舰体与电源正极相连 D.地下钢铁管道用导线连接锌块与该种舰体保护法原理相同 ②采用“牺牲阳极的阴极保护法”后,舰体上正极的电极反应式为_________。 (3);船上有些器皿是铜制品,表面有铜锈。 ①据了解铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散) ,结构如下图所示。 下列说法正确的是 A.疏松的Cu2(OH)3Cl属于有害锈 B. Cu2(OH)2CO3 既能溶于盐酸也能溶于氢氧化钠溶液 C.青铜器表面涂一层食盐水可以做保护层 D.用HNO3溶液除锈可以保护青铜器的艺术价值,做到“修旧如旧 ②文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体) ,将腐蚀文物置于含Na2CO,的缓冲溶液中浸泡,可以使CuCl转化为难溶的Cu2(OH)2CO3反应的离子方程式为___________________。 (4)考古队员将舰船上的部分文物打捞出水后,采取脱盐、干燥等措施保护文物。从电化学原理的角度分析“脱盐、干燥”的防腐原理:____________________。 19. (10分)氮元素及其化合物在日常生活、工农业生产及军事领域应用广泛。 (1)肼(N2H4)是发射火箭的一种重要原料,电子式为__________________。 (2)已知反应:4NH3(g) + 5O2(g)=4NO(g)+6H2O(g) △H= -1025 kJ/mol,在2 L密闭容器中投入1 mol NH3和1 mol O2,2 min后测得反应放热102.5 kJ。用氧气表示0~ 2 min的反应速率v(O2) =__________,此时,H2O(g)的体积分数为__________%(保留2位小数)。 (3)已知Ksp(AgC1)=1. 8×10-10,向100 mL2×10 -5mol/L AgNO3溶液中滴加100 mL1 ×10 -5mol/LNH4Cl溶液,溶液中_____________(填“ 有”或“没有”)白色AgCl沉淀生成。 (4)将6NO+4NH3=5N2+6H2O设计成原电池能有效降低含氮化合物的排放,减少环境污染,装置如图所示。 电极B为______极,反应过程中每转移0.3 mol电子,可消除有害气体的体积为_______L(标准状况下)。 20. (10分)一种用草酸泥渣(含PbC2O4和PbSO4)制备PbCrO4的工艺流程如下: 回答下列问题: 已知:①PbC2O4完全分解的化学方程式为PbC2O4PbO+CO↑+CO2↑。 ②PbCrO4难溶于水。 (1)泥渣“粉磨筛分”的目的是____________;实验室过滤操作需要的玻璃仪器有漏斗、烧杯和_____。 (2)用Na2CO3将难以热分解的硫酸铅转化为易分解的的碳酸铅。若在水溶液中进行, PbSO4(s) +(aq)→PbCO3(s) + (aq),该反应的平衡常数K___________。[已知Ksp(PbCO3) =6.4×10-4,Ksp(PbSO4) =1.6×10-8]。 (3)铬酸钠在硫酸溶液中可转化为重铬酸钠,该反应的离子方程式为_______________,步骤V“合成”时发生反应的化学方程式为_________________。 (4)铬酸铅是一种用于水彩和油彩的黄色颜料,遇到空气中的硫化氢颜色会变黑,该过程的化学方程式为_________________________。 21. (12 分)某研究小组为测定软锰矿中MnO2 的质量分数,实验步骤如下:准确称取0.5000 g软锰矿样品,加入1. 34 g Na2C2O4再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到250 mL容量瓶中并定容。取出25. 00mL待测液置于锥形瓶中,再用0.0100 mol/L KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。(已知KMnO4、MnO2在酸性条件下均能将NaC2O4氧化,且还原产物均为Mn2+。) (1)配制240 mL 0.0100mol/L KMnO4标准溶液,若使用分析天平需要KMnO4固体质量为_______g(保留4位有效数字),需要使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为__________(填名称)。 (2)酸化KMnO4溶液可选用的酸是__________, KMnO4标准溶液应置于________(填 “酸式”或“碱式”)滴定管中,原因是_______________。 (3)KMnO4和Na2C2O4在酸性条件下反应的离子方程式为_________________。 (4)到达滴定终点的实验现象是____________________。 (5)根据实验数据计算,软锰矿中MnO2的质量分数为____________%。 安徽省宣城市2019-2020学年高二上学期期末考试 化学试题参考答案 1-5:DACBD 6-10:BBCAA 11-16:DCCAD B 17. (10分) (1)⑧(1 分);NaHCO3=Na++HCO3-(1 分) (2)CO32-+H2OHCO3- +OH-(2分) (3)Al(OH)3+OH-=AlO2- +2H2O(2分) (4)在浓氨水中存在NH3+H2ONH3·H2ONH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,促使平衡逆向移动(2分) (5)A>B>C(2分) 18. (10分) (1)Fe-2e-=Fe2+(或 Fe-2e-+2OH-=Fe(OH)2)(1 分) (2)①C(2分)②O2 +4e- +2H2O=4OH- (1分) (3)①A(2 分 )②4CuCl +O2+2H2O+2CO32-=2Cu2(OH)2CO3+4Cl- (2 分) (4)脱盐、干燥处理破坏了微电池中的离子导体(或电解质溶液),使文物表面无法形成微电池发生电化学腐蚀(2分) 19. (10分) (1) (2 分) (2)0.125 mol/(L· min)(2分) ;28.57(2 分) (3)没有(2分) (4)正(1分);5.6(1分) 20. (10 分) (1)加快反应速率(或原料粒度越小,反应物之间混合接触越好,反应越完全等合理答案均可以)(1分); 玻璃棒(1分) (2)2.5×105(2分) (3)2H++2CrO42-=Cr2O72-+H2O(2 分) Na2Cr2O7+2Pb(NO3)2+H2O=2PbCrO4↓+2NaNO3+2HNO3(2 分) (4)PbCrO4+H2S= PbS+H2CrO4(2分) 21. (12分 ) (1)0. 3950;胶头滴管、250 mL容量瓶(各1分) (2)稀硫酸;酸式;酸性KMnO4溶液具有强氧化性,能腐蚀碱式滴定管的橡皮塞(各1分) (3)2MnO4-+5C2O42-+16H+=2Mn2++ 10CO2↑+8H2O(2 分) (4)当滴入最后一滴标准溶液时,锥形瓶内溶液由无色变为浅红色,且半分钟不褪色(2分) (5)87(2分)查看更多