- 2021-05-07 发布 |
- 37.5 KB |
- 6页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习有关气体的制备、净化、收集和检验型实验题作业
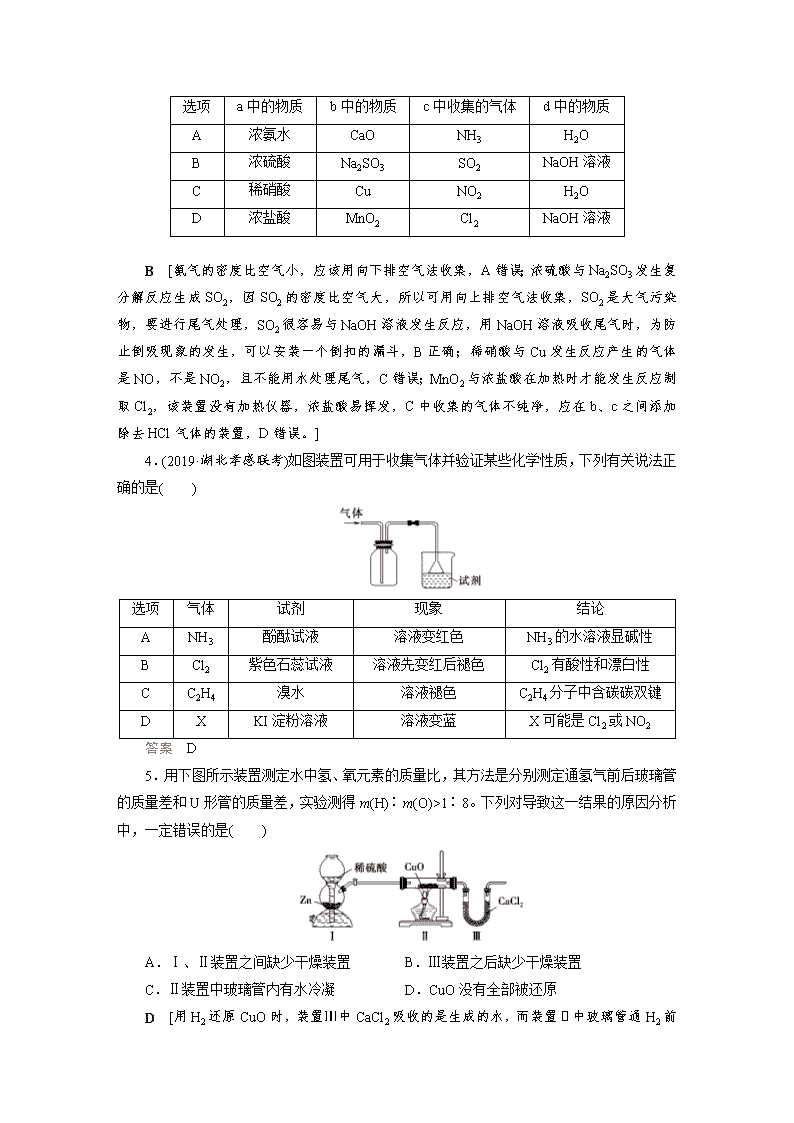
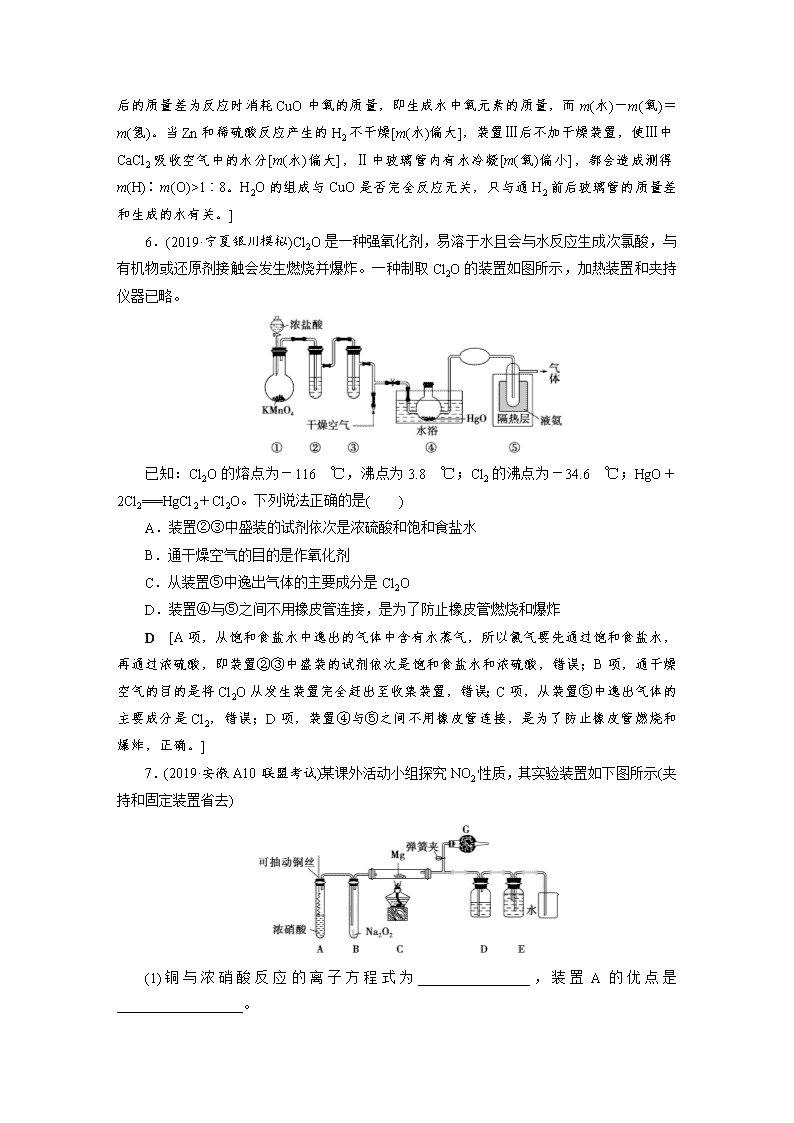
课时作业(十七) 有关气体的制备、净化、收集和检验型实验题 1.(2020·山东济宁检测)下面是实验室制取氨气的装置和选用的试剂,其中错误的是( ) A [NH4Cl加热生成的NH3和HCl,冷却后又生成NH4Cl,不能得到NH3。] 2.(2020·辽宁沈阳模拟)如图为常用玻璃仪器组成的七种实验装置,根据需要可在其中加入液体或固体试剂。下列说法错误的是( ) A.A、B装置既能用于收集Cl2,又能用于收集NO B.装有浓硫酸的F装置可用于干燥CO2气体 C.C、E装置可用于尾气吸收,能防止液体倒吸到气体发生装置中 D.G装置可用于合成氨实验中,可干燥、混合并能大致观察H2和N2的体积比 答案 B 3.(2020·河南南阳测试)实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( ) 选项 a中的物质 b中的物质 c中收集的气体 d中的物质 A 浓氨水 CaO NH3 H2O B 浓硫酸 Na2SO3 SO2 NaOH溶液 C 稀硝酸 Cu NO2 H2O D 浓盐酸 MnO2 Cl2 NaOH溶液 B [氨气的密度比空气小,应该用向下排空气法收集,A错误;浓硫酸与Na2SO3发生复分解反应生成SO2,因SO2的密度比空气大,所以可用向上排空气法收集,SO2是大气污染物,要进行尾气处理,SO2很容易与NaOH溶液发生反应,用NaOH溶液吸收尾气时,为防止倒吸现象的发生,可以安装一个倒扣的漏斗,B正确;稀硝酸与Cu发生反应产生的气体是NO,不是NO2,且不能用水处理尾气,C错误;MnO2与浓盐酸在加热时才能发生反应制取Cl2,该装置没有加热仪器,浓盐酸易挥发,C中收集的气体不纯净,应在b、c之间添加除去HCl气体的装置,D错误。] 4.(2019·湖北孝感联考)如图装置可用于收集气体并验证某些化学性质,下列有关说法正确的是( ) 选项 气体 试剂 现象 结论 A NH3 酚酞试液 溶液变红色 NH3的水溶液显碱性 B Cl2 紫色石蕊试液 溶液先变红后褪色 Cl2有酸性和漂白性 C C2H4 溴水 溶液褪色 C2H4分子中含碳碳双键 D X KI淀粉溶液 溶液变蓝 X可能是Cl2或NO2 答案 D 5.用下图所示装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因分析中,一定错误的是( ) A.Ⅰ、Ⅱ装置之间缺少干燥装置 B.Ⅲ装置之后缺少干燥装置 C.Ⅱ装置中玻璃管内有水冷凝 D.CuO没有全部被还原 D [用H2还原CuO时,装置Ⅲ中CaCl2吸收的是生成的水,而装置Ⅱ中玻璃管通H2 前后的质量差为反应时消耗CuO中氧的质量,即生成水中氧元素的质量,而m(水)-m(氧)=m(氢)。当Zn和稀硫酸反应产生的H2不干燥[m(水)偏大],装置Ⅲ后不加干燥装置,使Ⅲ中CaCl2吸收空气中的水分[m(水)偏大],Ⅱ中玻璃管内有水冷凝[m(氧)偏小],都会造成测得m(H)∶m(O)>1∶8。H2O的组成与CuO是否完全反应无关,只与通H2前后玻璃管的质量差和生成的水有关。] 6.(2019·宁夏银川模拟)Cl2O是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物或还原剂接触会发生燃烧并爆炸。一种制取Cl2O的装置如图所示,加热装置和夹持仪器已略。 已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃;Cl2的沸点为-34.6 ℃;HgO+2Cl2===HgCl2+Cl2O。下列说法正确的是( ) A.装置②③中盛装的试剂依次是浓硫酸和饱和食盐水 B.通干燥空气的目的是作氧化剂 C.从装置⑤中逸出气体的主要成分是Cl2O D.装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸 D [A项,从饱和食盐水中逸出的气体中含有水蒸气,所以氯气要先通过饱和食盐水,再通过浓硫酸,即装置②③中盛装的试剂依次是饱和食盐水和浓硫酸,错误;B项,通干燥空气的目的是将Cl2O从发生装置完全赶出至收集装置,错误;C项,从装置⑤中逸出气体的主要成分是Cl2,错误;D项,装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸,正确。] 7.(2019·安徽A10联盟考试)某课外活动小组探究NO2性质,其实验装置如下图所示(夹持和固定装置省去) (1)铜与浓硝酸反应的离子方程式为________________,装置A的优点是__________________。 (2)G中试剂为________,作用是________________________。 (3)类比Mg与CO2反应的思路,写出Mg与NO2反应的化学方程式_________________________________________________, 设计装置D(内装NaOH溶液) 和装置E的目的是________________________。 (4)一段时间后,装置B中管壁发烫,瓶内红棕色物质消失,淡黄色粉末变成白色固体(为单一物质)。小组同学认为Na2O2与NO2发生了氧化还原反应,其结果有两种假设: ①NO2被Na2O2氧化,则白色固体是________(填化学式)。 ②NO2被Na2O2还原,为了验证此产物,取适量白色固体于试管中,加蒸馏水溶解,滴加酸性高锰酸钾溶液,则观察到的现象是______________________________________。 解析 (1)铜与浓硝酸反应生成硝酸铜、二氧化氮、水,反应离子方程式是Cu+4H++2NO===Cu2++2NO2↑+2H2O;通过抽动铜丝可以控制反应的速率;(2)NO2有毒,G中可以盛放氢氧化钠(或碱石灰)吸收NO2,避免污染环境;(3)Mg与NO2反应生成氧化镁和氮气,反应方程式是4Mg+2NO24MgO+N2;装置D(内装NaOH溶液) 可以吸收NO2,氮气难溶于水,若装置E中收集到气体,则证明装置C中发生反应生成N2;(4)①NO2被Na2O2氧化,则生成硝酸盐,白色固体是NaNO3;②NO2被Na2O2还原,则生成亚硝酸盐,亚硝酸盐可以被高锰酸钾氧化,所以高锰酸钾溶液褪色。 答案 (1)Cu+4H++2NO=Cu2++2NO2↑+2H2O 可以控制反应的速率 (2)碱石灰(NaOH固体) 吸收NO2,避免污染环境 (3)4Mg+2NO24MgO+N2 证明装置C中发生反应生成N2 (4)①NaNO3 ②高锰酸钾溶液褪色 8.(2019·四川南充考试)兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。 【查阅资料】 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃) 是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。 【原料制备】 在实验室分别制备原料气NO和Cl2。 (1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂。 原料制备 装置Ⅰ 装置Ⅰ 装置Ⅱ 烧瓶中 分液漏斗中 制备纯净Cl2 MnO2 ①__________ ②__________ 制备纯净NO Cu ③__________ ④__________ 【合成亚硝酰氯】 利用制得的NO和Cl2制备NOCl,装置如图所示: (2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是______________________。 (3)装置连接顺序为 a→________________(按气流自左向右方向,用小写字母表示)。 (4)装置Ⅴ的作用是_______________________________________________________。 (5)装置Ⅸ在实验时,预期观察到的现象是__________________________________ ________________________________________________________________________。 (6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________。 【拓展学习】 (7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸) 时会生成亚硝酰氯和氯气,该反应的化学方程式为___________________________________________。 解析 (1)实验室用二氧化锰与浓盐酸加热反应制备氯气,分液漏斗中加入浓盐酸;生成的氯气中含有杂质氯化氢、水蒸气;因此混合气体进入装有饱和食盐水的装置Ⅱ中,以除去氯化氢,因此②中加入饱和食盐水;实验室用铜和稀硝酸反应制备一氧化氮,分液漏斗中加入稀硝酸;由于装置内有空气,会有一氧化氮部分氧化为二氧化氮,因此混合气体进入盛有水装置Ⅱ中,除去二氧化氮。(2)装置Ⅳ、Ⅴ装有浓硫酸,除可进一步干燥NO、Cl2外,另一个作用通过观察气泡的多少来控制气体的速率。(3)氯气和一氧化氮混合后在装置IV中发生反应生成NOCl,通过a进入到IX装置内,进行液化,收集NOCl,多余的尾气再用碱液吸收的同时,必须用VII装置吸收水蒸气,以防止NOCl与水发生水解;所以装置连接顺序为 a→e→f→c→b→d (或f→e→c→b→d)。(4)装置Ⅴ中装有浓硫酸,起到干燥气体,防止水蒸气进入反应器。(5)已知:亚硝酰氯(NOCl熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,液体状态呈红褐色,遇水易水解;根据信息可知:装置Ⅸ中观察到的现象U型管内充满黄色气体,并有红色液体凝结;正确答案:U型管内充满黄色气体,并有红色液体凝结。(6)装置Ⅷ 中装有碱液,吸收尾气时,氢氧化钠溶液与NOCl发生反应生成氯化钠和亚硝酸钠;化学方程式为:NOCl+2NaOH===NaCl+NaNO2+H2O;正确答案:NOCl+2NaOH===NaCl+NaNO2+H2O。(7)浓硝酸与浓盐酸混合时发生氧化还原反应,生成亚硝酰氯和氯气,该反应的化学方程式为HNO3(浓)+3HCl(浓)===NOCl↑+Cl2↑+2H2O;正确答案:HNO3(浓)+3HCl(浓)===NOCl↑+Cl2↑+2H2O。 答案 (1)①浓盐酸 ②饱和食盐水 ③稀硝酸 ④水 (2)通过观察气泡调节气体的流速 (3)e→f→c→b→d(或f→e→c→b→d) (4)防止水蒸气进入反应器 (5)U型管内充满黄色气体,并有红色液体凝结 (6)NOCl+2NaOH===NaCl+NaNO2+H2O (7)HNO3(浓)+3HCl(浓)===NOCl↑+Cl2↑+2H2O查看更多