- 2021-05-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高一化学同步巩固练习解析:第1章 第2节第3课时(新人教版必修1)
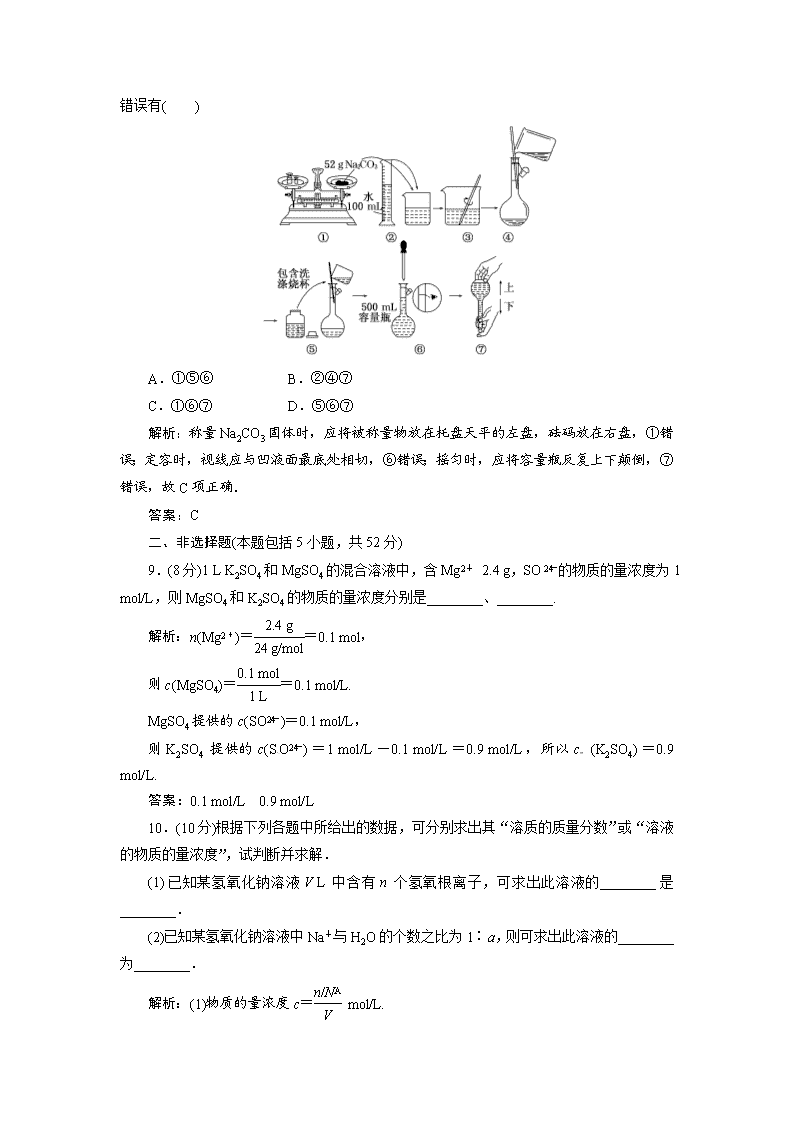
高一同步巩固练习试题解析(新人教版必修1) (时间45分钟,满分100分) 一、选择题(本题包括8小题,每小题6分,共48分) 1. 下列溶液中物质的量浓度为1 mol/L的是( ) A.将40 g NaOH固体溶解于1 L水中 B.将22.4 L氯化氢气体溶于水配成1 L溶液 C.将1 L 10 mol/L的浓盐酸与9 L水混合 D.10 g NaOH固体溶解在水中配成250 mL溶液 解析:A项NaOH固体溶于1 L水所得溶液的体积不是1 L,故NaOH溶液的浓度不是1 mol/L;B项22.4 L HCl气体所处的外界条件(如温度、压强)不确定,其物质的量不一定是1 mol,溶液的物质的量浓度不一定是1 mol/L;C项混合后溶液体积并不是10 L,则浓度不是1 mol/L;D项中c(NaOH)===1 mol/L. 答案:D 2.下列溶液中,物质的量浓度最大的是( ) A.1 L H2SO4溶液中含98 g H2SO4 B.0.5 L含49 g H2SO4的溶液 C.98 g H2SO4溶于水配成2 L溶液 D.0.1 L含24.5 g H2SO4的溶液 解析:A、B中H2SO4的物质的量浓度为1 mol/L,C中为0.5 mol/L,D中为2.5 mol/L. 答案:D 3. 用胆矾配制1 L 0.1 mol/L的CuSO4溶液,正确的做法是( ) A.将胆矾加热除去结晶水后,称取16 g溶于1 L水中 B.称取胆矾25 g溶于1 L水中 C.将25 g胆矾溶于少量水,然后将溶液稀释到1 L D.将16 g胆矾溶于少量水,然后将此溶液稀释至1 L 解析:n(胆矾)=1 L×0.1 mol/L=0.1 mol,其质量为0.1 mol×250 g/mol=25 g,所以配制时应将25 g胆矾溶于水配成1 L溶液. 答案:C 4.将5 mol/L盐酸10 mL稀释到200 mL,再取出5 mL,这5 mL溶液的物质的量浓度是( ) A.0.05 mol/L B.0.25 mol/L C.0.1 mol/L D.0.5 mol/L 解析:根据稀释定律:c(浓溶液)×V(浓溶液)=c(稀溶液)×V(稀溶液)列式,5 mol/L×10 mL=c(稀溶液)×200 mL,解得c(稀溶液)=0.25 mol/L,从中取出5 mL,浓度不变. 答案:B 5. 300 mL 0.2 mol/L KCl溶液与100 mL 0.3 mol/L AlCl3溶液中Cl-物质的量浓度之比是( ) A.1∶3 B.2∶3 C.2∶1 D.2∶9 解析:0.2 mol/L KCl溶液中,c(Cl-)=0.2 mol/L,0.3 mol/L AlCl3溶液中c(Cl-)=0.9 mol/L.两者之比为2∶9. 答案:D 6.下列配制的溶液浓度偏高的是( ) A.配制盐酸用量筒量取盐酸时俯视刻度线 B.配制盐酸定容时,仰视容量瓶刻度线 C.称量4 g NaOH配制0.1 mol/L NaOH溶液1000 mL时,砝码错放左盘 D.NaOH溶解后未经冷却即注入容量瓶至刻度线 解析:A项俯视刻度线,将会使量得盐酸的体积小于计算值,导致浓度偏低;B项定容时仰视容量瓶刻度线,将会导致溶液体积大于实际体积,溶液浓度偏小;C项由于所称NaOH固体的质量为整数,不需移动游码,故称得固体NaOH的质量是准确的,不会影响到配制溶液的浓度;D项因NaOH溶于水放热,使溶液体积增大,在冷却后液面低于容量瓶刻度线,导致所配溶液浓度偏高. 答案:D 7. 关于0.1 mol/L H2SO4溶液的叙述错误的是( ) A.1 L该溶液中含有H2SO4的质量为9.8 g B.0.5 L该溶液中氢离子的物质的量浓度为0.2 mol/L C.从1 L该溶液中取出100 mL,则取出溶液中H2SO4的物质的量浓度为0.01 mol/L D.取该溶液10 mL,加水稀释至100 mL后H2SO4的物质的量浓度为0.01 mol/L 解析:1 L 0.1 mol/L的H2SO4溶液中含溶质的质量为:m=n·M=1 L×0.1 mol/L×98 g/mol=9.8 g,A正确;0.1 mol/L H2SO4溶液中H+浓度为0.2 mol/L,B正确;H2SO4溶液的浓度与体积无关,仍然是0.1 mol/L,C错误;10 mL溶液加水稀释至100 mL,体积增大10倍,浓度变为原来的,即0.01 mol/L,D正确. 答案:C 8. 某同学用Na2CO3配制0.10 mol/L Na2CO3 溶液的过程如图所示.你认为该同学的错误有( ) A.①⑤⑥ B.②④⑦ C.①⑥⑦ D.⑤⑥⑦ 解析:称量Na2CO3固体时,应将被称量物放在托盘天平的左盘,砝码放在右盘,①错误;定容时,视线应与凹液面最底处相切,⑥错误;摇匀时,应将容量瓶反复上下颠倒,⑦错误,故C项正确. 答案:C 二、非选择题(本题包括5小题,共52分) 9.(8分)1 L K2SO4和MgSO4的混合溶液中,含Mg2+ 2.4 g,SO的物质的量浓度为1 mol/L,则MgSO4和K2SO4的物质的量浓度分别是________、________. 解析:n(Mg2+)==0.1 mol, 则c(MgSO4)==0.1 mol/L. MgSO4提供的c(SO)=0.1 mol/L, 则K2SO4提供的c(SO)=1 mol/L-0.1 mol/L=0.9 mol/L,所以c (K2SO4)=0.9 mol/L. 答案:0.1 mol/L 0.9 mol/L 10.(10分)根据下列各题中所给出的数据,可分别求出其“溶质的质量分数”或“溶液的物质的量浓度”,试判断并求解. (1)已知某氢氧化钠溶液V L中含有n个氢氧根离子,可求出此溶液的________是________. (2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的________为________. 解析:(1)物质的量浓度c= mol/L. (2)由Na+与H2O的个数比可知NaOH与H2O的物质的量之比,故溶质质量分数为×100%. 答案:(1)物质的量浓度 mol/L (2)溶质质量分数 ×100% 11.(8分)常温下,10.0 mL 1.0 mol/L的H2SO4(aq),加水稀释到500 mL,所得H2SO4(aq)的浓度为________mol/L;蒸发浓缩,使溶液的体积为2.40 mL,所得H2SO4(aq)的浓度为________mol/L. 解析:根据溶液的稀释定律,溶液稀释或浓缩前后溶质的质量和物质的量不变:c1V1=c2V2=c3V3. 稀释到500 mL时,[] c2(H2SO4)== =0.020 mol/L; 浓缩到2.40 mL时,c3(H2SO4)= ==4.2 mol/L. 答案:0.020 4.2 12.(13分) 实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL: (1)配制溶液时,一般可以分为以下几个步骤: ①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 其正确的操作顺序为________________.本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有________. (2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为____________ g,要完成本实验该同学应称出____________ g NaOH. (3)使用容量瓶前必须进行的一步操作是________. (4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________. ①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量洒到容量瓶外面 ③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线 ⑤未冷却到室温就将溶液转移到容量瓶并定容 ⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线 解析:(1)配制溶液的几个步骤为:②计算→①称量→③溶解→⑧冷却→⑤转移→⑥洗涤→⑦定容→④摇匀.主要仪器为250 mL容量瓶. (2)配制240 mL溶液,需使用250 mL容量瓶,计算时按250 mL计算,n(NaOH)=1.0 mol·L-1×0.25 L=0.25 mol m(NaOH)=10.0 g 称量时应左物右码,图中左码右物, 因有质量关系:游码+右盘=左盘,故烧杯的质量为30 g-2.6 g=27.4 g (3)容量瓶必须查漏后,才能使用. (4)①没洗涤会减少溶质,引起浓度偏低. ②溶液洒到外面,引起浓度偏低. ③含少量蒸馏水,对溶液浓度没有影响. ④俯视刻度线,导致液面不到刻度线,引起浓度偏高. ⑤未冷却就转移,定容并冷却后,液体体积减少,浓度偏高. ⑥定容后再加水,溶液体积变大,溶液浓度偏低. 答案:(1)②①③⑧⑤⑥⑦④ 250 mL容量瓶 (2)27.4 10.0 (3)查漏 (4)④ ⑤ 13.(13分)实验室配制0.1 mol/L的BaCl2溶液可分两个阶段进行,第一阶段:用托盘天平称取5.2 g无水BaCl2晶体. 第二阶段:溶解配制0.1 mol/L的BaCl2溶液.第一阶段操作有如下几步:A.将游码拨至0.2 g处;B.将游码拨至“0”处;C.在天平两边的托盘上各放一张干净的等质量的滤纸,调节天平两边的螺母使天平平衡;D.取走药品,将砝码放回砝码盒内;E.往左盘内逐步添加晶体至天平平衡;F.在右盘上放置5 g砝码. (1)其正确的操作顺序是(填序号): B→( )→( )→A→( )→( )→( ) (2)在E操作中,只缺少量晶体时,其操作方法是_____________________________ ________________________________________________________________________. (3)第二阶段操作,应先将5.2 g BaCl2加适量蒸馏水溶解,溶解过程中使用的主要仪器有________________.然后将溶液转入________中,再经________、________、________后即可得到0.1 mol/L BaCl2溶液. (4)下列操作使配制的BaCl2溶液浓度偏低的有________. A.将砝码放在左盘上,BaCl2放在右盘上进行称量 B.选用的容量瓶内有少量蒸馏水 C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡 解析:(1)使用托盘天平的步骤为:调零→放砝码→调游码→加物品→取物品→取砝码→游码回零. (2)只缺少量晶体时,应用右手轻轻拍打左手手腕,小心振动药匙加足药量. (3)溶解所需的仪器有烧杯、玻璃棒. (4)误差分析根据c==,由m、V的大小判断.A将砝码放错位置后,称BaCl2为4.8 g,偏低.B无影响,C摇匀后再加水即增大了溶液体积,偏低.D不振荡,溶液不均匀. 答案:(1)C F E D B (2)左手拿药匙,用右手轻轻拍左手手腕,小心振动药匙加足药量,使天平平衡 (3)烧杯、玻璃棒 250 mL容量瓶 洗涤 定容 摇匀 (4)A、C查看更多